


淀粉样肽(β-amyloid,Aβ)的沉积被认为是神经元损伤的主要原因,不溶解的Aβ 对神经元具有毒性作用。目前的很多研究致力于阐明Aβ引发的神经元凋亡机制,但仍无有效的针对性手段。在Aβ诱导的神经元凋亡实验中,Shoji等[1]发现JNK信号转导途径在阿尔采末病(Alzheimer′s disease,AD)的发病过程中参与了早期老年斑的形成,造成弥散性Aβ沉积,并激活脑内神经元中的JNK。后者依次激活几种关键转录因子,而这些因子的激活是Aβ诱导下游Fas受体介导的凋亡途径所依赖的,随后Fas配体(Fas Ligand,FasL)与受体Fas结合,诱导caspase级联反应,最终导致神经元凋亡[2]。
已有研究表明,黄酮类天然产物具有抗氧化、抗肿瘤、抑制酪氨酸蛋白激酶(tyrosine protein kinase,TPK)活性和细胞凋亡等作用[3]。染料木素(genistein,GEN)是大豆异黄酮中的一种成份,越来越多的研究显示,GEN在抗肿瘤、心脏病、骨质疏松症和认知功能障碍[4]中具 有重要作用。GEN在Aβ(25-35)诱导的神经元凋亡通路中的保护效应越来越受到关注,但其抗Aβ毒性的分子机制还需要进一步阐明。本研究探讨了GEN对Aβ(25-35)诱导的PC12细胞凋亡的分子保护机制,检测了Fas凋亡通路相关基因的表达以及JNK磷酸化激活的情况,为GEN治疗Aβ所致的神经退行性疾病提供依据。
1 材料与方法 1.1 材料高分化PC12细胞(中国科学院上海细胞所);GEN、Aβ(25-35)(Sigma公司);TRIzol(Invitrogen公司);SYBR® Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)、PrimeScriptTM RT Master Mix (Perfect Real Time)(TaKaRa公司); caspase-3和caspase-8活性检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、SP600125(碧云天生物技术公司);Phospho-SAPK/JNK(Thr183/Tyr185)抗体、SAPK/JNK 抗体 (CST公司);Rabbit anti-β-actin、Goat anti-rabbit IgG(γ-chain specific)(博士德公司);酶标仪(Biotek)、实时定量PCR仪(Biorad);荧光显微镜(Leica公司);流式细胞仪(BD Biosciences公司);引物合成(上海生工)。
1.2 细胞培养高分化PC12细胞在含有10%新生胎牛血清、100 kU·L-1青霉素和100 mg·L-1链霉素的RPMI 1640培养液中,37℃、5% CO2条件下常规培养。每2 d更换一次培养液。待细胞丰度达80%后用0.25%胰酶消化传代,实验用细胞均处在对数生长期。
1.3 MTT实验取对数生长期的细胞,按照1×105/孔的密度接种于96孔板中,常规培养。24 h后预先添加(0、12.5、25、50、100 μmol·L-1)GEN作用2 h,然后用20 μmol·L-1的Aβ(25-35)处理24 h。常规MTT方法在酶标仪测出各孔的吸光度(A值)。实验中,每个浓度组设置6个复孔,分别计算各浓度组吸光度平均值与对照组相比的抑制程度,实验重复3次,根据公式计算细胞存活率。细胞存活率/%=(A实验组-A空白组)/ (A正常对照组-A空白组)×100%。
1.4 流式细胞仪检测细胞凋亡取对数生长期的细胞,按照1×106/孔的密度接种于6孔板中,常规培养,24 h后预先添加(0、12.5、25、50 μmol·L-1)GEN作用2 h,然后用20 μmol·L-1的Aβ(25-35)处理24 h。把细胞培养液吸出至一合适离心管内,PBS洗涤贴壁细胞1次,每孔加入500 μL 0.25%胰酶消化细胞,然后加入上述的培养液终止消化,转移到1.5 mL离心管内,1 000×g离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,再加入5 μL Annexin V-FITC,轻轻混匀,加入10 μL碘化丙啶(PI)染色液,轻轻混匀。室温避光孵育10 min,在激发波长488 nm,发射波长530 nm的流式细胞仪下检测,Annexin V-FITC为绿色荧光,PI为红色荧光。定量分析凋亡细胞百分比。实验重复3次,并采用SPSS 20.0软件对数据进行统计学分析。
1.5 RNA提取和实时荧光定量PCR(qPCR)检测取对数生长期的细胞,按照1×106/孔的密度接种于6孔板中,常规培养,24 h后预先添加25 μmol·L-1GEN作用2 h,然后用20 μmol·L-1的Aβ(25-35)处理24 h,SP600125 (100 nmol·L-1) 先于Aβ(25-35) 1 h前加入。药物处理后,根据Invitrogen公司生产的TRIzol的操作手册进行总RNA的提取。取1 μg的总RNA在10 μL反应体系下,用TaKaRa公司的PrimeScriptTM RT Master Mix (Perfect Real Time)进行第一链cDNA的合成。下面的引物用于qPCR反应:β-actin F,5′-CACTTTCTACAATGAGCTGCG-3′,β-actin R,5′-CTGGATGGCTACGTACATGG-3′;Fas F,5′-CCCGGACCCAGAATACCAAG-3′,Fas R,5′-GTTCGTGTGCAAGGCTCAAG-3′;FasL F,5′-GAACTGGCAGAACTCCGTGA-3′,FasL R,5′-TGTGCTGGGGTTGGCTATTT-3′;caspase-3 F,5′-GAGACAGACAGTGGAACTGACGATG-3′,caspase-3 R,5′-GGCGCAAAGTGACTGGATGA-3′;caspase-8 F,5′-GAGCTGCCAGTTTCTGTTTTG-3′,caspase-8 R,5′-GTTGAAGATCAGACAGTACCCC-3′。反转录合成的cDNA用TaKaRa公司的SYBR® Premix Ex TaqTM II (Tli RNaseH Plus),采取20 μL体系两步法进行qPCR反应,反应条件:95℃30s,95℃ 5s,60℃30s,40个循环。实时定量PCR仪检测各个基因,基于CT(threshold cycle)值法,采用2-ΔΔCt分析,每个样本的mRNA含量用各内参β-actin进行标准化。
1.6 Western blot 检测JNK及p-JNK蛋白表达取对数生长期的细胞,按照1×106/孔的密度接种于6孔板中,常规培养,24 h后预先添加25 μmol·L-1 GEN作用2 h,然后用20 μmol·L-1的Aβ(25-35)处理24 h,SP600125 (100 nmol·L-1) 先于Aβ(25-35) 1h前加入。药物处理后收集细胞,并得到细胞裂解液,BCA测得各自浓度,调整各样品浓度一致,100℃沸水煮沸5 min,10%分离胶,5%浓缩胶,80 V 30 min,120 V 60 min SDS-PAGE电泳分离蛋白质。200 mAh,60 min湿转。转膜结束,5%脱脂奶粉25 r·min-1摇床,封闭2 h。一抗(JNK,p-JNK)1 ∶ 2 000,TBST稀释,4℃孵育过夜,TBST洗2次,再用TBS洗1次,每次5 min;二抗(goat anti-rabbit IgG)1 ∶ 4 000孵育1 h,TBST洗3次,再用TBS洗1次,每次10 min。ECL发光显色,曝光,扫描。
1.7 caspase活性检测取对数生长期的细胞,按照1×106/孔的密度接种于6孔板中,常规培养。按“1.6”药物处理后,采用分光光度法,参照说明书测定caspase-3或caspase-8的酶活性。
1.8 统计学处理 实验数据以 表示,两样本均数间比较用Student′s t检验,多样本均数间比较用单因素方差分析(one-way ANOVA),组间两两比较用LSD检验,采用SPSS 20.0软件对数据进行统计学分析。
表示,两样本均数间比较用Student′s t检验,多样本均数间比较用单因素方差分析(one-way ANOVA),组间两两比较用LSD检验,采用SPSS 20.0软件对数据进行统计学分析。
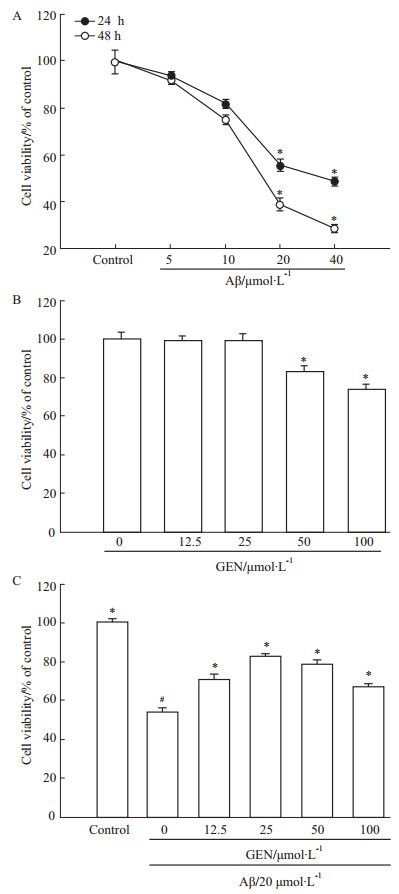
为观察GEN在Aβ诱导的PC12的保护作用,首先,用不同浓度Aβ(0~40 μmol·L-1)作用PC12细胞24 h和48 h,结果显示,Aβ明显降低PC12细胞存活率,最小剂量是20 μmol·L-1(P<0.05 vs control)(Fig1A)。随后我们检测GEN在没有Aβ诱导下对PC12细胞活力的影响,GEN(0~100 μmol·L-1)作用PC12细胞24 h,结果显示,0~25 μmol·L-1 GEN对细胞活力几无影响,而50和100 μmol·L-1 GEN使细胞存活率明显降低(Fig1B)。进一步检测GEN对Aβ诱导的PC12细胞存活率的影响,PC12预先与不同浓度GEN(0~100 μmol·L-1)孵育2 h,再继续用20 μmol·L-1的Aβ分别共同处理24 h。结果显示,20 μmol·L-1 Aβ单独组明显减少PC12细胞存活率(P<0.05 vs control),GEN (12.5、25、50和100 μmol·L-1)+ Aβ组细胞活力都高于Aβ单独组(P<0.05 vs Aβ alone),然而50 μmol·L-1和100 μmol·L-1 GEN处理组细胞存活率明显低于25 μmol·L-1 GEN组,故25 μmol·L-1剂量的GEN具有最大的保护作用(Fig1C)。
|
Fig 1
Prevention of Aβ(25-35) induced cell apoptosis by GEN( )
A: Dose-dependent changes of cell viability of PC12 cells by Aβ treatment. *P<0.05 compared to Aβ control; B: Cells were treated with genistein (0, 12.5, 25, 50 and 100 μmol·L-1) for 24 h. *P<0.05 compared with control; C: Cells were pretreated with genistein (0, 12.5, 25, 50 and 100 μmol·L-1) for 2 h followed by exposure to 20 μmol·L-1 Aβ(25-35) for 24 h. #P<0.05 compared to control; *P<0.05 compared to Aβ alone. Cell viability was evaluated by MTT assay )
A: Dose-dependent changes of cell viability of PC12 cells by Aβ treatment. *P<0.05 compared to Aβ control; B: Cells were treated with genistein (0, 12.5, 25, 50 and 100 μmol·L-1) for 24 h. *P<0.05 compared with control; C: Cells were pretreated with genistein (0, 12.5, 25, 50 and 100 μmol·L-1) for 2 h followed by exposure to 20 μmol·L-1 Aβ(25-35) for 24 h. #P<0.05 compared to control; *P<0.05 compared to Aβ alone. Cell viability was evaluated by MTT assay
|
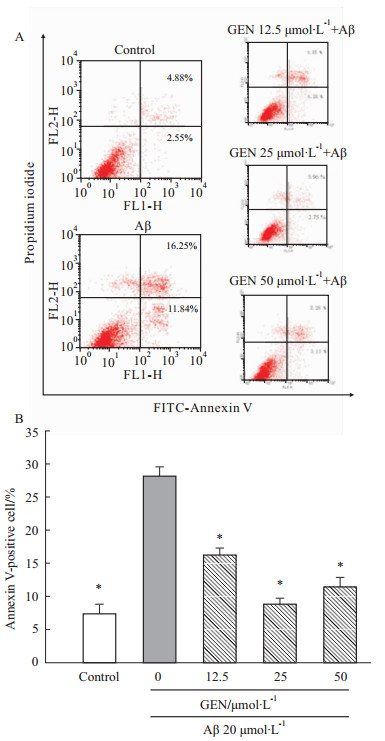
为了进一步证实GEN对Aβ诱导的PC12细胞的保护效应及其GEN最佳浓度的选择。Annexin V-FITC双染法检测GEN(12.5、25、50 μmol·L-1)对Aβ诱导的PC12细胞的凋亡情况(Fig2A)。定量分析Annexin V-FITC凋亡细胞百分比结果显示,Aβ(25-35)诱导的PC12细胞凋亡百分比明显高于对照组(P<0.05),GEN作用组(12.5、25、50 μmol·L-1)都明显抑制Aβ诱导的细胞凋亡(P<0.05),其中,25 μmol·L-1剂量的GEN具有最大抑制效应(Fig2B)。因此,25 μmol·L-1的GEN被运用到后续的实验。
|
| Fig 2 GEN pretreatment attenuates Aβ(25-35) induced cell apoptosis A:Annexin-V-FITC/PI double staining of PC12 cells; B: The bar chart describes the percentage distribution of apoptotic cells. Percentage of annexin-V-positive cells analysis of FACS obtained from three separate experiments and are expressed as mean ± SD, n=3; *P<0.05 compared to Aβ alone. |
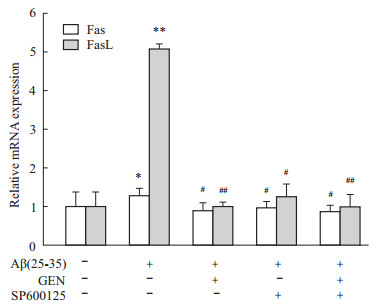
Fas凋亡途径是凋亡机制的重要通路,在Aβ诱导的神经元凋亡机制研究中,Aβ诱导的JNK的激活和调控Fas受体介导的细胞凋亡已有研究[2]。为探讨GEN对Aβ诱导的PC12的抗凋亡机制,我们用RT-qPCR检测Fas通路2个重要基因Fas和FasL mRNA表达情况。RT-qPCR统计结果显示,Aβ诱导组明显增加FasL的表达,温和上调Fas的表达(P<0.05或0.01 vs control),Aβ诱导引起Fas和FasL表达的增加与报道吻合[2]。GEN组明显减少Aβ诱导的Fas、FasL的增加,同时,JNK抑制剂SP600125也可减少Fas、FasL的表达,GEN+SP600125合用组同样明显抑制Fas、FasL的表达,抑制作用与GEN组相当(P<0.05或0.01 vs Aβ组),见Fig3。
|
Fig 3
Effect of GEN on the mRNA of Fas and FasL in PC12 cells detected by real-time PCR( )
PC12 cells were pretreated with or without GEN at concentrations of 25 μmol·L-1 for 2 h followed by exposure to 20 μmol·L-1 Aβ(25-35) for 24 h. SP600125 (100 nmol·L-1) was added to cultures 1 h prior to Aβ(25-35). *P<0.05, **P<0.01 compared to control; #P<0.05, ##P<0.01 compared to Aβ alone. )
PC12 cells were pretreated with or without GEN at concentrations of 25 μmol·L-1 for 2 h followed by exposure to 20 μmol·L-1 Aβ(25-35) for 24 h. SP600125 (100 nmol·L-1) was added to cultures 1 h prior to Aβ(25-35). *P<0.05, **P<0.01 compared to control; #P<0.05, ##P<0.01 compared to Aβ alone.
|
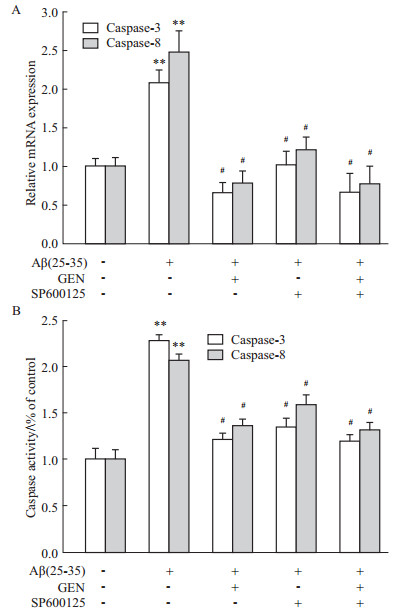
在Fas凋亡机制中,caspase级联反应是凋亡关键过程。为进一步探讨GEN对Aβ刺激引起的Fas和FasL的调控以及与JNK的关系,首先采用RT-qPCR检测caspase-3和caspase-8基因的表达。RT-qPCR统计结果显示,GEN组、JNK抑制剂SP600125组和GEN+SP600125合用组均明显下调caspase-3和caspase-8基因的表达(P<0.05 vs Aβ 组)(Fig4A)。GEN对caspase-3和caspase-8基因的调控作用进一步被caspase酶活性测定证实,与Aβ组相比,JNK抑制剂SP600125和GEN都可对Aβ刺激引起的caspase-3和caspase-8酶活力的增强起抑制作用(Fig4B)。
|
Fig 4
Effect of GEN on the mRNA and activity of caspase-3 and caspase-8 in PC12 cells( ,n=3)
The mRNA expression was detected by real-time PCR, and the activity expression was detected by colorimetric assay. PC12 cells were pretreated with or without GEN at concentrations of 25 μmol·L-1 for 2 h followed by exposure to 20 μmol·L-1 Aβ(25-35) for 24 h. SP600125 (100 nmol·L-1) was added to cultures 1 h prior to Aβ(25-35). **P<0.01 compared to control; #P<0.05 compared to Aβ alone. ,n=3)
The mRNA expression was detected by real-time PCR, and the activity expression was detected by colorimetric assay. PC12 cells were pretreated with or without GEN at concentrations of 25 μmol·L-1 for 2 h followed by exposure to 20 μmol·L-1 Aβ(25-35) for 24 h. SP600125 (100 nmol·L-1) was added to cultures 1 h prior to Aβ(25-35). **P<0.01 compared to control; #P<0.05 compared to Aβ alone.
|
Aβ诱导引起JNK的激活已被证实[2],为探讨GEN对Aβ刺激引起的JNK激活的调控,我们检测了p-JNK和总JNK蛋白表达情况。相对于Aβ单独组,p-JNK 54和46 ku条带被GEN减弱(P<0.05 vs Aβ 组),JNK抑制剂SP600125也能明显减弱p-JNK 54和46 ku条带,两者合用效果最强(Fig5A、B)。
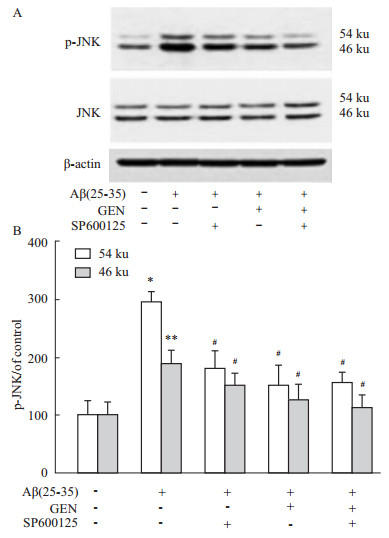
|
| Fig 5 GEN attenuates Aβ(25-35)-induced JNK phosphorylation detected by Western blot PC12 cells were pretreated with or without GEN at concentrations of 25 μmol·L-1 for 2 h followed by exposure to 20 μmol·L-1 Aβ(25-35) for 24 h. SP600125 (100 nmol·L-1) was added to cultures 1 h prior to Aβ(25-35). A: JNK and p-JNK levels were determined by immunoblot analysis with antibody to JNK and p-JNK; B: Quantitative results of p-JNK are presented compared to control. Densitometric analysis of Western blot obtained from three separate experiments, and data are expressed as mean ± S.D, n=3. **P<0.01 compared to control; #P<0.05 compared to Aβ alone. |
目前,许多关于AD病理机制的研究集中在Aβ的沉积。在体外研究发现,神经元突起退化与Aβ的表达有关联[5]。注射Aβ至大鼠脑部会引起神经元损伤[6]。Aβ诱导的神经元凋亡是涉及到各种信号通路的细胞死亡的一个基本过程。
GEN是大豆异黄酮的主要活性成份,口服可被小肠吸收[7]。有证据表明,GEN可穿过活体实验动物血脑屏障[8],在老年神经退行性疾病中,可以与雌激素受体结合发挥雌激素功能,促进神经元再生[9]。我们先前的研究发现,染料木素可通过增强PKC酶活性,调节α-/β-分泌酶活性,减少不溶性Aβ的形成和沉积,调节 Bcl-2 和Bax基因的表达水平,降低细胞的凋亡程度,从而抑制Aβ诱导的神经毒性作用[10, 11]。GEN调控与凋亡通路相关的信号机制愈加被阐明。
分子信号网络的协同作用决定了细胞的命运[12]。在许多的应激反应的信号转导通路中,JNK信号级联在维持细胞稳态和许多细胞活动中具有重要作用,比如细胞生长、转化、分化和凋亡[13]。强有力的证据表明,Aβ诱导的神经元凋亡与JNK激活密切相关[14]。JNK信号的激活调控一些基因的转录活性,包括Fas/FasL[14]。SP600125是JNK磷酸化激活的抑制剂,可以有效抑制Aβ诱导的Fas/FasL的表达,JNK激活是Aβ诱导的细胞凋亡中的 关键步骤[15]。因此,抑制JNK依赖的凋亡基因的表达可能是针对神经元凋亡的一种非常有效的治疗策略。JNK的激活调控Fas/FasL的表达,FasL与Fas聚合,然后通过胞质区的死亡结构域招募接头蛋白和caspase-8酶原,形成死亡诱导信号复合物(death-inducing signaling complex,DISC),进而激活caspase-3,导致细胞凋亡。我们目前的研究发现,Aβ诱导的PC12细胞凋亡涉及到JNK依赖的Fas/FasL的上调,GEN可明显减少Aβ诱导的Fas/FasL的表达,GEN还可明显降低Aβ诱导的JNK磷酸化水平,表明GEN对Aβ诱导的Fas/FasL表达的改变与JNK活性的抑制有关。
总之,我们的研究表明,GEN通过抑制Aβ诱导的PC12细胞JNK的磷酸化作用,进而下调Fas和FasL表达水平,降低caspase-3和caspase-8活性,发挥抑制Aβ毒性和神经元凋亡的保护作用。抑制JNK依赖的凋亡基因的表达可能是针对神经元凋亡的一种非常有效的治疗策略,但GEN可能是一种涉及到多机制的药物,其抗神经细胞凋亡机制还需进一步的研究。
| [1] | Shoji M, Iwakami N, Takeuchi S, et al. JNK activation is associated with intracellular beta-amyloid accumulation[J]. Brain Res Mol Brain Res, 2000, 85(1-2):221-33. |
| [2] | Morishima Y, Gotoh Y, Zieg J, et al. Beta-amyloid induces neuronal apoptosis via a mechanism that involves the c-Jun N-terminal kinase pathway and the induction of Fas ligand[J]. J Neurosci, 2001, 21(19):7551-60. |
| [3] | 张 珂, 马胜林. 天然药物抗肿瘤机制的研究进展[J]. 中华中医药杂志, 2011, 34(10):2344-7. Zhang K, Ma S L. Progress on anticancer molecule mechanism of naturally occurring drugs[J]. China J Tradit Chin Med Pharm, 2011, 34(10):2344-7. |
| [4] | Thorp A A, Sinn N, Buckley J D, et al. Soya isoflavone supplementation enhances spatial working memory in men[J]. Br J Nutr, 2009, 102(9):1348-54. |
| [5] | Horiuchi M, Maezawa I, Itoh A, et al. Amyloid beta 1-42 oligomer inhibits myelin sheet formation in vitro[J]. Neurobiol Aging, 2012, 33(3):499-509. |
| [6] | Miguel-Hidalgo J J, Vecino B, Fernandez-Novoa L, et al. Neuroprotective role of S12024 against neurodegeneration in the rat dentate gyrus[J]. Eur Neuropsychopharmacol, 1998, 8(3):203-8. |
| [7] | Picherit C, Coxam V, Oudadesse H, et al. Dihydrotestosterone prevents glucocorticoid-negative effects on fetal rat metatarsal bone in vitro[J]. Biol Neonate, 2000, 77(3):181-90. |
| [8] | Tsai T H. Concurrent measurement of unbound genistein in the blood, brain and bile of anesthetized rats using microdialysis and its pharmacokinetic application[J]. J Chromatogr A, 2005, 1073(1-2):317-22. |
| [9] | Lephart E D, Setchell K D, Handa R J, Lund T D. Behavioral effects of endocrine-disrupting substances:phytoestrogens[J]. ILAR J, 2004, 45(4):443-54. |
| [10] | Luo S, Lan T, Liao W, et al. Genistein inhibits Abeta(25-35)-induced neurotoxicity in PC12 cells via PKC signaling pathway[J]. Neurochem Res, 2012, 37(12):2787-94. |
| [11] | 赵美顺, 陈敬荣, 郑尧杰, 杨 红. 染料木素对Aβ诱导损伤的PC12细胞的保护作用[J]. 中国药科大学学报, 2014, 45(2):227-31. Zhao M S, Chen J R, Zheng Y J, Yang H. Protective effect of genistein on Aβ25-35-induced PC12 cells injury[J]. J China Pharm Univ, 2014, 45(2):227-31. |
| [12] | Jin Z, El-Deiry W S. Overview of cell death signaling pathways[J]. Cancer Biol Ther, 2005, 4(2):139-63. |
| [13] | Junttila M R, Li S P, Westermarck J. Phosphatase-mediated crosstalk between MAPK signaling pathways in the regulation of cell survival[J]. FASEB J, 2008, 22(4):954-65. |
| [14] | Yao M, Nguyen T V, Pike C J. Beta-amyloid-induced neuronal apoptosis involves c-Jun N-terminal kinase-dependent downregulation of Bcl-w[J]. J Neurosci, 2005, 25(5):1149-58. |
| [15] | Yao M, Nguyen T V, Pike C J. Estrogen regulates Bcl-w and Bim expression:role in protection against beta-amyloid peptide-induced neuronal death[J]. J Neurosci, 2007, 27(6):1422-33. |

