


2. 厦门市疾病预防与控制中心, 福建 厦门 361021
2. Xiamen Center for Disease Control and Prevention, Xiamen Fujian 361021, China
乙肝病毒 (HBV) 是迄今所有已知可感染人体并具有独立复制能力的双链DNA病毒中最小且最有效的病毒,仅含3.2 kb,属于嗜肝DNA病毒科。HBV可以引发急性和慢性肝炎,后者又可发展为肝硬化乃至肝癌。HBV感染呈全球性,全球约20亿人曾感染过HBV,其中3.5多亿人为慢性HBV感染患者,每年约有786 000人死于HBV感染所致的肝衰竭、肝硬化和原发性肝细胞癌 (HCC)[1]。美国食品药品监督管理局已批准两个Ⅰ型干扰素和5个核苷逆转录酶抑制剂用于乙肝的治疗,但临床效果仍然十分有限。虽然预防乙型肝炎的疫苗在很大程度上减少了慢性乙肝的发生,但疫苗接种覆盖率存在巨大的地域差异性,美国高达90%,而南亚仅占56%[1]。防治指南先后强调了抗病毒是治疗乙肝的重中之重,因而详细阐明HBV的复制机制,并以此为基础,寻找高效低毒的抗病毒作用靶点已成为防治工作者的研究重心,并可为新药研究发现奠定坚实的前期基础。
1 乙型肝炎病毒复制机制HBV一旦进入人体,病毒包膜表面上抗原大蛋白 (LHBs) N端27~46位氨基酸就与肝细胞膜上的钠离子-牛磺胆酸协同转运蛋白 (NTPC)[2] 结合,病毒颗粒通过受体介导的细胞内吞作用进入细胞,再由细胞微管系统转运至核孔复合物。HBV病毒是240个由两个核心蛋白(core protein,CP)以一定的夹角形成的二聚体亚单位,以一定的空间顺序结合形成的对称的20面体。病毒的CP经未知磷酸化机制暴露核内定位信号,与核孔复合物结合而脱去衣壳,HBV DNA进入核内,病毒颗粒由内吞到入核这一过程需要细胞内GTP激酶信号通路的参与。HBV DNA再经目前机制未明的修复正链缺口转变成超共价闭合环状DNA (cccDNA)。有研究在稳定转染HBV DNA和DHBV DNA的细胞株中分离到去蛋白rcDNA (protein free-rcDNA,PF-RC),并证明PF-RC是rcDNA到cccDNA转变过程的中间体,可能是在胞质核衣壳内,通过某种具有丝氨酸蛋白酶活性的物质切断P蛋白酪氨酸残基与负链5' 端磷酸基团间的磷酸二酯键形成的,rcDNA去蛋白化激发部分核衣壳解聚,暴露核定位信号,通过核孔复合体介导PF-RC转运到核内,然后由宿主细胞相关酶把PF-RC转化成cccDNA。用siRNA抑制核转运蛋白β1表达或表达功能缺陷的转运蛋白β1,均导致胞质PF-RC积聚,而胞核内PF-RC及cccDNA减少。细胞RNA多聚酶Ⅱ以cccDNA为模板,转录产生mRNA。病毒DNA聚合酶 (即P蛋白) 结合于pgRNA (前基因组RNA,也是3.5kb mRNA) 5' 端的茎环结构,促使pgRNA包裹入核心颗粒中,P蛋白TP区第63位酪氨酸残基上的羟基与GTP共价结合引发合成5'-GAAT-3' 的四聚DNA引物,P蛋白与该引物转位到pgRNA3' 端DR1区,以pgRNA为模板转录合成互补性负链DNA,同时DNA聚合酶的RNAse H (核糖核酸酶H) 切割模板pgRNA,仅保留5' 端完整的DR1片段,与该片段互补的短小RNA脱离并附着在负链5' 端,引导正链合成。当合成延伸到负链5' 端时,DNA聚合酶模板切换至负链3' 端继续合成正链DNA,形成松弛环状DNA (rcDNA),再移去共价结合在负链5' 端的病毒聚合酶和正链5' 端的短链RNA低聚物 (用于启动),就形成了cccDNA。正链合成启动时,核心颗粒结构改变,成为成熟的核心颗粒,可与表面抗原相互识别,以芽生的方式形成完整病毒颗粒。包裹着衣壳的HBV-DNA再由膜包裹后分泌到细胞外,也可以重新脱去衣壳进入细胞核内,以维持细胞核内cccDNA的数量(Fig1)
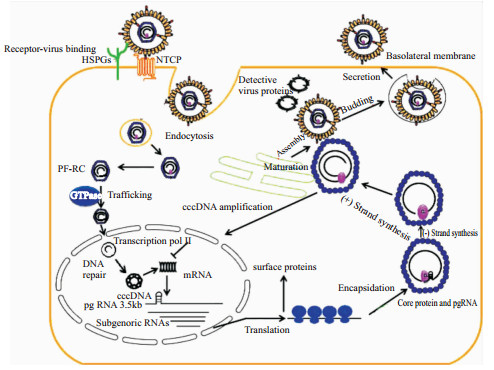
|
| Fig 1 Model of hepatitis B virus life cycle in hepatocytes |
就理论而言,病毒复制的各个阶段都有可能成为药物靶点。故针对病毒的吸附、穿入、脱壳、生物合成及装配分泌各阶段特点,选择相应的有效药物去阻断其生命周期,从而实现抑制乙肝病毒繁殖、扩散。
2.1 病毒复制药物靶点 2.1.1 吸附吸附 (adsorption) 是指病毒附着于易感细胞的表面,它是感染的起始期。细胞与病毒相互作用最初是偶然碰撞和静电作用,这是可逆的联结,随后的特异性吸附是非常重要的。Yan等[2]对乙肝病毒结合受体的肽段 (Pre-S1的2至48氨基酸)[4, 5]进行结构修饰,并将其作为探针,用中国科学家1980年发现的树鼩为肝细胞来源,得到原代培养的树鼩肝细胞 (PTH),应用强有力的现代生物化学技术,寻找结合Pre-S1肽段的蛋白质,发现了钠离子-牛磺胆酸协同转运多肽 (NTCP)。NTCP在肝脏内起着转运胆酸和钠离子的作用,胆汁盐及其衍生物就有可能发展成为潜在药物[6],乙型肝炎和丁型肝炎病毒正是利用这一正常蛋白,与之结合并发挥作用。我们可以设计可溶性受体结合物,以防止病毒与受体的结合,有文献报道环胞霉素及其衍生物可以阻断HBV与NTCP的相互作用[7]。亦有文献报道HBV易感细胞表面表达NTCP受体,而非易感细胞不表达。此外,HSPGs作为共受体在人体内普遍存在,非特异性与HBV病毒作用[3]。与此同时,HepG2-hNTCP-C4细胞株的构建有助于探索抑制HBV进入宿主细胞的新型抗HBV药物[8]。
2.1.2 穿入和脱壳穿入 (penetration) 是指病毒核酸或感染性核衣壳穿过细胞膜进入胞质。HBV是包膜病毒,以融合形成内吞体的方式进入细胞,随着内吞体pH的降低,包膜蛋白构象发生变化,病毒包膜与内吞体膜融合,释放到细胞质中。内吞作用、内吞体与HBV病毒包膜的融合已被提议作为潜在的用药途径[9]。脱壳的具体过程不得而知,但病毒进入细胞质后,发生衣壳蛋白磷酸化,可以针对这一点通过抑制衣壳蛋白磷酸化来阻断感染。
2.1.3 生物合成生物合成 (biosynthesis) 是指病毒核酸复制和病毒蛋白质合成的过程,酶在该过程起着关键性作用,因而针对病毒酶的抗病毒药物也一直是防治研究的重点之一,通过竞争性地与酶结合来抑制病毒复制。目前,临床应用和正在开发阶段的抗HBV药物多是DNA聚合酶抑制剂,因其对cccDNA无明显影响,停药后多出现反弹,可能是cccDNA异常稳定或者DNA聚合酶抑制剂效能低,这就需要寻求高效DNA聚合酶抑制剂,并深入研究cccDNA合成的生化机制,寻找可行的分子靶点。cccDNA是HBV复制的中间体,是HBV mRNA和pgRNA的合成模板,也是HBV持续感染的关键因素,是病毒活跃复制状态的重要指标,是HBV生活周期的核心部分。在乙肝相关性HCC中,cccDNA与X蛋白相互作用、相互影响,cccDNA可能通过增加X蛋白的表达并通过其作用而致癌,X蛋白也调控着cccDNA的转录,使得HBV的复制处于活跃状态[10]。X蛋白的作用越来越受到重视,但迄今仍缺少突破性的发现。最近对非编码RNA的研究十分活跃,研究显示非编码RNA在细胞周期发挥的作用远远超乎人类以前的认知,或许为探索cccDNA调控提供新的思路[11]。
2.1.4 装配(或组装)新合成的病毒核酸和病毒核心蛋白在感染细胞内组合成病毒颗粒的过程称为装配或组装 (assembly)。病毒颗粒的装配是由病毒和细胞的蛋白,以及病毒pgRNA参与的复杂的多分子相互作用的过程,而核心蛋白的作用尤为突出。核心蛋白C末端鱼精蛋白样区150~183位高精氨酸区域,核心蛋白第5螺旋区的113和117位氨基酸的负电荷和C端155、162和170位丝氨酸的磷酸化在病毒pgRNA的壳体化和病毒复制过程中起着重要作用[12]。HBV包膜蛋白的前S1区、胞质侧SLOOP区与核心蛋白亚单位的钉突之间可以相互作用,有研究表明,表面刺突根部环样凹槽处和核衣壳表面的小孔附近,可能是病毒核衣壳同包膜蛋白的结合位点[13]。为以包膜过程为作用靶点的抗病毒药物设计提供强有力的证据。
研究发现,小分子bis-ANS可以和一个自由核心蛋白二聚体结合,改变核心蛋白的几何形状,进而影响衣壳装配,这类小分子可能代表一类新型抗病毒剂[14]。与改变构成二聚物两个核心蛋白夹角的bis-ANS原理不同,Stray等[15]发现的二氢嘧啶类(HAP)化合物可诱导活化核衣壳的装配,装配成异常的不稳定的非核衣壳颗粒,并加速正常核衣壳颗粒的降解,例如Bay41-4109和Bay39-5493,研究表明它们并没有影响二聚物的形成,只是改变了二聚物之间的夹角。亚氨糖类化合物N-DNJ、N-DGJ也可使病毒核衣壳的数量大大减少,但其分子作用机制尚不清楚,推测该类化合物可能同HAP、bis-ANS具有相似的作用机制。苯丙烯酰胺类化合物AT-61和AT-130可能是通过加快HBV核心颗粒的装配速度,抑制了前基因组pgRNA装配入壳[16]。Yang等[17]发现一种非核苷类化合物可以抑制pgRNA与乙肝核心抗原(HBcAg)的结合,从而抑制pgRNA装配入壳。此外,HBV是自组装,不需要支架蛋白(包括分子伴侣)辅助装配,但有研究表明,分子伴侣热激蛋白90可通过与HBV核心蛋白二聚体结合促进HBV病毒颗粒的产生[18](Fig2)。
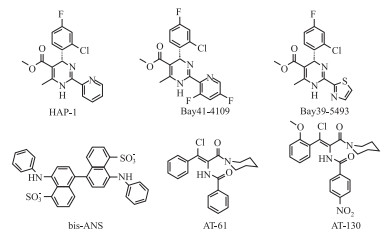
|
| Fig 2 Representative HBV capsid assembly inhibitors |
从HBV病毒内产生病毒颗粒和其它物质的过程叫分泌(secretion)。有研究发现的苯并咪唑类衍生物BM601在不影响乙肝e抗原(HBeAg)、宿主蛋白分泌和细胞应激反应的情况下,干扰表面抗原在高尔基体的聚集来抑制病毒颗粒和乙肝表面抗原(HBsAg)的分泌[19]。
鉴于HBV为迄今已知所有可感染人体并具有独立复制能力的双链DNA病毒中最小且最有效的病毒,人类经过长期的奋斗,人们逐渐开拓治疗的新方略,其中包括:
(1) 用小分子作用于病毒的变构效应以实现衣壳蛋白、糖蛋白错配不失为抗病毒良策之一,而且在已发表的HBV的文章得到佐证。
(2) 在HBV组装时,分为两个不同领域应对,把自组装和组装调控分开,各个击破。调控是在变构水平上进行,即调控分子构象的变化,细胞周期一般是蛋白改变其活动,这些蛋白是由效应分子诱导的;调控过程还需要病毒和宿主因子参与。阻隔调控是一个理想的抗病毒治疗的目标,而目前直接实现对病毒组装物理化学性质的调控仍处于初始探索阶段。
(3) 成核过程是成核单元先形成成核核心,在足够成核单元存在下装配成功;如果成核单元形成成核核心的过程过快,导致余下的成核单元装配不顺利;也有可能在成核过程中,成核单元结合不牢固[20]。
(4) 研究发现,阳离子细胞穿透肽 (CPP) 及其脂肪共轭域 (CatLip) 可以携带不带电荷的生物活性分子进入细胞内。使用感染和转染实验,发现CatLip肽能引起包膜蛋白的积累,导致PreS/S结构域发生严重变化,从而抑制鸭乙型肝炎病毒复制,变性的CPP也为抗病毒治疗提供了新靶点[21]。
2.2 宿主抗病毒靶点HBV病毒本身没有细胞毒性,通过多种机制降低机体免疫应答,以致不能有效清除病毒,使机体长期处于较弱的免疫应答,造成肝损伤,肝功能下降,故我们也可以以宿主免疫应答过程中的功能蛋白为作用靶点寻找治疗方法。
2.2.1 纤连蛋白纤连蛋白[22]在HepG2.2.15细胞中表达上调,同时纤连蛋白可以和HBV以一种物种限制的方式结合,在用纤连蛋白反义寡核苷酸、纤连蛋白抗体、原儿茶醛 (PA) 抑制纤连蛋白表达的实验中,发现HBV的数量随着纤连蛋白表达量的减少而降低。此外,还发现抑制纤连蛋白的表达可以提高HBV病毒对抗HBV药物的敏感性,这样纤连蛋白可能成为乙肝治疗的潜在靶点。
2.2.2 蛋白激酶SRPK1和SRPK2研究发现,蛋白激酶SRPK1和SRPK2是丝氨酸磷酸化的关键激酶,磷酸化过程对pgRNA的装配是非常重要的[23],推测可能是通过磷酸化核心蛋白来实现对HBV复制的控制。但有研究发现SRPK1和SRPK2是通过非磷酸化的途径抑制病毒复制[24],而不是磷酸化过程,具体机制还需深入研究。
2.2.3 分子伴侣分子伴侣在细胞内促进折叠、成熟、装配、转运,这些过程都要消耗ATP。在一定浓度的热休克蛋白抑制剂的作用下,病毒的活力不受影响,但病毒复制对此很敏感,因为伴侣调节许多细胞功能,包括信号网络、细胞周期和凋亡,病毒可操纵细胞的分子伴侣,以此利于病毒复制。热休克蛋白受到抑制后,可导致病毒聚合酶的降解,减少病毒基因表达,其作用对象可以是结构蛋白,也可以是非结构蛋白,例如Hsp90[25]。
2.2.4 SBP蛋白从病人体内分离的表面抗原在人肝脏cDNA库中筛选,发现一个新的表面抗原结合蛋白 (SBP) 和人的IgG重链结构相似,其N端结构域和表面抗原结合,带负电荷的SBP N端和带正电荷的HBsAg结合,SBP上的Fc片段更容易和酰基载体蛋白 (ACP) 上的Fc受体结合,促进ACP摄取HBsAg。实验也证实SBP可以促进树突细胞有效摄取表面抗原,并提高乙肝疫苗的免疫性[26]。
2.3 新辟蹊径Soulis和Boeke首次提出一种新的抗病毒策略:即核衣壳导向的病毒灭活 (capsid targeted viral inactivation,CATI),并将其用于逆转录病毒的实验治疗。CATI的基本原理是构建一种逆转录病毒衣壳蛋白,将其与某种对病毒具有破坏作用的蛋白融合,利用衣壳蛋白自组装的特性,将该融合蛋白装配于逆转录病毒的核衣壳中,发挥其抗病毒作用。由于乙肝病毒的复制过程类似于逆转录病毒,利用CATI原理制备融合蛋白用于治疗乙肝病毒的感染,在理论上具有高特异性、高效性、不易出现抗性株以及可采取常规给药方法等优点,具有诱人的应用前景。
新研究发现一种新的抑制HBV转录的方法,即将非共轭高亲和力的LNA-TFO转运入细胞核,这种方法是最有效且最持久的,该发现强调了LNA寡核酸 (锁核苷酸) 介导的特定序列基因沉默作为抑制病毒的一种新型的潜在的强大工具。
英国《每日邮报》网站7月22日报道:科学家采用基因剪辑技术,将一种被称为核酸酶的DNA剪切酶与一种被称为向导核糖核酸(gDNA)的RNA结合在一起瞄准病毒的基因组,实现首次从人类DNA中“删除”艾滋病毒,可以考虑将该方法用于HBV DNA的删除。
3 结语尽管HBV感染会引起严重的肝组织病理改变和肝功能损伤,但其本身是没有细胞毒作用的。肝组织病理改变和肝功能损伤实际上是宿主免疫系统与受感染的肝细胞相互作用的结果,而这又取决于病毒复制水平高低和宿主免疫力强弱[27]。这就要求我们既要研究病毒复制的具体机制,又要了解病毒进入人体后引发的免疫反应,详细了解机体免疫应答可帮助我们详细了解乙肝的慢性化机制,抑制乙肝恶化。
综上所述,人们在对慢型HBV感染的治疗研究已取得了很大的进展,但目前应用于临床的抗病毒药物和治疗方案尚需要进一步提高[27, 28]。相信随着人们对HBV复制机制、机体免疫应答机制的深入了解,将会发现更多的药物作用靶点,为开发高效低毒的新型药物指明方向。
| [1] | Trépo C, Chan H L, Lok A. Hepatitis B virus infection[J]. Lancet, 2014, pii:S0140-6736(14)60220-8. |
| [2] | Yan H, Zhong G, Xu G, et al. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus[J]. Elife, 2012, 1:e00049. |
| [3] | Ezzikouri S, Ozawa M, Kohara M, et al. Recent insights into hepatitis B virus-host interactions[J]. J Med Virol, 2014, 86(6):925-32. |
| [4] | Barrera A, Guerra B, Notvall L, Lanford R E. Mapping of the hepatitis B virus pre-S1 domain involved in receptor recognition[J]. J Virol, 2005, 79(15):9786-98. |
| [5] | Engelke M, Mills K, Seitz S, et al. Characterization of a hepatitis B and hepatitis delta virus receptor binding site[J]. Hepatology, 2006, 43(4):750-60. |
| [6] | Yan H, Peng B, Liu Y, et al. Viral entry of hepatitis B and d viruses and bile salts transportation share common molecular determinants on sodium taurocholate cotransporting polypeptide[J]. J Virol, 2014, 88(6):3273-84. |
| [7] | Watashi K, Sluder A, Daito T, et al. Cyclosporin A and its analogs inhibit hepatitis B virus entry into cultured hepatocytes through targeting a membrane transporter NTCP[J]. Hepatology, 2014, 59(5):1726-37. |
| [8] | Iwamoto M, Watashi K, Tsukuda S, et al. Evaluation and identification of hepatitis B virus entry inhibitors using HepG2 cells overexpressing a membrane transporter NTCP[J]. Biochem Biophys Res Commun, 2014, 443(3):808-13. |
| [9] | Grimm D, Thimme R, Blum H E. HBV life cycle and novel drug targets[J]. Hepatol Int, 2011, 5(2):644-53. |
| [10] | 潘爱萍, 黄古叶, 陈 晶, 何燕玲. 乙型肝炎病毒cccDNA与HBx蛋白在肝细胞性肝癌中表达的关系及意义[J]. 世界华人消化杂志, 2009, 17(7):712-5. Pan A P, Huang G Y, Chen J, He Y L. Relationship between hepatitis B virus covalently closed circular DNA and HBx protein expression in hepatocellular carcinoma and its signifi cance[J]. World J Gastroenterol, 2009, 17(7):712-5. |
| [11] | Kapranov P, Cawley S E, Drenkow J, et al. Large-scale transcriptional activity in chromosomes 21 and 22[J]. Science, 2002, 296(5569):916-9. |
| [12] | 赵国明, 夏广强, 朱学军. 以核衣壳为靶点的抗乙型肝炎病毒药物研究进展[J]. 国外医学·药学分册, 2006, 33(6):432-5. Zhao G M, Xia G Q, Zhu X J. Progress int the nucleocapsid targeting anti-hepatitis B virus drug research[J]. Sect Pharm Foreign Med Sci, 2006, 33(6):432-5. |
| [13] | Ponsel D, Bruss V. Mapping of amino acid side chains on the surface of hepatitis B virus capsids required for envelopment and virion formation[J]. J Virol, 2003, 77(1):416-22. |
| [14] | Zlotnick A, Ceres P, Singh S, Johnson J M. A small molecule inhibits and misdirects assembly of hepatitis B virus capsids[J]. J Virol, 2002, 76(10):4848-54. |
| [15] | Stray S J, Bourne C R, Punna S, et al. A heteroaryldihydropyrimidine activates and can misdirect hepatitis B virus capsid assembly[J]. Proc Natl Acad Sci USA, 2005, 102(23):8138-43. |
| [16] | Delaney WE 4th, Edwards R, Colledge D, et al. Phenylpropenamide derivatives AT-61 and AT-130 inhibit replicat ion of wild-type and lamivudine-resistant strains of hepatitis B virus in vitro[J]. Antimicrob Agents Chemother, 2002, 46(9):3057-60. |
| [17] | Yang L, Shi L P, Chen H J, et al. Isothiafludine, a novel non-nucleoside compound, inhibits hepatitis B virus replication through blocking pregenomic RNA encapsidation[J]. Acta Pharmacol Sin, 2014, 35(3):410-8. |
| [18] | Shim H Y, Quan X, Yi Y S, Jung G. Heat shock protein 90 facilitates formation of the HBV capsid via interacting with the HBV core protein dimers[J]. Virology, 2011, 410(1):161-9. |
| [19] | Xu Y B, Yang L, Wang G F, et al. Benzimidazole derivative, BM601, a novel inhibitor of hepatitis B virus and HBsAg secretion[J]. Antiviral Res, 2014, 107:6-15. |
| [20] | Zlotnick A, Mukhopadhyay S. Virus assembly, allostery and antivirals[J]. Trends Microbiol, 2011, 19(1):14-23. |
| [21] | Abdul F, Ndeboko B, Buronfosse T, et al. Potent inhibition of late stages of hepadnavirus replication by a modified cell penetrating peptide[J]. PLoS One, 2012, 7(11):e48721. |
| [22] | Yang J, Ding X R, Zhang Y, et al. Fibronectin is essential for hepatitis B virus propagation in vitro:may be a potential cellular target[J]. Biochem Biophys Res Commun, 2006, 344(3):757-64. |
| [23] | Kann M, Sodeik B, Vlachou A, et al. Phosphorylation-dependent binding of hepatitis B virus core particles to the nuclear pore complex[J]. J Cell Biol, 1999, 145(1):45-55. |
| [24] | Zheng Y, Fu X D, Ou J H. Suppression of hepatitis B virus replication by SRPK1 and SRPK2 via a pathway independent of the phosphorylation of the viral core protein[J]. Virology, 2005, 342(1):150-8. |
| [25] | Geller R, Taguwa S, Frydman J. Broad action of Hsp90 as a host chaperone required for viral replication[J]. Biochim Biophys Acta, 2012, 1823(3):698-706. |
| [26] | 张恒辉, 郭 芳, 费 然, 等. CD4+ CD25+调节性T细胞在慢性乙型肝炎患者免疫发病机制中的作用[J]. 世界华人消化杂志, 2007, 15(20):2225-30. Zhang H H, Guo F, Fei R, et al. Effects of regulatory T cells on anti-viral immune responses impaired by chronic hepatitis B[J]. World J Gastroenterol, 2007, 15(20):2225-30. |
| [27] | 李 华, 许瑞安. 乙型肝炎的分子治疗[M]//许瑞安, 陈凌, 肖卫东, 主编. 分子基因药物学. 北京:北京大学出版社 & 北京大学医学出版社联合出版, 2008:206-45. Li H, Xu R A. Molecular treatment of hepatitis B[M]//Xu R A, Chen L, Xiao W D. Molecular Gene Medicine. Beijing:Peking University Press & Peking University Medical Press, 2008:206-45. |
| [28] | 李欣燕, 吕颖慧, 许瑞安. 肝硬化分子治疗[M]//许瑞安, 陈凌, 肖卫东, 主编. 分子基因药物学. 北京:北京大学出版社 & 北京大学医学出版社联合出版, 2008:271-301. Li X Y, Lü Y H, Xu R A. Molecular treatment of liver cirrhosis[M]//Xu R A, Chen L, Xiao W D. Molecular Gene Medicine. Beijing:Peking University Press & Peking University Medical Press, 2008:271-301. |

