


脑缺血/再灌注后引起的炎症反应在脑组织损伤过程中扮演重要角色。已有大量研究表明,脑缺血/再灌注后释放大量炎症信号,介导大量炎性细胞的聚集和炎性因子的释放,进而引起脑组织水肿、破坏血脑屏障等,加重脑组织的损伤[1, 2, 3]。炎症反应是脑缺血/再灌注后脑组织继发性损伤的主要机制之一,其中包括转录因子的激活以及下游炎症因子的释放[4]。NF-κB是关键的转录因子家族,参与多种炎症基因的转录调控,在炎症反应中发挥重要作用[5]。
黄芪和三七是治疗心脑血管疾病的常用有效中药,黄芪总苷(astragalosides,AST)是黄芪中具有心脑血管效应的主要药效组分,主要含黄芪甲苷(astragaloside Ⅳ,AST Ⅳ);三七总皂苷(panax notoginseng saponins,PNS)是三七中具有心脑血管效应的主要药效组分,主要含人参皂苷Rg1(ginsenoside Rg1,Rg1)、人参皂苷Rb1(ginsenoside Rb1,Rb1)和三七皂苷R1(notoginsenoside R1,R1)。我们以往的研究表明,AST和PNS配伍可增强抗脑缺血/再灌注损伤的效应,其作用与抗氧化应激损伤、保护血脑屏障等有关[6]。进而对其中4种主要有效成分配伍的研究表明,AST Ⅳ、Rg1、Rb1和R1配伍也可增强其抗脑缺血/再灌注损伤的作用,其作用与抗氧化应激损伤有关[7],从而提示这4种有效成分为黄芪和三七抗脑缺血的主要药效物质,这些有效成分配伍可以增强其作用。为进一步阐明这4种有效成分配伍的作用机制,本研究从炎症反应和NF-κB信号通路研究了黄芪甲苷和人参皂苷Rg1、人参皂苷Rb1、三七皂苷R1配伍抗脑缺血/再灌注损伤的作用。
1 材料 1.1 实验动物SPF级♂ C57BL/6小鼠,体质量18~22 g,由湖南维通利华实验动物有限公司提供。动物合格证号为:SCXK(湘)2009-0004。饲养于SPF级动物实验室,湿度45%、室温25℃环境。
1.2 受试药物AST Ⅳ(批号:A0070)、Rg1(批号:A0237)、Rb1(批号:A0234)、R1(批号:A0273),购自成都曼思特生物科技有限公司,纯度≥98%,用时以5%羧甲基纤维素钠配成混悬液备用。依达拉奉(3-甲基-1-苯基-2-吡唑啉-5-酮),南京先声东元制药有限公司生产,批号80-090104,规格10 g·5 L-1,以生理盐水配成0.4 g·L-1溶液。
1.3 实验试剂全蛋白提取试剂盒(批号:KGP2100)购自南京凯基生物科技发展有限公司;细胞核和细胞质蛋白提取试剂盒(批号:SK3051)、磷酸酶抑制剂复合物Ⅲ(批号:PL019-1)、改良型BCA蛋白质定量检测试剂盒(批号:SK3051)购自上海生工生物工程股份有限公司;组织总RNA提取试剂盒(批号:Lo423)购自天根生物试剂有限公司;Reverse Transcription System逆转录试剂盒(批号:ADA3500)购自Promega;兔抗小鼠β-actin抗体(批号:sc-130656),大鼠抗小鼠磷酸化IκBα(p-IκBα)抗体(批号:SC-8404)、兔抗小鼠NF-κB p65抗体(批号:SC-33020)购自Santa Gruz Biotechnology;辣根过氧化物酶标记的二抗购自北京中杉生物技术有限公司。
2 方法 2.1 脑缺血模型制作乙醚麻醉小鼠,仰卧位固定,在颈部正中做1 cm切口,暴露颈总动脉及伴行的迷走神经,分离并夹闭双侧颈总动脉造成脑缺血,20 min后恢复血流[8],再灌注24 h。假手术组也同样进行手术,但不进行脑缺血和再灌注。再灌注24 h后,将小鼠迅速断头,取出脑组织置于冰上,去除小脑及脑干后检测。
2.2 动物分组和给药方法根据前期实验结果[9],在小鼠脑缺血模型,4种有效成分配伍可对抗脑缺血后氧化应激,增强脑组织能量代谢,剂量以AST Ⅳ 40 +Rg1 50 +Rb1 40 +R1 10 mg·kg-1配伍作用最强。因此,本研究中4个有效成分配伍的剂量参考以往的研究结果。将小鼠随机分为以下11组:假手术组、模型组、AST Ⅳ组(40 mg·kg-1)、Rg1组(50 mg·kg-1)、Rb1组(40 mg·kg-1)、R1组(10 mg·kg-1)、4种有效成分配伍组(AST Ⅳ 40 +Rg1 50 +Rb1 40 +R1 10 mg·kg-1)、AST Ⅳ(40 mg·kg-1)+Rg1(50 mg·kg-1)组、AST Ⅳ(40 mg·kg-1)+Rb1(40 mg·kg-1)组、AST Ⅳ(40 mg·kg-1)+R1(10 mg·kg-1)组、依达拉奉组(4 mg·kg-1),每组8只小鼠。依达拉奉组腹腔注射给药,每日给药2次;其余各给药组灌胃给药,假手术组、模型组灌胃给予0.5%羧甲基纤维素钠,给药体积均为10 mL·kg-1,每天给药1次。连续3 d,d 3末次给药1 h后造模。造模期间同前给药。
2.3 指标检测 2.3.1 RT-PCR法测定脑组织TNF-α、IL-1β、ICAM-1 mRNA表达取右脑视交叉前组织50 mg,以TRIzol提取总RNA,测定A206/A280为1.8-2.0,纯度>90%。逆转录成互补脱氧核糖核酸(cDNA),以此为模板进行PCR扩增。TNF-α基因引物:上游序列:5′-ATGGCCTCCCTCTCATCAGT-3′,下游序列:5′-TACCAGGGTTTGAGCTCAGC-3′,扩增片段为382 bp。IL-1β基因引物:上游序列:5′-CTCGCAGCAGCACATCAACA-3′,下游序列:5′-TGCCGTCTTTCATTACACAGGA-3′,扩增片段为428 bp。ICAM-1基因引物:上游序列:5′-GTGATGCTCAGGTATCCATCCA-3′,下游序列:5′-CACAGTTCTCAAAGCACAGCG-3′,扩增片断213 bp。β-actin基因引物:上游序列:5′-GAGACCTTCAACACCCCAGC-3′,下游序列:5′-CCACAGGATTCCATACCCAA-3′,扩增片段446 bp。PCR反应体系 20 μL,扩增条件为:先95℃ 2 min,再94℃ 45 s,60℃ 30 s,72℃ 2 min,35循环。最后72℃ 延伸10 min。取扩增产物10 μL行1%琼脂糖凝胶电泳,ChampGel 5500凝胶成像系统对目的条带进行扫描,Image-pro plus图像分析软件测定目的条带的积分光密度值(integrated optical density,IOD),以目的条带的IOD值与β-actin条带的IOD值的比值即相对IOD半定量目的基因的表达强度。
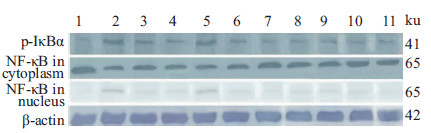
2.3.2 Western blot法测定脑组织p-IκBα及胞质、胞核NF-κB蛋白表达取左脑视交叉前脑组织100 mg,加1 mL RIPA裂解液匀浆、冰上裂解30 min,4℃下12 000 r·min-1离心5 min,取上清液。以改良型BCA蛋白质定量法检测蛋白质含量,确定蛋白质上样总量110 μg,取蛋白样品与1/3量的4×SDS凝胶上样缓冲液混合使总体积为20 μL,煮沸变性5~10 min。SDS-PAGE 电泳分离2~3 h,300 mA恒流1 h湿转至PVDF膜上,用含5%脱脂奶粉的TBS溶液封闭3 h,TBST溶液洗3次。再分别与兔抗小鼠β-actin抗体(1:1 000)、大鼠抗小鼠p-IκBα抗体(1:1 000)、兔抗小鼠NF-κBp65抗体(1:200)溶液3 mL混合,4℃静置过夜,TBST溶液洗3次。然后与辣根过氧化物酶(HRP)标记的二抗(1:1 000)5~8 mL室温孵育1 h,TBST洗膜3次。取增强型DAB底物显色试剂盒进行显影,将PVDF膜进行扫描,Image Pro-Plug6.0图像分析软件测定目的条带的IOD,以β-actin为内参照,以目的条带的IOD值与β-actin条带的IOD值的比值作为该目的蛋白的相对表达量。由于NF-κB必须发生核转位,进入细胞核后才可以启动下游炎性细胞因子的表达,故本文以NF-κB核转位率来评价其活化情况,NF-κB核转位率=胞核相对表达量/(胞核相对表达量+胞质相对表达量)。
2.4 统计分析方法实验数据采用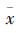 ± s表示,运用SPSS 16.0统计软件进行统计分析。先将各组数据进行方差齐性检验,多组间比较采用单因素方差分析,方差齐者用LSD检验。方差不齐时先将数据转换后使之方差齐,再同上进行分析。
± s表示,运用SPSS 16.0统计软件进行统计分析。先将各组数据进行方差齐性检验,多组间比较采用单因素方差分析,方差齐者用LSD检验。方差不齐时先将数据转换后使之方差齐,再同上进行分析。
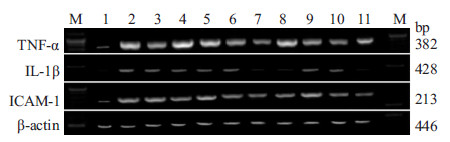
见Fig1,Tab1。与假手术组比较,模型组TNF-α表达明显升高(P<0.01)。与模型组比较,AST Ⅳ、R1、4种有效成分配伍及AST Ⅳ+Rb1、AST Ⅳ+R1组TNF-α表达明显降低(P<0.01或P<0.05)。且AST Ⅳ+Rb1组 TNF-α的表达低于Rb1组(P<0.05),AST Ⅳ+R1组TNF-α的表达低于AST Ⅳ及R1单用组(均P<0.01)且AST Ⅳ+Rg1组IL-1β的表达低于AST Ⅳ及Rg1单用组(均P<0.01)。4种有效成分配伍降低TNF-α表达的效应强于各有效成分单用及AST Ⅳ+Rg1、AST Ⅳ+Rb1组(均P<0.01)。
|
| Fig.1 TNF-α,IL-1β,ICAM-1mRNA maps in brain tissues among the group 1:Sham;2:Model;3:Astragaloside Ⅳ;4:Ginsenoside Rg1;5:Ginsenoside Rb1;6:Notoginsenoside R1;7:Four active component combination;8:AST Ⅳ+Rg1;9:AST Ⅳ+Rb1;10:AST Ⅳ+R1;11:Edaravone.The same below |
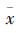 ± s,n=8)
± s,n=8)
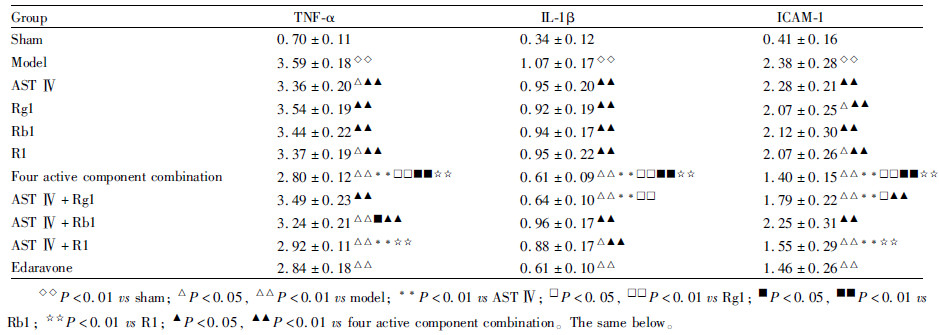 |
与假手术组比较,模型组IL-1β 表达明显升高(P<0.01)。与模型组比较,4种有效成分配伍、AST Ⅳ+Rg1、AST Ⅳ+R1及依达拉奉组IL-1β 表达明显下降(P<0.01或P<0.05)。且AST Ⅳ+Rg1组IL-1β的表达低于AST Ⅳ及Rg1单用组(均P<0.01),4种有效成分配伍降低IL-1β mRNA表达的效应强于各有效成分单用及AST Ⅳ+Rb1、AST Ⅳ+R1(均P<0.01)。
与假手术组比较,模型组ICAM-1表达明显升高(P<0.01)。与模型组比较,Rg1、R1、4种有效成分配伍、AST Ⅳ+Rg1、AST Ⅳ+R1组ICAM-1表达明显下降(P<0.01或P<0.05)。且AST Ⅳ+Rg1、AST Ⅳ+R1降低ICAM-1表达的效应分别强于Rg1、R1 及AST Ⅳ单用(P<0.01或P<0.05);4种有效成分配伍降低ICAM-1表达的效应强于各有效成分单用及AST Ⅳ+Rg1、AST Ⅳ+Rb1组(均P<0.01)。
3.2 各组脑组织p-IκBα,胞质、胞核NF-κB蛋白表达和NF-κB核转位率的比较见Fig2,Tab2。与假手术组比较,模型组p-IκBα蛋白表达明显增加(P<0.01)。与模型组比较,AST Ⅳ、Rg1、R1及各配伍组均能明显降低p-IκBα蛋白的表达(P<0.01或P<0.05)。且配伍组降低p-IκBα蛋白表达的效 应强于各有效成分单用组(均P<0.01),4种有效成分配伍组的效应强于AST Ⅳ+Rb1组(P<0.05),与AST Ⅳ+Rg1、AST Ⅳ+R1及依达拉奉组比较,差异无统计学意义(均P>0.05)。
|
| Fig.2 Western blot patterns of p-IκBa protein as well as NF-κB protein in cytoplasm and nucleus in brain tissues among group |
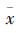 ± s,n=8)
± s,n=8)
 |
与假手术组比较,模型组胞质NF-κB蛋白表达明显减少(P<0.01)。与模型组比较,除Rb1外,各给药组胞质NF-κB蛋白表达明显增加(P<0.01或P<0.05)。且AST Ⅳ+Rg1、AST Ⅳ+R1组NF-κB蛋白表达的增加大于Rg1、R1 及AST Ⅳ单用组(均P<0.01);AST Ⅳ+Rb1组NF-κB蛋白表达的增加大于Rb1单用(P<0.05);4种有效成分配伍组NF-κB蛋白表达的增加大于4种有效成分单用及AST Ⅳ+Rb1组(均P<0.01),与AST Ⅳ+Rg1、AST Ⅳ+R1及依达拉奉组比较,差异无统计学意义(均P>0.05)。
与假手术组比较,模型组胞核NF-κB蛋白表达明显增加(P<0.01)。与模型组比较,除Rb1外,各给药组胞核NF-κB蛋白表达明显减少(P<0.01或P<0.05)。且AST Ⅳ+Rb1组胞核NF-κB蛋白表达的减少高于Rb1组(P<0.01),AST Ⅳ+R1组胞核NF-κB蛋白表达的减少分别高于AST Ⅳ、R1单用组(均P<0.01)。4种有效成分配伍组胞核NF-κB蛋白表达的减少高于4种有效成分单用组及AST Ⅳ+Rg1、AST Ⅳ+Rb1组,与AST Ⅳ+R1及依达拉奉比较,差异无统计学意义(均P>0.05)。
与假手术组比较,模型组NF-κB核转位率明显增加(P<0.01)。与模型组比较,除Rb1外,各给药组均能明显抑制NF-κB核转位率的增加(均P<0.01)。且配伍组降低NF-κB核转位率的效应大于各有效成分单用(P<0.01或P<0.05),4种有效成分配伍组的效应大于AST Ⅳ+Rg1、AST Ⅳ+Rb1组,与AST Ⅳ+R1及依达拉奉比较差异无显著性(均P>0.05)。
4 讨论当脑缺血/再灌注发生时,脑内胶质细胞、脑血管内皮细胞、血小板等释放大量的TNF-α、IL-1、血小板激活因子等促炎性细胞因子[10],促炎性细胞因子激活白细胞、内皮细胞后,通过释放蛋白酶和氧自由基,使白细胞和血管内皮细胞表达黏附分子,从而诱导白细胞及血小板等粘附于微血管内,导致血流中断或堵塞。活化后的白细胞在血管内聚集,通过释放蛋白水解酶等,损伤血管内皮,导致血脑屏障破坏和脑水肿发生;活化白细胞还可释放大量的炎性介质,使更多的中性粒细胞发生聚集、浸润,加重炎性反应[11]。TNF-α在炎症网络中具有关键作用,是全身炎性反应的始动介质,可诱导IL-1、IL-6和黏附分子表达释放,使炎性损伤的级联效应放大[12, 13, 14]。ICAM-1属于免疫球蛋白超家族,是重要的黏附分子之一,介导白细胞向血管内皮细胞的黏附,诱导血管内膜的炎症反应。脑缺血后,脑组织IL-1表达增加,其中主要是IL-1β。IL-1能诱导脑微血管内皮细胞黏附分子及趋化因子的表达,促进白细胞浸润,引起炎症反应[15]。动物实验表明,IL-1β在大鼠大脑中动脉缺血2h后,再灌注0~24h内IL-1β等炎症细胞因子逐渐增加,且24h后达到高峰[16]。
本研究结果显示,脑缺血/再灌注后,脑组织TNF-α、IL-1β、ICAM-1mRNA表达均升高,提示缺血缺氧刺激可引起炎性细胞因子的表达。AST Ⅳ和Rg1单用可以分别降低TNF-α和ICAM-1的表达,R1能同时减少TNF-α和ICAM-1的表达。黄芪和三七有效成分单用对IL-1β表达没有影响。AST Ⅳ+Rg1 能降低IL-1β、ICAM-1的表达,AST Ⅳ+Rb1仅能降低TNF-α的表达,AST Ⅳ+R1及4种有效成分配伍对TNF-α、IL-1β、ICAM-1表达的升高均具有明显抑制作用。提示4种有效成分配伍可以增强对脑缺血/再灌注后脑组织TNF-α、IL-1β、ICAM-1等炎症因子表达的抑制作用,其对IL-1β表达的抑制作用可能主要来自于AST Ⅳ+Rg1,对TNF-α和ICAM-1表达的抑制作用可能主要来自于AST Ⅳ+R1。
NF-κB是一种广泛存在于真核细胞内的转录因子。静息状态下NF-κB与κB抑制蛋白-α(IκB-α)结合,以失活状态存在于胞质中。当细胞受到某些细胞因子、氧化应激及内毒素等刺激时,使IκB磷酸化及降解,IκB与NF-κB解离,后者迅速移位至细胞核,并与核内DNA特定靶部位结合,启动相关靶基因转录,参与调节细胞因子、黏附分子表达、免疫反应及炎症反应等。而一些炎性细胞因子(IL-1、IL-2、TNF-α)、黏附分子(VCAM-1、ICAM-1)及转录生长因子(TGF-β)等又可诱导NF-κB进一步活化,形成正反馈作用,刺激NF-κB活化,加重炎症反应[17, 18]。
本研究结果显示,脑缺血/再灌注后,脑组织p-IκBα蛋白表达增加,NF-κB核转位率增加。提示脑缺血后导致IκB磷酸化及降解,IκB与NF-κB解离,使NF-κB发生了核转位。AST Ⅳ、Rg1、R1及各有效成分配伍均能抑制IκB磷酸化,减少NF-κB核转位的发生,且配伍组的效应大于各有效成分单用,4种有效成分配伍组的效应大于AST Ⅳ+Rg1及AST Ⅳ+Rb1组。表明AST Ⅳ与三七的主要有效成分配伍抑制炎性细胞因子表达的作用可能与抑制NF-κB信号通路的激活有关。
综上所述,黄芪和三七的4种有效成分配伍可以增强对脑缺血/再灌注后脑组织TNF-α、IL-1β、ICAM-1等炎症因子表达的抑制作用,其机制可能与抑制缺血/再灌注后脑组织NF-κB信号通路的激活,从而减少炎性因子的生成有关。
| [1] | 姜红, 刘广志.缺血性脑卒中与炎症[J].中国神经免疫学和神经病学杂志, 2009, 16(3):225-8.Jiang H, Liu G Z. Ischemic stroke and inflammation[J]. China J Neuroimm Neurol, 2009, 16(3):225-8.. |
| [2] | Denes A, Thornton P, Rothwell N J, et al. Inflammation and brain injury:acute cerebral ischemia, peripheral and central inflammation[J]. Brain Behav Immun, 2010, 24(5):708-23. |
| [3] | Nagakannan P, Shivsharan B D, Thippeswamy B S, et al. Protective effect of hydroal-coholic extract of Mimusops elengi Linn. flowers against middle cerebral artery occlusion induced brain injury in rat[J]. J Ethnopharmacol, 2012, 140(2):247-54. |
| [4] | Brouns R, De Deyn P P. The complexity of neurobiological processes in acute ischemic stroke[J]. Clin Nettrol Neurosurg, 2009, 111(6):483-95. |
| [5] | Ahmed A U, Sarvestani S T, Gantier M P, et al. Integrin-linked kinase modulates lipopolysaccharide-and helicobacter pylori-induced nuclear factor κB-activated tumor necrosis factor-α production via regulation of p65 serine 536 phosphorylation[J]. J Biol Chem, 2014, pii:jbc.M114.574541. |
| [6] | 黄小平, 谭华, 邓常清.黄芪总苷和三七总皂苷配伍对脑缺血/再灌注后MMP-9和TIMP-1表达的影响[J].中国中药杂志, 2010, 35 (16):2187-91.Huang X P, Tan H, Chen B Y, Deng C Q. Influence of Astragalosides and Panax Notoginseng Saponins compatibility on MMP-9 and TIMP-1 after cerebral ischemia-reperfusion in mice[J]. China J Chin Mater Med, 2010, 35(16):2187-91.. |
| [7] | 黄小平, 邓常清, 邱咏园, 等.黄芪甲苷和三七的三种有效成分配伍对小鼠脑缺血/再灌注后氧化应激和Nrf2/HO-1途径的影响[J].中国药理学通报, 2013, 29(11):1596-601.Huang X P, Qiu Y Y, Deng C Q. Effects of the combinations between Astragaloside Ⅳ and three active components in notoginseng on oxidative stress and Nrf2/HO-1 pathway after cerebral ischemic-reperfusion in mice[J]. Chin Pharmacol Bull, 2013, 29(11):1596-601.. |
| [8] | Yonekura I, Kawahara N, Nakatomi H, et al. A model of global cerebral ischemia in C57BL/6 mice[J]. J Cereb Blood Flow Met, 2004, 24(2):151-8. |
| [9] | 黄小平, 王蓓, 邱咏园, 等.黄芪甲苷、人参皂苷Rg1、Rb1和三七皂苷R1抗小鼠脑缺血/再灌注氧化应激损伤和促进能量代谢的配伍研究[J].湖南中医药大学学报, 2014, 34(7):5-11.Huang X P, Wang B, Qiu Y Y, et al. Study of the effective compatibility dose of four active components in astragalus and notoginseng on early cerebral ischemia-reperfusion in mice[J]. J Hunan Univ Chin Med, 2014, 34(7):5-11.. |
| [10] | Wong C H, Crack P J. Modulation of neuro-inflammation and vascular response by oxidative stress following cerebral ischemia-reperfusion injury[J]. Curr Med Chem, 2008, 15(1):1-14. |
| [11] | Danton G H, Dietrich W D. Inflammatory mechanisms after ischemia and stroke[J]. Nenropathol Exp Neurol, 2003, 62(2):127-36. |
| [12] | 巩固, 黄怡, 袁利邦, 等. LRG介导内毒素预处理诱导的脑保护作用[J].细胞与分子免疫学杂志, 2011, 27(8):865-7.Gog G, Huang Y, Yuan L B, et al. Requirement of LRG in endotoxin-mediated brain protection[J]. Chin J Cell Mol Immunol, 2011, 27(8):865-7.. |
| [13] | Harai O A, Liao J K. NF-κB and innate immunity in ischemic stroke[J]. New York Acad Sci, 2010, 1207:32-40. |
| [14] | Rummel C, Gerstberger R, Rhth J, et al. Parthenolide attenuates LPS-induced fever, circulating cytokines and markers of brain inflammation in rats[J]. Cytokine, 2011, 56(3):739-48. |
| [15] | Huang J, Upadhyay U M, Tamargo R J. Inflammation in stroke and focal cerebral ischemia[J]. Surg Neurol, 2006, 66(3):232-45. |
| [16] | 薛晶, 冯加纯, 杨艺敏, 等.脑缺血/再灌注后炎症和自由基作用的实验研究[J].中国老年学杂志, 2009, 29(6):644-6.Xue J, Feng J C, Yang Y M, et al. Experimental study on inflammation and free radicals after cerebral ischemia-reperfusion[J]. Chin J Gerontol, 2009, 29(6):644-6.. |
| [17] | Ridder D A, Schwaninger M. NF-kappaB signaling in cerebral ischemia[J]. Neuroscience, 2009, 158(3):995-1006. |
| [18] | Hess S, Methe H, Kim J Q, Edelman E R. NF-kappaB activity in endothelial cells is modulated by cell substratum interactions and influences chemokine-mediated adhesion of natural killer cells[J]. Cell Transplant, 2009, 18(3):261-73. |

