


2. 贵阳医学院民族药与中药开发应用教育部工程研究中心,贵州 贵阳 550004
王爱民(1962-),男,学士,教授,研究方向:中药药效物质基础及质量控制研究,通讯作者,Tel:0851-6908468,E-mail: gywam100@gmail.com
2. Engineering Research Center for the Development and Application of Ethnic Medicine and TCM (Ministry of Education), Guiyang Medical College, Guiyang 550004, China
杜仲为杜仲科植物杜仲Eucommia ulmoides Oliver的干燥树皮,又名思仙、思仲、木棉,为我国名贵滋补药材,主要分布于四川、贵州、广西、云南等地。杜仲具有补肝肾、强筋骨、降血压、抗肿瘤等诸多功效[1, 2]。目前研究表明,杜仲主要功效成分为环烯醚萜类、木质素类、黄酮类、苯丙素类等,其中京尼平苷酸具有降血压、抗肿瘤、抗氧化等药理作用,原儿茶酸具有抗氧化作用,绿原酸具有抗菌的作用,松脂醇二葡萄糖苷和松脂醇单葡萄糖苷则为主要降血压成分[3, 4, 5, 6, 7, 8]。药物血浆蛋白结合率是进行药动学研究的重要参数[9, 10, 11],目前仅报道了松脂醇二葡萄糖苷和京尼平苷酸药物动力学研究[12, 13],对于杜仲中多种成分血浆蛋白结合率的研究尚未见报道。本文以京尼平苷酸、松脂醇二葡萄糖苷、松脂醇单葡萄糖苷、原儿茶酸和绿原酸为检测指标,采用平衡透析法研究其在大鼠血浆中的药物蛋白结合率,为进一步研究杜仲的药动学提供基础参数。
1 仪器与材料 1.1 仪器超高效液相色谱ACQUITY UPLC系统(美国Waters公司),配有二元超高压溶剂系统、自动进样器、柱温箱、三重四级杆质量分析器和Masslynx4.1质谱工作站;涡旋混合器ZH-2(天津药典标准仪器厂);冷冻高速离心机Allegra 64R(美国Beckman Coulter 公司);氮吹仪MTN-2800D(天津奥特塞恩斯仪器有限公司);电子天平EL204(上海梅特勒-托利多仪器有限公司);透析袋MD25(截留相对分子质量 8000-14000,塞兰博生物制品有限公司)。
1.2 试剂与试药京尼平苷酸和原儿茶酸对照品(四川省维克奇生物科技有限公司,批号120314、110306,纯度≥98%);绿原酸对照品(北京世纪奥科生物技术有限公司,批号MUST-11042802,纯度≥98%);松脂醇二葡萄糖苷对照品(上海顺勃生物工程有限公司,批号201206,纯度≥98%);松脂醇单葡萄糖苷对照品(江苏弘惠医药有限公司,批号070801,纯度≥98%);葛根素对照品(中国药品生物制品鉴定所,批号111-090623,纯度≥98%)。杜仲提取物(自制,各指标成分含量:京尼平苷酸3.5%、原儿茶酸0.17%、绿原酸0.19%、松脂醇二葡萄糖苷2.1%、松脂醇单葡萄糖苷1.0%)。乙腈、甲酸为色谱纯,实验用水为超纯水,其他试剂为分析纯。
1.3 动物健康SD大鼠,♂,体质量为240~260 g,由贵阳医学院实验动物中心提供(批号SCXK[黔]2014-0001)。
2 方法与结果 2.1 色谱条件色谱柱Waters BEH C18(2.1 mm×50 mm,1.7 μm)柱,流动相:0.1%甲酸乙腈(A),0.1%甲酸水(B),梯度洗脱程序见Tab1,流速:0.35 mL·min-1,柱温:45 ℃,进样器的温度:15 ℃,进样体积为1 μL。
| Time/min | A/% | B/% | curve |
| Initial | 5 | 95 | - |
| 0.5 | 10 | 90 | 6 |
| 3.5 | 20 | 80 | 6 |
| 4 | 90 | 10 | 6 |
| 5 | 5 | 95 | 1 |
采用电喷雾电离源(ESI),毛细管电离电压3 kV,离子源温度120 ℃,喷雾气与反吹气为氮气,去溶剂气流速650 L·h-1,去溶剂气温度350 ℃,反吹气流速为50 L·h-1,碰撞气为氩气,碰撞气流速0.16 mL·min-1,扫描方式为多反应离子监测(MRM);负离子模式(ESI-),用于定量的离子对(m/z)京尼平苷酸:373.2→211.0,原儿茶酸:152.9→109.0,绿原酸353.1→191.0,松脂醇二葡萄糖苷:681.3→357.2,松脂醇单葡萄糖苷:519.3→357.2;正离子模式(ESI+),葛根素(内标):417.0→267.0;锥孔电压为35V,碰撞能量分别为15、15、15、25、15、35V。
2.3 溶液的配置 2.3.1 标准溶液和内标的配制精密称取京尼平苷酸、原儿茶酸、绿原酸、松脂醇二葡萄糖苷、松脂醇单葡萄糖苷对照品适量至10 mL容量瓶中,用甲醇定容。得京尼平苷酸(1.350 g·L-1)、原儿茶酸(0.974 g·L-1)、 绿原酸(1.000 g·L-1)、松脂醇二葡萄糖苷(1.004 g·L-1)、松脂醇单葡萄糖苷(1.010 g·L-1)的储备液。分别精密量取京尼平苷酸等5种对照品储备液适量,用甲醇按梯度稀释成所需浓度,得混合系列标准溶液。精密称取0.00500 g葛根素对照品至5 mL容量瓶,用甲醇定容至刻度,得葛根素(1.000 g·L-1) 的储备液。取内标储备液适量至25 mL容量瓶中,用甲醇定容至刻度,配制成20 mg·L-1的内标溶液,置冰箱(-20 ℃)保存,备用。
2.3.2 磷酸缓冲液(PBS)的配制精密称取KH2PO4 0.2 g、Na2HPO4 2.88 g、KCl 0.2 g、NaCl 8.0 g,用适量超纯水溶解,加1% NaOH调节pH至7.4,将溶液转移至1 000 mL容量瓶中,超纯水定容至刻度,储存备用。
2.4 样品处理方法 2.4.1 血浆样品处理方法精密量取大鼠血浆500 μL,置于5 mL离心管中,补加甲醇50 μL,依次加入1%甲酸水200 μL,内标溶液(20 mg·L-1)10 μL,甲醇2 mL,涡混1 min,超声5 min,4 ℃、15 000 r·min-1离心10 min,取上清液置离心管中,氮吹仪45 ℃空气吹干,甲醇300 μL复溶,15 000 r·min-1离心10 min后取上清液UPLC-MS/MS进样分析。
2.4.2 缓冲液样品处理方法精密量取缓冲液1 mL,置于2 mL离心管中,补加 50 μL甲醇,依次加入1%甲酸水200 μL,内标溶液10 μL,涡混1 min,氮吹仪45 ℃空气吹干,甲醇300 μL复溶,15 000 r·min-1离心10 min,取上清液UPLC-MS/MS进样分析。
2.5 方法学验证 2.5.1 专属性考察分别精密量取空白血浆500 μL或空白磷酸缓冲液1 mL,除不加内标外,其余按“2.4”项操作,获得空白样品色谱图A;将一定浓度标准溶液和内标溶液加入空白血浆或磷酸缓冲液,同上操作得色谱图B;取平衡透析实验血浆或缓冲液,同上操作得色谱图C,相关色谱图见Fig1。京尼平苷酸、原儿茶酸、绿原酸、松脂醇二葡萄糖苷、松脂醇单葡萄糖苷及内标葛根素的相对保留时间分别为0.97、1.06、1.45、2.37、3.69和1.80 min,内源性物质对待测物的测定无干扰。
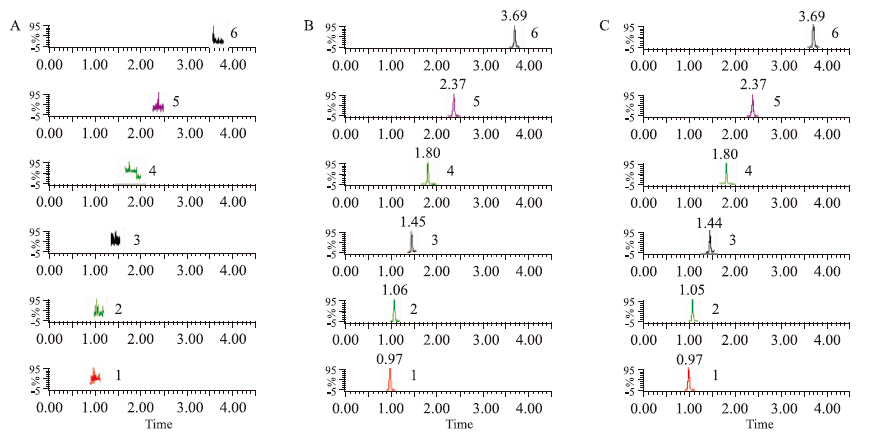
|
| Fig 1 HPLC chromatograms of five analytes and internal standard in plasma A: Blank plasma; B: Blank plasma spiked with reference substance and internal standard; C: Plasma samples. 1: Geniposidic acid; 2: Protocatechuic acid; 3: Chlorogenic acid; 4: Puerarin; 5: Pinoresinol diglucoside; 6: Pinoresinol singleglucoside |
分别取6份空白血浆或磷酸缓冲液,依次加入含有5个指标成分的混合标准溶液50 μL,配制成相应质量浓度的标准溶液,按“2.4”项下操作。以样品的峰面积与内标峰面积之比为纵坐标Y,样品浓度为横坐标X,用加权最小二乘法进行线性回归,权重系数为1/C,求得标准曲线,见Tab2。结果表明,在测定范围内线性关系良好。
| Analyte | Concentration range/mg·L-1 | Curvilinear equation | r | LLOD/ μg·L-1 | |
| Geniposidic acid | plasma | 0.077~18. 4 | Y=0.5081X +0.0087 | 0.9997 | 7.30 |
| dialysate | Y=0.6367X +0.0123 | 0.9998 | 6.99 | ||
| Protocatechuic acid | plasma | 0.025~6.012 | Y=1.0830X+ 0.0019 | 0.9998 | 2.15 |
| dialysate | Y=1.4711X +0.0067 | 0.9998 | 1.53 | ||
| Chlorogenic acid | plasma | 0.026~6.198 | Y=0.9422X +0.0019 | 0.9996 | 3.98 |
| dialysate | Y=1.8178X +0.0013 | 0.9997 | 3.37 | ||
| Pinoresinol diglucoside | plasma | 0.152~37.037 | Y=0.8143X+ 0.0062 | 0.9997 | 14.8 |
| dialysate | Y=1.1756X +0.0094 | 0.9996 | 13.6 | ||
| Pinoresinol singleglucoside | plasma | 0.077~18. 4 | Y=2.5185X +0.0045 | 0.9998 | 3.16 |
| dialysate | Y=3.3595X +0.0013 | 0.9998 | 2.19 |
按“ 2.5.2 ”项下分别配制含有京尼平苷酸等5个指标成分的血浆或磷酸缓冲液低、中、高3个浓度的质控(QC)样品,按“2.4”项下操作,连续测定3 d,每个浓度平行5份。考察方法的准确度与日内、日间精密度。结果表明该方法准确、可靠、重现性好(Tab3、4)。
| Analyte | Control/ mg·L-1 | Extraction recovery/% | Accuracy/% | Precision (RSD/%) | |
| Intra-day | Inter-day | ||||
| Geniposidic acid | 0.077 | 109.05±9.97 | 102.58±2.45 | 2.38 | 0.32 |
| 0.693 | 97.85±4.23 | 102.68±2.59 | 2.52 | 0.83 | |
| 6.283 | 101.84±3.94 | 99.02±2.73 | 2.76 | 0.73 | |
| Protocatechuic acid | 0.025 | 98.50±7.17 | 105.23±5.10 | 4.85 | 0.13 |
| 0.223 | 103.15±0.84 | 104.90±6.38 | 6.08 | 2.86 | |
| 2.004 | 92.19±7.65 | 100.77±7.90 | 7.84 | 1.78 | |
| Chlorogenic acid | 0.026 | 99.08±2.86 | 100.66±6.36 | 6.32 | 2.98 |
| 0.230 | 103.08±10.54 | 107.80±5.04 | 4.68 | 3.55 | |
| 2.066 | 100.98±10.14 | 104.15±7.39 | 7.10 | 2.37 | |
| Pinoresinol diglucoside | 0.152 | 108.69±0.69 | 99.66±3.13 | 3.14 | 5.00 |
| 1.372 | 102.76±2.87 | 100.59±8.44 | 8.39 | 3.54 | |
| 12.346 | 95.77±9.33 | 97.76±4.89 | 5.00 | 1.37 | |
| Pinoresinol singleglucoside | 0.077 | 103.33±1.86 | 103.93±4.84 | 4.66 | 4.47 |
| 0.693 | 100.93±4.28 | 104.24±3.65 | 3.50 | 0.53 | |
| 6.235 | 100.71±3.81 | 101.15±3.16 | 3.12 | 0.51 | |
| Analyte | Control/ mg·L-1 | Extraction recovery/% | Accuracy/% | Precision (RSD/%) | |
| Intra-day | Inter-day | ||||
| Geniposidic acid | 0.077 | 102.93±2.90 | 100.62±4.25 | 4.22 | 0.54 |
| 0.693 | 99.61±7.01 | 101.24±3.41 | 3.36 | 1.37 | |
| 6.283 | 98.87±8. | 97.48±2.95 | 3.02 | 2.66 | |
| Protocatechuic acid | 0.025 | 91.91±11.42 | 94.37±6.05 | 6.42 | 3.10 |
| 0.223 | 91.85±8.75 | 103.33±9.97 | 9.65 | 2.32 | |
| 2.004 | 110.46±4.01 | 108.65±7.69 | 7.07 | 2.95 | |
| Chlorogenic acid | 0.026 | 83.54±0.87 | 93.69±6.49 | 6.93 | 7.46 |
| 0.230 | 85.24±6.08 | 94.90±5.07 | 5.34 | 1.69 | |
| 2.066 | 103.93±1.42 | 102.61±3.88 | 3.78 | 0.79 | |
| Pinoresinol diglucoside | 0.152 | 92.81±7.55 | 95.27±4.29 | 4.50 | 2.07 |
| 1.372 | 103.44±5.63 | 107.32±9.42 | 8.78 | 1.19 | |
| 12.346 | 97.85±6.06 | 100.44±1.61 | 1.60 | 2.13 | |
| Pinoresinol singleglucoside | 0.077 | 96.32±4.33 | 97.73±5.50 | 5.63 | 1.67 |
| 0.693 | 98.92±5.76 | 100.09±2.67 | 2.67 | 0.75 | |
| 6.235 | 99.21±7.32 | 99.92±3.79 | 3.79 | 0.62 | |
按“2.5.2”项下分别配制血浆或磷酸缓冲液低、中、高3个浓度的质控(QC)样品,每个浓度平行5份,按“2.4”项下操作,记录各物质峰面积(A提取)。另取低、中、高浓度的混合标准溶液,吹干,残留物以300 μL甲醇溶解,记录各物质峰面积(A)。将两组峰面积进行比较,即A提取/A计算各物质的提取回收率,结果见Tab3、4。
2.5.5 稳定性考察按“ 2.5.2 ”项下分别配制血浆或磷酸缓冲液低、中、高3个浓度的质控(QC)样品,每个浓度平行5份,分别考察在室温放置4 h,4℃下冷藏6 h,反复冻融3次,及处理后自动进样器中放置24 h后的稳定性,结果表明,在上述条件下的RSD均小于10%,样品稳定性良好。
2.6 血浆蛋白结合率实验方法将透析袋剪成4cm 左右的小段,用蒸馏水煮沸5 min,再用60 ℃蒸馏水冲洗2 min。取出少量缓冲液冲洗后,于缓冲液中浸泡,4 ℃保存备用。将处理后的透析袋一端折叠用线结扎,将1 mL空白血浆加入透析袋内,放一粒玻璃珠以保证透析袋在缓冲液中保持垂直,透析袋内留一小空气泡,将透析袋另一端扎紧,使其悬浮于盛有20 mL缓冲液的广口瓶中,膜外缓冲液中杜仲提取物浓度分别为5、10、25、50、100、200 mg·L-1,调节透析袋内外液面,使其保持在同一水平面,并避免透析袋贴于瓶壁。将瓶口密封后,于4℃静置72 h至药物扩散平衡。透析结束后,用10%的高氯酸溶液检查透析外液是否有蛋白漏出,有漏出者则该样品作废。分别测定透析袋内药物浓度Dt (总浓度)与袋外药物浓度Df (游离药物浓度),根据公式计算血浆蛋白结合率:血浆蛋白结合率/%=[(Dt-Df)/Dt]×100%,结果见Tab5。
| Analyte | Control/ mg·L-1 | Drug concentration/mg·L-1 | Protein binding rate/% | Average/% | |
| Plasma in bag filter | Dialysate out of bag filter | ||||
| Geniposidic acid | 5 | 0.280±0.016 | 0.206±0.015 | 25.55±1.80 | 25.60±2.50 |
| 10 | 0.587±0.076 | 0.434±0.057 | 26.03±3.55 | ||
| 25 | 1.122±0.060 | 0.831±0.057 | 25.94±3.74 | ||
| 50 | 2.203±0.074 | 1.637±0.072 | 25.67±2.09 | ||
| 100 | 4.482±0.225 | 3.346±0.174 | 25.33±2.49 | ||
| 200 | 8.395±0.549 | 6.286±0.257 | 25.12±1.85 | ||
| Protocatechuic acid | 5 | 0.043±0.001 | 0.018±0.002 | 58.98±5.36 | 57.58±3.73 |
| 10 | 0.086±0.008 | 0.036±0.002 | 57.98±2.09 | ||
| 25 | 0.157±0.014 | 0.066±0.005 | 57.66±5.69 | ||
| 50 | 0.316±0.034 | 0.133±0.011 | 57.75±2.20 | ||
| 100 | 0.590±0.035 | 0.252±0.016 | 57.23±1.82 | ||
| 200 | 0.969±0.054 | 0.424±0.037 | 56.16±4.46 | ||
| Chlorogenic acid | 5 | 0.043±0.003 | 0.019±0.002 | 54.98±1.88 | 54.28±3.19 |
| 10 | 0.108±0.003 | 0.050±0.002 | 54.72±3.57 | ||
| 25 | 0.199±0.017 | 0.090±0.004 | 54.42±3.92 | ||
| 50 | 0.421±0.035 | 0.191±0.014 | 54.42±3.65 | ||
| 100 | 0.954±0.071 | 0.438±0.016 | 53.94±3.62 | ||
| 200 | 1. 3±0.067 | 0.793±0.050 | 53.39±3.21 | ||
| Pinoresinol diglucoside | 5 | 0.140±0.007 | 0.105±0.009 | 24.74±5.94 | 24.01±4.71 |
| 10 | 0.337±0.023 | 0.253±0.016 | 24.61±5.82 | ||
| 25 | 0.652±0.033 | 0.490±0.012 | 24.65±4.65 | ||
| 50 | 1.300±0.055 | 0.986±0.044 | 24.07±3.82 | ||
| 100 | 2.608±0.189 | 1.984±0.044 | 23.59±5.44 | ||
| 200 | 4.723±0.194 | 3.650±0.159 | 22.61±4.59 | ||
| Pinoresinol singleglucoside | 5 | 0.114±0.004 | 0.056±0.003 | 50.51±2.75 | 49.99±3.42 |
| 10 | 0.279±0.028 | 0.138±0.008 | 50.40±3.27 | ||
| 25 | 0.544±0.026 | 0.269±0.012 | 50.49±3.90 | ||
| 50 | 1.081±0.084 | 0.539±0.024 | 50.02±3.31 | ||
| 100 | 2.103±0.219 | 1.049±0.043 | 49.66±5.57 | ||
| 200 | 3.460±0.180 | 1.760±0.036 | 49.04±1.85 | ||
药物经吸收进入血液后,一部分与血浆中的蛋白结合,一部分呈游离的分子状态。平衡透析法基于药物结合的平衡原理,可测定药物游离浓度,是研究药物血浆蛋白结合率的经典方法。
本实验建立了使用UPLC-MS/MS测定杜仲提取物大鼠血浆蛋白结合率的实验方法,实验证明此方法可快速、准确地同时测定杜仲提取物中的5个指标成分。实验中对药液浓度、平衡时间进行了考察,在4 ℃条件下,平衡24、48、72、96 h后分别测定透析袋内外浓度,最终选择72 h为平衡时间。血浆蛋白结合率实验结果提示,杜仲提取物中除京尼平苷酸和松脂醇二葡萄糖苷为低度结合(25%)外,原儿茶酸、绿原酸和松脂醇单葡萄糖3个成分为中度结合。采用SPSS 18.0软件进行方差分析,表明在所研究的浓度范围内,京尼平苷酸等5种成分不存在质量浓度依赖性(P>0.05)。
| [1] | 江苏新医学院. 中药大辞典(上册)[M]. 上海:上海科学技术出版社,1986:2090. Jiangsu new medical college. The dictionary of traditional Chinese Medicine (volume one) [M]. Shanghai: Shanghai Scientific and Technical Publishers, 1986:2090 |
| [2] | 程光丽. 杜仲有效成分分析及药理学研究进展[J]. 中成药,2006, 28 (5):723-5. Cheng G L. Advance in studies on active constituent and their pharmacological activities of Eucommia ulmoides oliv.[J]. Chin Tradit Pat Med ,2006, 28 (5):723-5. |
| [3] | 李 竹,晏 媛,李 青. 杜仲的药理活性研究进展[J]. 中国药事,2004, 18 (2):131-2. Li Z, Yan Y, Li Q. Advance in study on pharmacological activities of Eucommia ulmoides oliv[J]. Chin Pharm Aff, 2004, 18 (2):131-2. |
| [4] | 赵玉英,耿 权,程铁民. 杜仲化学成分研究概况[J]. 天然产物研究与开发,1995, 7(3):46-52. Zhao Y Y, Geng Q, Cheng T M. A survey of the studies on chemical constituents of Eucommia ulmoides oliv[J]. Nat Prod Res Dev, 1995, 7 (3):46-52. |
| [5] | 管淑玉,苏薇薇. 杜仲化学成分与药理研究进展[J]. 中药材,2003, 26 (2):124-9. Guan S Y, Su W W. Advance in studies on chemical constituents and pharmacological activities of Eucommia ulmoides oliv.[J]. Chin Med Mat, 2003, 26 (2):124-9. |
| [6] | Deyama T, Nishibe S, Nakazawa Y. Constituents and pharmacological effects of Eucommia and Siberian ginseng[J]. Acta Pharmacol Sinica, 2001, 22(12), 1057-70. |
| [7] | Hsieh C L, Yen G C. Antioxidant actions of Du Zhong (Eucommia Umoides Oliv.) toward oxidative damage in biomolecules[J]. Life Sci, 2000, 66 (15):1387-400. |
| [8] | Luo L F, Wu W H, Zhou Y J, et al. Antihypertensive effects of Eucommia ulmoides oliv. extracts in spontaneously hypertensive rats[J]. J Ethnopharmacol, 2010, 129 (2):238-43. |
| [9] | 周 玲,居文政,刘子修,等. 灯盏细辛注射液多成分血浆蛋白结合率测定[J]. 中国药理学通报,2011, 27 (5):719-22. Zhou L, Ju W, Liu Z X, et al. Determination of plasma protein binding rate of multicomponent in Dengzhanxixin injection[J]. Chin Pharmacol Bull, 2011, 27 (5):719-22. |
| [10] | 冯志强,韩 坚,谢智勇,等. 黄芩提取物中黄酮类成分血浆蛋白结合率的测定[J]. 中国药理学通报,2012, 28(2):286-9. Feng Z Q, Han J, Xie Z Y, et al. Determination of plasma protein binding rate of multicomponent in scutellaria baicalensis Georgi [J]. Chin Pharmacol Bull, 2012, 28 (2):286-9. |
| [11] | 黄 勇,陈 慧,郑 林,等. 液质联用超滤法测定注射用复方荭草中原儿茶酸、异荭草素及野黄芩苷的血浆蛋白结合率[J]. 中国药学杂志,2011, 46 (15):1200-4. Huang Y, Chen H, Zheng L, et al. Determination of plasma protein binding rates of protocatechuic acid, isoorientin and scutellarin in compound Hongcao freeze-dried powder for injection by ultrafiltration combined with UPLC-ESI-MS/MS[J]. Chin Pharm J, 2011, 46 (15):1200-4. |
| [12] | Zheng X, Huang X T, Li N, et al. Determination of geniposidic acid in rat plasma by LC-MS/MS and its application to in vivo pharmacokinetic studies[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2012, 887-8,138-42. |
| [13] | Wang J L, Liu E W, Zhang Y, et al. Validation of a HPLC-tandem MS/MS method for pharmacokinetics study of (+)-Pinoresinol di -β-D-glucopyranoside from Eucommia ulmoides Oliv extract in rats’ plasma[J]. J Ethnopharmacol, 2012, 139 (2):337-42. |

