癌性痛是一种病理性疼痛,而骨癌痛又是癌性痛中最主要的一种。既往的研究观察到,高达85%的肺、乳腺、前列腺癌症患者都存在骨转移,三分之一的患者都有骨痛症状[1]。虽然骨癌痛严重影响患者的生活质量,但由于其发生机制尚未明了,临床治疗效果不佳。研究发现,PI3K/Akt信号通路参与神经病理痛[2, 3]和炎性痛的发生[4, 5, 6],但其是否参与骨癌痛的发生发展尚未可知。本研究拟通过构建大鼠胫骨癌痛模型,鞘内给予PI3K抑制剂LY294002后观察大鼠机械痛阈、脊髓p-Akt表达情况,探讨骨癌痛发生的脊髓机制。
1 材料与方法 1.1 主要试剂和仪器Walker256细胞(南京中医药大学新药与海洋药物研究中心药理毒理研究室惠赠),PI3K抑制剂LY294002(Calbiochem,美国),兔抗p-Akt一抗(Cell Signaling,美国),SP试剂盒(北京中杉生物,中国),DAB显色试剂盒(北京中杉生物,中国),照相机Olympus-C7070wz (Olympus,日本),倒置显微镜Olympus-CKX41(Olympus,日本),von-frey针刺触觉测量仪(stoelting,美国)。
1.2 动物选择与分组清洁级♀未交配Sprague-Dawley大鼠40只,苏州希诺赛生物科技有限公司提供,使用许可证号为SCXK (苏)2013-0003。体质量180~200 g,动物饲养室温度22℃~24℃,湿度40%~60%,周期光照8:00~20:00,大鼠自由饮水、进食。随机分为5组(n=8):假手术组(Ⅰ组)、假手术+LY294002组(Ⅱ组)、骨癌痛组(Ⅲ组)、骨癌痛+DMSO组(IV组)、骨癌痛+LY294002组(V组)。
1.3 骨癌痛模型的制备参照文献[7]介绍的方法制备胫骨癌痛模型。大鼠腹腔注射4%水合氯醛0.01 mL·g-1麻醉后,于其左胫骨上段膝关节下胫骨平台切开约5 mm小口,先用牙科探针在胫骨干骺端钻孔然后用微量注射器,注入10 μL肿瘤细胞(浓度为2×1010·L-1)混悬液,医用胶水封堵针孔。外涂红霉素眼膏。假手术组仅注入磷酸盐缓冲液(PBS液)10 μL。
1.4 蛛网膜下腔置管参照文献[8]的方法,在大鼠麻醉后进行蛛网膜下腔置管,置管后单笼饲养并剔除出现肢体感觉或运动障碍、导管脱出的大鼠。Ⅱ组和Ⅴ组于接种后d 7~9鞘内注射浓度为2.5 g·L-1的PI3K抑制剂LY294002 10 μL,每天1次,Ⅳ组鞘内注射5% DMSO 10 μL。
1.5 机械痛阈的测定各组大鼠于术后d 7给药前及给药后1~8 h,每小时测定机械痛阈。将大鼠放入底部为铁丝网的有机玻璃笼中安静30 min,使其适应周围环境。利用一系列von-frey丝刺激大鼠后肢足底中部,逐渐加力使毛针弯曲。根据Up and down法,若大鼠不出现缩足,则换大一级力度的毛针,如出现缩足(The 50% mechanical withdrawal threshold to von Frey hair,MWT),则记录相应的数值(MWT值)。两次试验之间至少间隔5 min,连测6次,取平均值[9]。
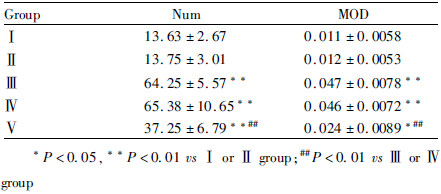
1.6 免疫组织化学染色各组大鼠造模后d 9,经腹腔注射4%水合氯醛0.01 mL·g-1麻醉后处死大鼠,打开胸腔,暴露心脏,经升主动脉先灌注生理盐水200 mL以冲净血液,随即灌注4%多聚甲醛300 mL。取L4-6脊髓段,置于多聚甲醛中后固定4~6 h,再浸于20%蔗糖溶液中4℃过夜直至沉底。用贴片法行冰冻冠状切片,厚约6 μm。切片于室温PBS冲洗5 min×3次,行SP法免疫组织化学染色。组织切片经过3%过氧化氢及正常山羊血清孵育后,滴加小鼠抗p-Akt一抗(1:50),4℃湿盒孵育24 h;生物素标记的羊抗小鼠IgG常温下孵育2h;辣根酶标记链酶卵白素,常温下孵育2 h;DAB显色、贴片、脱水、透明、封片。用PBS代替一抗或二抗作阴性对照。切片拍照后,Image-Pro Plus 6.0软件分析脊髓背角染色阳性细胞数(Num)和平均光密度值(mean optical density,MOD)。
1.7 统计学处理用SPSS 19.0统计学软件分析数据,计量资料以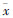 ± s表示,组内比较采用t检验,组间比较采用方差分析。
± s表示,组内比较采用t检验,组间比较采用方差分析。
各组大鼠的MWT基础值差异均无统计学意义(P>0.05)。Ⅰ,Ⅱ组大鼠d 7 MWT值比较差异无统计学意义(P>0.05),Ⅲ,Ⅳ组大鼠d 7 MWT值均低于Ⅰ组(P<0.01),且该两组间MWT值差异亦无统计学意义(P>0.05)。与Ⅲ组比较,术后d 7给药后V组大鼠2~4 h的MWT值差异有统计学意义(P<0.05),给药后3 h达到峰值(P<0.01),见Fig1,2。

|
Fig 1
The MWT of rats in all groups before i.t.injections
(g,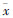 ± s,n=8)
**P < 0.01 vs I group (d7) ± s,n=8)
**P < 0.01 vs I group (d7)
|

|
Fig 2
Effect of PI3K inhibitor LY294002 on MWT in BCP rats
(g,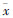 ± s,n=8)
*P<0.05,**P<0.01 vsⅠ group,#P<0.05,##P<0.01 vs Ⅲ group ± s,n=8)
*P<0.05,**P<0.01 vsⅠ group,#P<0.05,##P<0.01 vs Ⅲ group
|
与Ⅰ组比较,术后d 9,Ⅲ组、Ⅳ组和V组大鼠脊髓背角p-Akt阳性细胞数增加,表达上调(P<0.01);与Ⅲ组和Ⅳ组比较,Ⅴ组脊髓背角p-Akt阳性细胞数降低,表达下调(P<0.01);Ⅰ组和Ⅱ组、Ⅲ组和Ⅳ组p-Akt的阳性细胞数及表达比较差异无统计学意义(P<0.01),见Fig3,Tab1。

|
| Fig 3 Different expressions of p-Akt in spinal dorsal horn in rats Intrathecal LY294002 significantly decreased the expression of p-Akt in BCP rats.Scale Bar:50μm. |
本研究建立的胫骨癌痛模型是目前进行癌痛研究的常用模型[7],能模拟人类骨癌痛基本特征,且造模技术纯熟,模型稳定。本研究在造模后d 7,造模大鼠出现机械痛阈降低,且活动度下降,提示胫骨癌痛模型已建立。
磷脂酰肌醇-3-激酶(phosphoinositide 3-kinase,PI3K)是一种可使肌醇环D-3位羟基磷酸化的磷脂酰肌醇激酶,哺乳类的PI3K可分为3个亚型:Class I、ClassII和ClassIII,能激活下游Akt的是ClassI亚型。Akt又称蛋白激酶B (protein kinase B,PKB)是一种丝氨酸/苏氨酸蛋白激酶,属于AGC蛋白激酶家族。PI3K活化后与Akt结合,使Akt从胞液转移至胞膜内侧,同时引起其构象变化并发生磷酸化,即磷酸化Akt (p-Akt)[10, 11, 12],因此Akt是PI3K信号通路中的中心环节,p-Akt常作为PI3K活化的标志[13, 14]。
既往研究证明,PI3K/Akt信号通路参与了慢性疼痛的发生和发展。在神经病理痛大鼠模型上,身体同侧背根神经节和脊髓背角的p-Akt阳性神经元明显增加,而鞘内注射PI3K抑制剂wortmannin或LY294002,以及Akt抑制剂IV或(-)-鱼藤素可以明显缓解大鼠的机械痛敏[2]。此外,Guedes等[3]发现,在坐骨神经横断术(sciatic nerve transection,SNT)后7 d,总Akt和p-Akt的表达均增高。在皮内注射辣椒素构建的炎性痛模型中,p-Akt在腰段脊髓背角和背根神经节的表达都明显增高[4, 15],而预先给予PI3K抑制剂则可以预防由辣椒素引起的大鼠的机械痛敏,且Wortmannin和LY294002这两种PI3K的抑制剂均对此有效[4, 15]。Pezet等[6]还发现,鞘内给予LY294002后可以缓解由足底注射福尔马林引发的炎性痛,该作用有剂量依赖性,且对第一时相和第二时相的炎性痛均有缓解作用。
本实验研究观察,骨癌痛造模成功的大鼠产生明显的机械痛觉超敏,脊髓背角L4~6水平的p-Akt表达增加,PI3K/Akt通路被激活;而连续3 d鞘内给予PI3K抑制剂LY294002阻断PI3K/Akt信号通路后,脊髓p-Akt表达降低,PI3K/Akt活化受到抑制。术后7 d的MWT值显示,大鼠已产生的机械痛觉过敏,在鞘内注射LY294002后2~4 h被部分逆转,骨癌痛得到部分缓解,3 h时达到峰值。因此我们有理由推测,大鼠骨癌痛模型中脊髓水平PI3K/Akt信号通路得到激活,且主要在骨癌痛早期发生作用。
综上所述,脊髓PI3K/Akt信号通路的激活可能参与了大鼠骨癌痛的形成。
| [1] | Middlemiss T,Laird B J,Fallon M T.Mechanisms of cancer-induced bone pain[J].Clin Oncol,2011,23(6):387-92. |
| [2] | Xu J T,Tu H Y,Xin W J,et al.Activation of phosphatidylinositol 3-kinase and protein kinase B/Akt in dorsal root ganglia and spinal cord contributes to the neuropathic pain induced by spinal nerve ligation in rats[J].Exp Neurol,2007,206(2):269-79. |
| [3] | Guedes R P,Araújo A S,Janner D,et al.Increase in reactive oxygen species and activation of Akt signaling pathway in neuropathic pain[J].Cell Mol Neurob,2008,28(8):1049-56. |
| [4] | Sun R,Yan J,Willis W D.Activation of protein kinase B/Akt in the periphery contributes to pain behavior induced by capsaicin in rats[J].Neuroscience,2007,144(1):286-94. |
| [5] | Liang L,Fan L,Tao B,et al.Protein kinase B/Akt is required for complete freund's adjuvant-induced upregulation of Nav17 and Nav18 in primary sensory neurons[J].J Pain,2013,14(6):638-47. |
| [6] | Pezet S,Marchand F,D'Mello R,et al.Phosphatidylinositol 3-kinase is a key mediator of central sensitization in painful inflammatory conditions[J].J Neuroscience,2008,28(16):4261-70. |
| [7] | 姚明,杨建平,王丽挪,等.腹水传代与体外培养Walker256癌细胞系建立大鼠骨癌痛模型的可行性[J].中华医学杂志 ,2008,88:880-4. Yao M,Yang J P,Wang L N,et al.Feasibility of establishment of rat model of bone cancer pain by using Walker 256 cells cultured in vitro or in vivo[J].Chin Med J,2008,88:880-4. |
| [8] | 杨建平,蒋豪,吴珏.大鼠蛛网膜下腔埋管并长期留置操作的改进[J]. 中华麻醉学杂志 ,1993,13(2):110.Yang J P,Jiang H,Wu J.The improvement of the operation to place and keep Subarachnoid catheter in rats[J].Chin J Anesthesiol,1993,13(2):110. |
| [9] | Hu J H,Yang J P,Liu L,et al.Involvement of CX3CR1 in bone cancer pain through the activation of microglia p38 MAPK pathway in the spinal cord[J].Brain Res,2012,1465:1-9. |
| [10] | Hanada M,Feng J,Hemmings B A.Structure,regulation and function of PKB/AKT-a major therapeutic target[J].Biochim Biophys Acta,2004,1697(1-2):3-16. |
| [11] | Nicholson K M,Anderson N G.The protein kinase B/Akt signalling pathway in human malignancy[J].Cell Signall,2002,14(5):381. |
| [12] | Vanhaesebroeck B,Alessi D R.The PI3K-PDK1 connection:more than just a road to PKB[J].Biochem J,2000,346(Pt 3):561. |
| [13] | Jones P F,Jakubowicz T,Pitossi F J,et al.Molecular cloning and identification of a serine/threonine protein kinase of the second-messenger subfamily[J].Proceed Nat Acad Sci,1991,88(10):4171-5. |
| [14] | Coffer P J,Woodgett J R.Molecular cloning and characterisation of a novel putative protein-serine kinase related to the cAMP-dependent and protein kinase C families[J].Europ J Biochem,1991,201(2):475-81. |
| [15] | Sun R Q,Tu Y J,Yan J Y,et al.Activation of protein kinase B/Akt signaling pathway contributes to mechanical hypersensitivity induced by capsaicin[J].Pain,2006,120(1):86-96. |