灯盏花是菊科植物短葶飞蓬Erigeron breviscapus (Vant.) Hand.-Mazz.的干燥全草,又名灯盏细辛,其有效成分灯盏乙素(scutellarin),即4′,5,6-三羟基黄酮-7-葡萄糖醛酸苷,具有活血化瘀、抑制血小板和红细胞的黏附及聚集,降低血液粘稠度,增加心肌供血量,改善组织缺血等作用,临床主要用于治疗高血压、脑血栓等心脑血管疾病[1, 2]。
有关灯盏乙素的动物药代动力学研究结果表明其生物利用度很低,在大鼠、家兔和犬体内的生物利用度分别为2.3%[3]、0.18%[4]和0.4%[5],然而灯盏乙素疗效明显,说明必有其发挥作用的物质基础存在。据文献报道,灯盏乙素本身在胃肠道内吸收较差[6, 7],主要以苷元的形式吸收进入体内[8, 9]。灯盏乙素苷元(scutellarein)吸收入血后,其结构中的5、6、7和4′位上的羟基均可能与内源性的α-D-葡萄糖醛酸发生共价结合反应,生成一系列灯盏乙素苷元的β-葡萄糖醛酸苷[8, 10, 11],故以灯盏乙素为检测对象生物利用度很低。我们建立了先用β-葡萄糖醛酸苷酶将血浆中灯盏乙素苷元的β-葡萄糖醛酸苷水解成苷元,再通过LC-MS-MS进行检测的方法来研究灯盏乙素在人体内的药代动力学。该方法水解效率高、样品前处理简单,专一性强。
1 材料与方法 1.1 药品与试剂灯盏花素分散片,漯河南街村全威制药股份有限公司,每片含灯盏乙素20 mg,批号100602;灯盏乙素对照品,美国ChromaDex公司,批号00019097-811;灯盏乙素苷元对照品,美国ChromaDex公司,批号00019096-224;槲皮素(内标)对照品,中国食品药品检定研究院,批号100081-200907;β-葡萄糖醛酸苷酶,美国Sigma公司,产品编号G0751,型号Type H-1;维生素C注射液,金陵药业股份有限公司,规格2 mL∶0.5 g,批号110316;试验用水为超纯水;甲醇、乙腈等试剂均为色谱纯。
1.2 仪器与液质条件API 4000 LC-MS-MS联用仪,色谱工作站Analyst 1.4.2;梅特勒MT-5电子天平;Biofuge PrimoR冷冻高速离心机;Drict-Q5超纯水机。
液相条件:色谱柱:Agilent ZORBAX SB C18(2.1 mm×150 mm,5 μm);流动相: 乙腈(含0.1%甲酸)∶甲醇∶水(含0.1%甲酸,1%异丙醇)= 40∶10∶50 (V/V);流速:200 μL·min-1;柱温:40℃。
质谱条件:多反应监测(MRM);电喷雾离子化;负离子检测;离子源电压:4500 V;离子源温度:500℃;选择离子通道:灯盏乙素苷元,[M-H]-,m/z 285.0/136.8;槲皮素,[M-H]-,m/z 301.1/120.8。
1.3 受试者选择12名健康男性受试者,体质量62~75 kg,年龄21~29岁,经体检证明肝、肾功能、心电图正常,符合受试者入选要求。签署知情同意书,并经伦理委员会审批同意。试验前两周及试验期间未服用其他任何药物。
1.4 试验设计受试者于试验前1日和试验期内勿吸烟、饮用酒类、咖啡类饮料或果汁;试验前1日晚17∶00前入住Ⅰ期病房,统一标准晚餐,禁食10 h。次日早晨空腹服用灯盏花素分散片,用250 mL温开水送服;服药2 h后方可再饮水,4 h后统一进食低脂肪饮食。给药前及给药后1、2、3、4、5、6、7、8、9、10、12、14、16、19 h肘静脉取血4 mL,置于加入20 μL维生素C注射液的肝素化试管中,振荡均匀。血样标本1 500×g离心10 min,取血浆置-75℃冰箱中保存。
1.5 血浆样品的处理于2.0 mL塑料离心管中精密加入受试者血浆样品0.2 mL,0.58 mol·L-1冰醋酸20 μL和10 kU·mL-1 β-葡萄糖醛酸苷酶液20 μL,旋涡10 s混匀后,放入37℃水浴中水解30 min。水解完毕后立刻加入内标槲皮素溶液10 μL(15 872 μg·L-1),甲醇0.8 mL,旋涡振荡3 min,13 800×g离心5 min,吸取上清液进行LC-MS-MS分析,进样量10 μL。
1.6 数据处理及统计分析采用中国药理学会编制的DAS 1.0软件,对受试者的血药浓度-时间数据进行处理,计算各药代动力学参数,其中AUC采用梯形法计算,T1/2用药时曲线末端相计算,Tmax和Cmax为实测值。
2 结果 2.1 酶解条件分别加入不同浓度的β-葡萄糖醛酸苷酶液20 μL(以0.1 mol·L-1、 pH 4.75乙酸钠缓冲液配制成320、160、80、40、20、10、5、4、3、2、1、0.5、0 kU·mL-1),结果显示当酶浓度为10 kU·mL-1时水解效率最高。另考察了酶解时间(10、20、30、45、60、120 min)的影响,发现酶解30 min达到峰值。
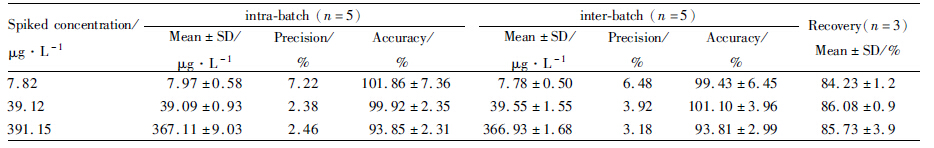
2.2 特异性在本实验所采用的LC-MS-MS条件下,灯盏乙素苷元保留时间在2.5 min左右,内标槲皮素保留时间在2.8 min左右。灯盏乙素苷元和内标互不干扰,峰形良好,无杂峰干扰,基线平稳,见Fig1。
|
| Fig 1 Representative MRM chromatograms of scutellarein and quercetin (IS) in human plasma samples A:a blank plasma sample;B:a blank plasma sample spiked with scutellarein(C=40 μg·L-1,tR=2.5 min)and IS(C =1600 μg·L-1,tR=2.8 min);C:plasma sample 9 h after oral administration of 120 mg scutellarin |
本实验考察了人空白血浆经提取后,内源性杂质对灯盏乙素苷元和内标槲皮素的离子抑制情况。结果显示,灯盏乙素苷元血浆质控样品在7.82、39.12、391.15 μg·L-1 3个浓度下,LC-MS-MS介质效应(n=3)分别为96.51%、99.72%、97.52%;内标槲皮素介质效应(n=9)为81.35%。
2.4 标准曲线和线性范围以灯盏乙素苷元血药浓度C(分别为513.38、256.69、128.34、64.17、32.09、16.04、8.02、4.01 μg·L-1)为横坐标,灯盏乙素苷元峰面积和内标峰面积比f为纵坐标,以f对C作回归计算,得回归方程:f=0.019 2×C-0.010 1,r=0.999 5,权重系数w=1/C2。药物浓度与峰面积间线性关系良好,线性范围为4.01~513.38 μg·L-1,最低定量限为4.01 μg·L-1。
2.5 精密度与准确度制备含灯盏乙素苷元浓度分别为391.15、39.12、7.82 μg·L-1的含药血浆质控样品,按“血浆样品的处理”项下操作,连续做3 d,每批每个浓度各做5份样品,计算灯盏乙素苷元峰面积和内标峰面积的比值f,代入当天的随行标准曲线中求得实测浓度,由实测浓度计算批内与批间精密度,实测浓度与加入浓度的比值即为准确度,结果见Tab1。
制备含灯盏乙素苷元浓度分别为391.15、39.12、7.82 μg·L-1的含药血浆质控样品,按“血浆样品的处理”项下操作,记录峰面积A1。人空白血浆经提取后,加入灯盏乙素苷元标准溶液样品,记录峰面积A2,A1和A2的比值(A1/A2×100)即为提取回收率R(%)。结果见Tab1。
2.7 样品稳定性制备含灯盏乙素苷元浓度分别为391.15、39.12、7.82 μg·L-1的含药血浆样品,另制备含灯盏乙素浓度分别为583.92、58.39、11.68 μg·L-1的含药血浆样品,考察血浆样品反复冻融3次、-20℃放置23 d、室温放置4 h,按“血浆样品的处理”方法处理后的分析物放置24 h的稳定性,经实测浓度与加入浓度进行比较,灯盏乙素苷元浓度变化在-14.18%~1.09%,灯盏乙素浓度变化在-14.09%~2.62%,表明两者在上述条件下均稳定。
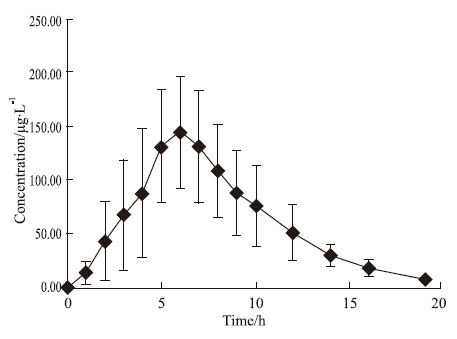
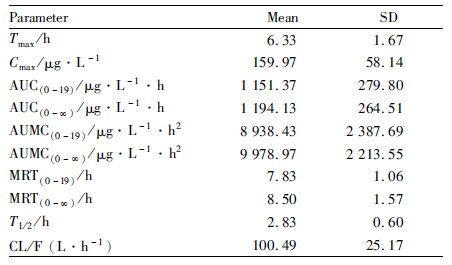
2.8 人体内药动学研究12名健康男性受试者口服120 mg灯盏花素分散片后,灯盏乙素苷元的平均血药浓度-时间曲线见Fig2,主要药代动力学参数见Tab2。
|
Fig 2
Mean plasma concentration-time profiles of scutellarein after oral administration of 120 mg scutellarin preparations in 12 male volunteers ( ± s, n=12) ± s, n=12)
|
 |
灯盏乙素及其苷元较不稳定,为防止氧化,本实验于取血前在肝素化试管中加入了维生素C,同时,在样品前处理和标准溶液配制中也加入了维生素C。实验表明加入维生素C可增加样品稳定性。
据文献报道[12],健康人口服灯盏花素60 mg后,血浆中仅可检测到异灯盏乙素和灯盏乙素这两种β-葡萄糖醛酸苷,未检测到硫酸酯共价结合物。本文通过β-葡萄糖醛酸苷酶将血浆中的异灯盏乙素、灯盏乙素全部水解成灯盏乙素苷元进行测定。实验中使用的β-葡萄糖醛酸苷酶来自软体动物Helix pomatia,除具有水解β-葡萄糖醛酸苷的活性外,还具有硫酸酯酶活性,即使血浆中存在微量的难以检测的硫酸酯共价结合物,也可被水解成苷元得到检测。本实验还考察了酶解条件、酶解转化率,酶解稳定性,发现以10 kU·mL-1酶液酶解30 min即能达到高效的酶解作用。血浆中高、中、低3个浓度灯盏乙素转化为苷元的比率在94.72%~99.80%之间,灯盏乙素苷元酶解过程中的变化率在-4.63% ~-9.37%之间,表明在本实验酶解条件下,灯盏乙素几乎全部转化为苷元,且苷元在酶解过程中稳定,说明直接以灯盏乙素苷元为检测对象是合理可行的,该方法能真实反映灯盏乙素制剂吸收进入体内的量。
本研究发现,12名受试者口服灯盏花素分散片120 mg后,灯盏乙素苷元Tmax波动较大,且有4名受试者出现双峰现象,提示灯盏乙素制剂在胃肠道的吸收可能存在肝肠循环。灯盏乙素苷元Cmax及AUC存在较大个体差异,可能是因为不同个体间胃肠道菌群的β-葡萄糖醛酸苷酶活性不同,影响到灯盏乙素转化为苷元的量,而灯盏乙素在胃肠道内主要以苷元的形式被吸收,从而导致了不同个体间Cmax及AUC的差异。
| [1] | 邱 璐, 瞿礼嘉, 虞 泓, 等. 灯盏花素的研究进展[J]. 中草药, 2005, 36(1):141-4. Qiu L, Qu L J, Yu H, et al. Advances in studies on Erigeron breuiscapus[J]. Chin Tradit Herb Drugs, 2005, 36(1): 141-4. |
| [2] | 丁存刚, 葛庆华. 灯盏花素药物动力学研究进展[J]. 中国医药工业杂志, 2010, 37(2): 137-9. Ding C G, Ge Q H. Progress of pharmacokinetics of breviscapine[J]. Chin J Pharm, 2010, 37(2): 137-9. |
| [3] | Liu X B, Ye J X, Quan L H, et al. Pulmonary delivery of scutellarin solution and mucoadhesive particles in rats [J]. Eur J Pharm Biopharm, 2008, 70: 845-52. |
| [4] | 沈 腾, 郁韵秋, 翁伟宇, 等. 灯盏花素缓释片在兔体内的绝对生物利用度[J]. 中国临床药理学杂志, 2008, 17(1): 25-8. Shen T, Yu Y Q, Weng W Y, et al. Absolute bioavailability of breviscapine sustained release tablet in rabbit [J]. Chin J Clin Pharm, 2008, 17 (1): 25-8. |
| [5] | 葛庆华, 周 臻, 支晓瑾, 等. 灯盏花素在犬体内的药动学和绝对生物利用度研究[J]. 中国医药工业杂志, 2003, 34(12): 618-20. Ge Q H, Zhou Z, Zhi X J, et al. Pharmacokinetics and absolute bioavailability of breviscapine in beagle dogs[J]. Chin J Pharm, 2003, 34(12): 618-20. |
| [6] | Cao F, Zhang H Y, Guo J X, et al. Mrp 2-related efflux of scutellarin in the intestinal absorption in rats[J]. Die Pharm, 2008, 63: 75-80. |
| [7] | 尤海生, 张 海, 董亚林, 等. 野黄芩苷和灯盏乙素苷元在Caco-2细胞模型中的吸收转运特性[J]. 中西医结合学报, 2010, 8: 863-9. You H S, Zhang H, Dong Y L, et al. Absorption and transportation characteristics of scutellarin and scutellarein across Caco-2 monolayer model[J]. J Chin Integrat Med, 2010, 8(9): 863-9. |
| [8] | Zhang J L, Che Q M, Li S Z, et al. Study on metabolism of scutellarin in rats by HPLC-MS and HPLC-NMR [J]. J Asian Nat Products Res, 2003, 5(4): 249-56. |
| [9] | Wang Y Z, Ao H S, Qian Z M, et al. Intestinal transport of scutellarein and scutellarin and firstpass metabolism by UDP-glucuronosyltransferase-mediated glucuronidation of scutellarein and hydrolysis of scutellarin[J]. Xenobiotica, 2011, 41(7): 538-48. |
| [10] | 居文政, 储继红, 谭仁祥, 等. UPLC-MS/M联用法分析灯盏花乙素在胃肠道的代谢物[J]. 中国临床药理学与治疗学, 2006,11(3): 292-5 Ju W Z, Chu J H, Tan R X, et al. Study on metabolites of scutellarin in gastrointestinal tract by UPLC-MS/ MS method[J]. Chin J Clin Pharmacol Ther, 2006, 11 (3): 292-5. |
| [11] | Xia H J, Qiu F, Zhu S, et al. Isolation and Identification of ten metabolites of breviscapine in rat urine[J]. Biol Pharm Bull, 2007, 30(7): 1308-16. |
| [12] | Chen X Y, Cui L, Duan X T, et al. Pharmacokinetics and metabolism of the flavonoid scutellarin in humans after a single oral administration[J]. Drug Metabol Disposition: Biological Fate Chemicals, 2006, 34: 1345-52. |