2.蚌埠医学院药学系,安徽 蚌埠 233030;
3. 蚌埠医学院第一附属医院心胸外科,安徽 蚌埠 233004
蒋志文(1951-),男,博士,教授,硕士生导师,研究方向:生化药理学,通讯作者,Tel: 0552-3175321,E-mail: zzwwjj51@aliyun.com
2.Faculty of Pharmacy, Bengbu Medical College,Bengbu Anhui 233030,China;
3. Dept of Cardiothoracic Surgey, the First Affiliated Hospital of Bengbu Medical College, Bengbu Anhui 233010,China
硫酸乙酰肝素(HS)是广泛分布于动物组织中的直链状硫酸化多糖,在胚胎生成、细胞骨架组成、细胞迁徙、创伤愈合、炎症、肿瘤转移、血管生成等一系列生物反应中发挥关键性作用。体外、体内实验显示,HS具有确切的抗肿瘤细胞增殖、转移的作用[1, 2]。从猪小肠肥大细胞中提取出来的UFH和HS一样是以氨基葡萄糖和艾杜醛酸二糖为单位连接起来的硫酸化多糖,该多糖具有较高的抗凝血活性,作为抗凝血药物广泛用于临床。近年来它们所表现的抗肿瘤细胞增殖、侵袭和转移作用,越来越受到人们的关注,特别是其结构与抗肿瘤活性之间的关系已成为研究的焦点[3]。
为了研究肝素酰化位置和抗肿瘤细胞增殖活性之间的关系,研究人员通过制备多糖铵盐,然后在高效催化剂二甲氨基吡啶(DMAP)的作用下进行酰化反应,得到低抗凝血性低分子肝素丁酰化物,这种低分子肝素丁酰化物抗凝血活性明显下降,而抗增殖活性明显提高,但是,30 mg·kg-1的给药剂量,几乎没有临床应用可能性[4]。
本实验参照文献[5],氧化还原方法制备低抗凝血性低分子肝素(LMWH),在此基础上利用DCC/DMAP催化体系,对该LMWH糖环上的羟基进行乙酰化,同时对艾杜醛酸的羧基进行酰基脲修饰,制得低抗凝血性的乙酰化低分子肝素(acetylated low molecular weight heparin,ALMWH)。在X线衍射(XRD)试验、差示扫描量热(DSC)试验,对其结构、构型、理化性质进行研究基础上,对其体外抗肿瘤细胞增殖、转移性能,抗凝血活性进行了检测。
1 材料与方法 1.1 材料 1.1.1 人乳腺癌细胞株MDA-MB-231、MCF-7,购自ATCC (Manassas,VA)。蚌埠医学院生化药理研究室冻存培养。
1.1.2 动物及分组新西兰兔(普通级),♀,体质量(2.3±0.3) kg。随机分为3组,对照组、LMWHP组和ALMWH组,每组6只。
1.1.3 主要试剂MEM培养基、胰蛋白酶、HEPES购于Gibco公司、青链霉素、庆大霉素为市售。胎牛血清购于杭州四季青公司。人工重建基底膜材料Matrigel,购于Sigma公司。Transwell小室(24 孔,0.8 μm)购于Corning公司。市售低分子肝素(LMWHP)购于江苏万邦生化医药股份有限公司。100B-ACT监测仪(北京科仪诚科技开发中心)。LMWH和ALMWH(安徽省生化药物工程技术研究中心自制,专利号201210574597.1)
1.2 方法 1.2.1 LMWH和ALMWH的 X 射线衍射(XRD)光谱经凝胶渗透色谱测知,由UFH降解而得的LMWH的分子量为5683 g/mol,ALMWH的分子量为7707 g/mol。将得到的LMWH或ALMWH粉末在日本MXPAHF型射线衍射仪上扫描,电压40 kV,电流200 mA,TTRAX3θ测角,扫描范围3~60°,扫描速度8°min-1。可得到LMWH和ALMWH的X射线光谱图。
1.2.2 LMWH及ALMWH的差示扫描量热(DSC)分析取5 mg ALMWH和LMWH试样于铝坩锅中,N2气保护。升温速率为20 ℃·min-1,第1次扫描升温至160℃,自然冷却至室温后,第2次扫描升温至180℃,得DSC曲线。
1.2.3 激活凝血时间参照文献的方法测定[6]从家兔心脏取血,注入含有柠檬酸钠的采血管,加药,注入硅藻土测定管,记录激活凝血时间(ACT)。
1.2.4 抗肿瘤细胞增殖活性测试按(3~7)×104细胞/皿的胞密度接种人乳腺癌MDA-MB-231细胞于含有改良的MEM培养基中(10%的灭活FCS,20 mmol·L-1 Hepes,2.0 g·L-1碳酸氢钠,1×10 IU·L-1青霉素,100 mg·L-1链霉素,10 mg·L-1庆大霉素,0.33 mg·L-1胰岛素),37.0℃、95%空气、5% CO2温湿环境下培养。24 h后,吸弃培养液,用无FCS的MEM淋洗细胞2 次,复换以低血清(0.1%FBS)培养液继续培养24 h。继之用0.26、1.29、6.49 μmol·L-1浓度的ALMWH和LMWH处理细胞,于用药后48 h用胰酶释放游离细胞,分别收集、计细胞数。增殖抑制率按下述公式计算:

肿瘤细胞在体外仍然具有迁移能力,细胞划痕实验可以直观的观察划痕后的细胞迁移和侵润能力。12孔板背面做标记,每隔0.5 cm垂直于横轴划痕,每个孔上划痕3条,取对数生长期MDA-MB-231细胞,按每个孔15万个细胞加入孔中,待90%汇合时,沿预先标记好的线划痕。用PBS洗去划痕脱落的细胞,加入含不同药物的无血清培养基,置于5%CO2,37℃,饱和湿度条件下培养,于0、24 h于倒置显微镜下观察细胞的迁移情况。实验分阴性对照组、LMWH组、ALMWH组,每孔设3个复孔,实验重复3次,显微镜下观察细胞迁徙程度,测定细胞的迁移距离。侵袭抑制率按下述公式计算:

将Materigel胶与预冷的无血清MEM培养基按1∶8的比例稀释,50 μL/孔均匀包被在Transwell小室底部膜的内表面,送入细胞培养箱30 min使之成胶。取对数生长、且无血清培养基处理12~24 h的肿瘤细胞,消化离心后,用无血清培养基进行重悬计数。每个内室加入200 μL(含2×104个细胞)含或不含药物的细胞悬液。于24 孔板即外室中加入700 μL的含5% 胎牛血清的MEM培养基。在1 h内每隔10 min观察一次下室,避免有气泡产生。然后移培养箱,于37℃、5% CO2、饱和湿度下培养48 h。取出小室,用PBS 清洗两次,90% 乙醇固定10 min,用PBS湿润的棉签轻轻擦去上室表面未侵袭的细胞,1%结晶紫染液室温下染色10 min。PBS漂去多余染料,显微镜下每孔随机取5个视野拍照,计数并计算抑制率。
1.2.7 统计学方法数据以 ± s表示,采用t检验进行统计学分析。
± s表示,采用t检验进行统计学分析。
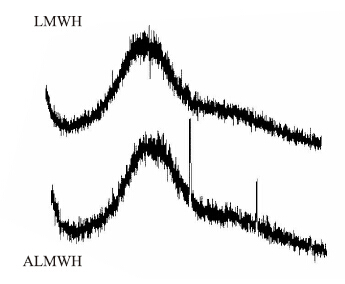
将得到的LMWH和ALMWH粉末在日本MXPAHFX射线衍射仪上扫描,得到LMWH和ALMWH的X射线光谱图。从衍射光谱可以看出,两个非晶鼓包半峰宽并无明显差距,说明ALMWH和LMWH一样,仍然属于非晶结构,ALMWH上的两个锐锋是ALMWH分子表面吸附的NaCl的吸收。
|
| Fig 1 X-ray diffraction analysis of LMWH and ALMWH |
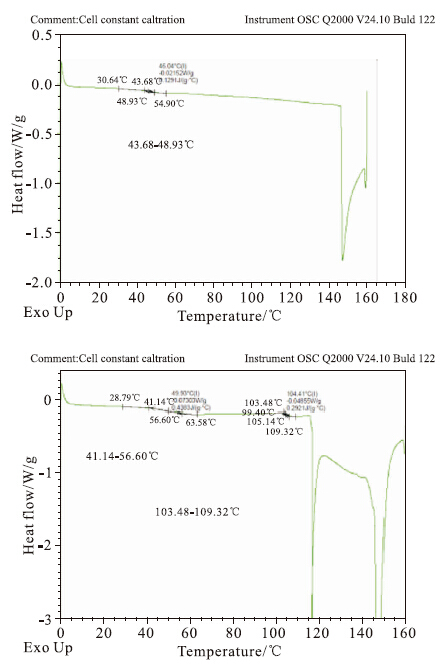
如Fig2所示,LMWH在0~180℃升温过程中,在(43.68~48.93)℃(该温度属于老化温度)处有一个缓慢的热吸收。在(148~160)℃有一个强吸热峰,是LMWH失去结合水产生的热吸收。ALMWH的老化温度明显变宽,为(41.14~56.60)℃。(103.48~109.32)℃处有个小的吸收,是ALMWH中自由水失水产生的热吸收,其结合水失水产生的热吸收温度变低,吸收带变宽,为(117~160)℃,吸收峰变大。提示ALMWH有新的吸水性取代基存在,ALMWH对于水的结合能力增强。
|
| Fig 2 Differential scanning calorimetry of LMWHP and ALMWH |
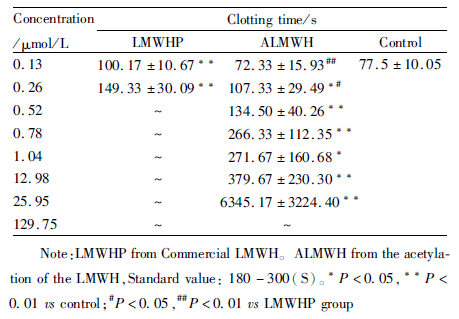
为了检验ALMWH是否降低了抗凝血活性,将市售LMWHP和ALMWH用家兔血浆各配制8个浓度进行ACT测定。结果如Tab1所示,ALMWH的抗凝血活性较市售LMWHP明显降低,尤其在低浓度范围内(0.13~1.04 μmol·L-1),ALMWH表现出极低的抗凝活性,0.26 μmol药物浓度的ALMWH与LMWHP比较,LMWHP抗凝活性明显提高,ALMWH抗凝血活性较LMWHP明显降低。
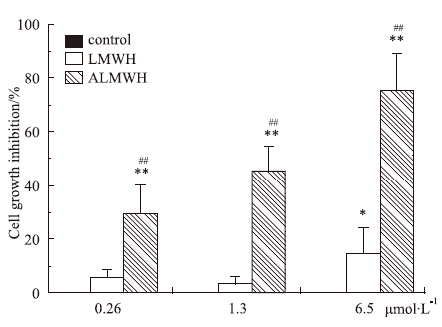
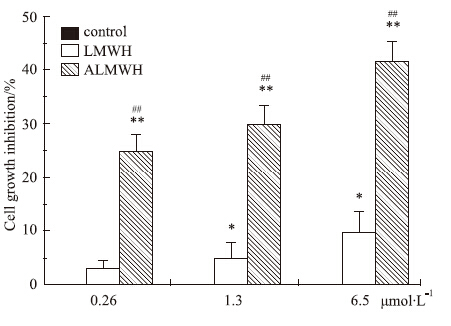
LMWH和ALMWH抗肿瘤细胞增殖效应的结果见Fig3,Fig4。1.3 μmol·L-1的ALMWH即可对MDA-MB-231、MCF-7细胞的增殖产生明显的抑制作用,且随着处理时间的延长,对肿瘤细胞的增殖抑制作用增强。ALMWH对于肿瘤细胞增殖活动呈现出明显的剂量依赖性。
|
| Fig 3 Effect of ALMWH on the proliferation of MDA-MB-231 LMWH from UFH was degraded by sodium periodate treatment followed by sodium borohydride reduction. ALMWH was from the acetylation of the LMWH. The results were from 3 separate experiments (total n=9)*P < 0.05,**P < 0.01 vs control,and #P < 0.05,##P < 0.01 vs LMWH. |
|
| Fig 4 Effect of ALMWH on the proliferation of MCF-7 The results were from 3 separate experiments (total n=9)*P<0.05,**P<0.01 vs control,##P<0.01 vs LMWH |
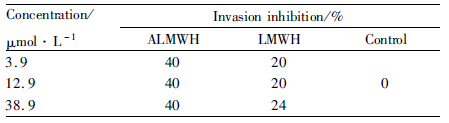
划痕实验是测定肿瘤细胞迁移能力的方法之一。在培养的单层细胞上划痕,然后加入药物观察其对肿瘤细胞迁移的影响。不同药物对乳腺癌细胞MDA-MB-231细胞迁移能力的抑制见Fig5、Tab2。经3个不同浓度(3.9、12.9、38.9 μmol·L-1)LWMH处理的MDA-MB-231细胞24 h,细胞保持着活跃的迁移能力,与此相比,3个不同浓度的ALMWH表现出对乳腺癌细胞迁移的明显抑制,抑制率均达到40%。

|
| Fig 5 Effects of ALMWH and LMWH on migration of breast cancer cells (Magnification: 40 times) |
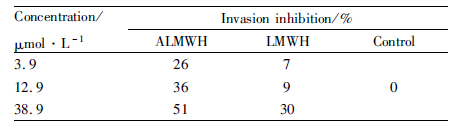
ALMWH抑制人乳腺癌MDA-MB-231细胞的侵袭实验结果见Fig6。3.9、12.9、38.9 μmol·L-1的LMWH和ALMWH分别处理MDA-MB-231细胞48 h后,将侵袭和迁移的细胞进行固定染色,分别于200×和400×显微镜下拍照并计数统计(Tab3),可见3.9、12.9 μmol·L-1的LMWH对MDA-MB-231细胞的侵袭无抑制作用,38.9 μmol·L-1的LMWH显示30%的侵袭抑制率。但ALMWH对于MDA-MB-231细胞的侵袭抑制作用明显,38.9 μmol·L-1的ALMWH对于MDA-MB-231细胞的侵袭抑制作用达到51%。

|
| Fig 6 Impacts of ALMWH and LMWH on invasive activity of MDA-MB-231 cells |
HS具有明显的抗肿瘤细胞增殖的作用[1, 2]。而UFH的这种作用要低得多,且抗凝血活性强,易引发出血,限制了其作为抗肿瘤药物的应用。HS与UFH在分子结构上的主要区别在于硫酸化程度与艾杜醛酸的含量。HS的低硫酸化、高乙酰化、低艾杜醛酸量,这种分子结构有利于其与UFH/HS结合蛋白相互作用,完成多种多样的生理调控作用。UFH硫酸化程度高,艾杜醛酸含量高[7],分子链比HS更加柔软,易曲挠、易旋转[8]。我们用氧化还原方法断裂了艾杜糖醛酸的C2-C3键,使其抗凝血活性大为降低(Tab1)。在此基础上利用DCC/DMAP催化体系对LMWH的艾杜醛酸的羧基进行酰基脲修饰,并进行糖环上羟基的乙酰化,所制得的低抗凝血性的ALMWH,经X射线检测,ALMWH和LMWH虽同属非晶结构,但DSC分析则证明ALMWH中有新的结合水与自由水存在,说明对LMWH艾杜醛酸的羧基的酰基脲修饰是成功的。氢核磁1-HNMR检测显示ALMWH的2.3 ppm的乙酰基的积分面积比LMWH 2.0 ppm处的积分面积明显增加,证实LMWH的羟基确产生了乙酰化修饰。从艾杜醛酸的一位碳上氢质子吸收峰在5.2 ppm处有4个分裂,证实艾杜醛酸亦被选择性修饰。
市售低分子肝素对乳腺癌细胞的增殖活性的抑制虽呈剂量依赖性,然而在低剂量时作用不明显[9]。本研究用氧化还原方法制备了LMWH后,用DCC/DMAP催化体系对该LMWH糖环上的羟基进行乙酰化,所获得的ALMWH在低浓度(0.26、1.29、6.49 μmol·L-1)时即表现较之LMWH为大的抗肿瘤细胞增殖作用,说明通过对LMWH的化学改造确可提高LMWH的抗癌活性,并能降低其抗凝血活性。
LMWH抗肿瘤细胞侵袭转移也被业界公认[10]。低抗凝血性LMWH可以明显抑制胰腺癌的黏附和转移[11]。但是,其抗转移作用机制并不十分明了。转移是一个复杂过程,表现为多阶段性、多基因参与多种转录因子调控,并涉及肿瘤细胞异常增殖、黏附、运动、细胞外基质降解,血管生成[12, 13, 14]。Sudha等[11]用LMWH抑制胰腺癌转移的最低起效给药剂量为20 mg·kg-1,据此,用于抑制乳腺癌细胞迁移的浓度选定于3.89、12.98、38.93 μmol。实验结果显示,在该浓度的LMWH对于乳腺癌MDA-MB-231细胞的迁移几无作用。而同样3种浓度的ALMWH却表现出明显的抗迁移作用。
ALMWH比LMWH具有增强的抗乳腺癌MDA-MB-231细胞增殖、转移作用。抗凝血活性低,出血性风险低,与水分子结合能力强。本研究为低毒性抗肿瘤药物筛选提供了基本方法。
| [1] | 蒋志文,Le Bourhis Xuefen,Hubert Hondermarck.肿瘤细胞的进行性增殖和Bip/GRP78的合成[J]. 中国药理学通报, 2002, 18(1):79-83. Jiang Z W, Le Bourhis Xuefen, Hubert Hodermarck. Progressing proliferation of cancer cells and the synthesis of Bip/GRP78 [J]. Chin Pharmacol Bull, 2002, 18(1):79-83. |
| [2] | 刘 浩,蒋志文,童旭辉, 等.硫酸乙酰肝素蛋白聚糖对C3H小鼠乳腺癌移植瘤的抑制作用及其机制[J]. 中国药理学通报, 2008, 24(6):744-8. Liu H, Jiang Z W, Tong X H, et al.Inhibition and mechanism of heparan aulfate proteoglycan on xenograft breaswt cancer in C3H mice[J]. Chin Pharmacol Bull, 2008, 24(6):744-8. |
| [3] | Crabbe T, Ioannou C, Docherty A J. Human progelatinase A can be activated by autolysis at a rate that is concentration-dependent and enhanced by heparin bound to the C-terminal domain[J].Eur J Biochem, 1993, 218(2): 431-8. |
| [4] | Yu L, Garg H G, Li B, et al. Antitumor effect of butanoylated heparin with low anticoagulant activity on lung cancer growth in mice and rats[J]. Curr Cancer Drug Targets, 2010, 10(2):229-41. |
| [5] | Garg H G, Mrabat H, Yu L, et al. Anti-proliferative effects of O-acyl-low-molecular-weight heparin derivatives on bovine pulmonary artery smooth muscle cells[J].Glycoconj J, 2011, 28(6):419-26. |
| [6] | Hostettler N, Naggi A, Torri G, et al. P-selectin and heparins dependent antimetastatic activity of non-anticoagulant heparins[J]. FASEB J, 2007, 21(13):3562-72. |
| [7] | Lindahl U, Lidholt K, Spillman D, et al. More to heparin than anticoagulation[J]. Thromb Res, 1994, 75(1):1-32. |
| [8] | Rabenstein D L.肝素和硫酸乙酰肝素的三维结构[J]. 食品与药, 2012, 14(9):3-4. Rabenstein D L.three dimensional structures of heparin and heparn sulfate[J].Food Drug, 2012, 14(9):3-4. |
| [9] | 王 鹏,庞 新,姜 达. 低分子肝素对人乳腺癌MCF-7细胞的体外作用及其机制研究[J]. 临床荟萃, 2011, 24:2149-52. Wang P, Pang X, Jiang D.Study for antimeoplastic effect and mechanism of low molecular wright heparin on MCF-7 breast cancer cells [J].Clin Focus, 2011, 24:2149-52. |
| [10] | Engelberg H. Actions of heparin that may affect the malignant process[J]. Cancer, 1999, 85(2):257-72. |
| [11] | Sudha T, Phillips P, Kanaan C, et al.Inhibitory effect of non-anticoagulant heparin (S-NACH) on pancreatic cancer cell adhesion and metastasis in human umbilical cord vessel segment and in mouse model[J]. Clin Exp Met, 2012, 29 (5): 431-9. |
| [12] | 曾 亮, 罗非君, 曹 亚.转录因子调控肿瘤转移的分子机制研究进展[J]. 中国肿瘤, 2001, 10(5):286-8. Zeng L, Luo F J, Cao Y.Progress on molecular mechanisms of tumor metastasis regulated by transcription factors[J].Bull Chin Cancer, 2011, 10(10):286-8. |
| [13] | 何振辉,何太平,翁闪凡, 等. 芦荟大黄素对高转移乳腺癌细胞MDA-MB-231体外转移潜能的影响[J]. 中国药理学通报, 2013, 29(8):1114-8. He Z H, He T P, Weng S F, et al. Effect of Aloe emodin on metastatic abilities of human high metastatic breast cancer MDA-MB-231 cells in vitro[J]. Chin Pharmacol Bull, 2013, 29(8):1114-8. |
| [14] | 张阿丽, 张 弓, 彭 晋,等.内皮素-1活化ROCK/SLUG 诱导人卵巢癌细胞发生上皮向间充质转分化[J]. 中国药理学通报, 2012, 28(5):680-6. Zhang A L, Zhang G, Peng J, et al. Endothelin-1-induced epithelial to mesenchymal transition in human ovarian cancer cells via ROCK/SLUG pathway[J]. Chin Pharmacol Bull, 2012, 28(5):680-6. |