


 , LI Xue-min, LI Zhao-jie, ZUO Tao, TANG Qing-juan
, LI Xue-min, LI Zhao-jie, ZUO Tao, TANG Qing-juan
 , CHANG Yao-guang, WANG Jing-feng, XUE Chang-hu
, CHANG Yao-guang, WANG Jing-feng, XUE Chang-hu
多糖是海参体壁的主要活性物质,主要包括海参岩藻聚糖硫酸酯(sea cucumber fucoidan,SC-FUC)和海参硫酸软骨素(sea cucumber chondroitin sulfate,SC-CHS)两种组分。岩藻聚糖硫酸酯是一种主要由岩藻糖及硫酸酯基团组成的多糖类物质,近年来的研究主要集中于海洋藻类,已被证实具有抗病毒、抗氧化、抗凝血、抗血栓、抗肿瘤、增强免疫力等多种生物活性[1, 2]。相比之下,针对SC-FUC的活性研究较少,主要有抗肿瘤、抗凝血、解酒护肝等方面的报道[3, 4]。
海地瓜属于棘皮动物门芋海参科动物,在我国海域产量丰富、价格低廉,目前对其开发利用处于初级阶段。本实验室在前期研究中,利用自主筛选的海参岩藻聚糖硫酸酯酶(CZ1127FuCas)对海地瓜SC-FUC进行可控酶解,获得不同分子量SC-FUC,并对其进行结构解析和活性研究。研究表明,海地瓜SC-FUC是由[→3-α-L-fuc-2,4(OSO3)-1→3-α-L-fuc-1→3-α-L-fuc-1→3-α-L-fuc-1→]n组成的重复单元[5],分子量越小消化吸收率越高;不同分子量SC-FUC对小鼠的免疫调节作用不同,50 ku左右的SC-FUC效果最佳[5, 6]。
巨噬细胞以不同形式广泛分布在机体不同组织中,是抵抗微生物第一道防线之一。激活的巨噬细胞可以直接杀伤病原微生物,抑制多种肿瘤细胞的生长,清除凋亡细胞和突变细胞,并通过分泌NO、IL-6、IL-10、TNF-α等免疫活性分子,在先天性免疫防御和获得性免疫应答中起着不可忽视的作用[7, 8]。此外,巨噬细胞还可以作为抗原提呈细胞与T细胞相互作用启动免疫反应。根据巨噬细胞不同功能特性及其诱导Th1或Th2型免疫应答,通常将其相应分为M1和M2两型[9]。本研究以小鼠巨噬细胞RAW264.7为细胞模型,以50 ku SC-FUC为受试物,检测其对巨噬细胞增殖、吞噬功能及细胞因子分泌等细胞行为的影响,并对相关信号通路进行探讨,以阐明SC-FUC的免疫调控作用机制。
1 材料与方法 1.1 实验材料与仪器实验材料:低分子量海地瓜SC-FUC由本实验室制备,分子质量约为50 ku,纯度>90%;小鼠RAW264.7巨噬细胞,购自上海细胞生物研究所;DMEM培养基,美国Hyclone公司;胎牛血清(FBS),上海依科赛生物制品有限公司;Dextran、噻唑蓝(MTT),美国Sigma公司;Griess试剂盒,南京建成生物工程研究所;DMSO,上海伟进生物科技有限公司;中性红,北京百灵威科技有限公司;TRIzol regent,美国Invitrogen公司;随机引物(B0043-9),上海生工生物有限公司;M-MLV逆转录酶,美国Promega公司;dNTP,美国Frementes公司;RNA酶抑制剂,上海生工生物有限公司;FastStart Univeral SYBR Green Master (Rox),RNase Inhibitor,美国Roche公司。
仪器:Real-time PCR仪(iQ5型),美国Bio-Rad公司;细胞CO2培养箱,美国Nuaire公司;电子显微镜,上海长方光学仪器有限公司;多功能酶标仪,美国伯腾仪器有限公司。
1.2 方法 1.2.1 小鼠巨噬细胞的培养小鼠巨噬细胞RAW264.7购自上海细胞生物研究所。采用DMEM培养基(含10%胎牛血清),于37℃,5% CO2培养箱中培养。隔天换液,2~3 d进行一次传代处理,用0.25%胰酶消化细胞,取处于对数生长期的细胞进行后续实验。
1.2.2 MTT法检测巨噬细胞的增殖活性调整巨噬细胞密度为1×108个·L-1,接种于96孔板中,每孔100 μL。37℃,5% CO2培养箱中培养过夜使细胞贴壁。弃上清,分别加入200 μL不同浓度的50 ku SC-FUC (终浓度分别为25、50、100、200 mg·L-1),每个浓度设6个复孔,以Dextran (200 mg·L-1)为对照组。设定不同培养时间(6、12、24 h),37℃,5% CO2培养。吸弃细胞上清,每孔加200 μL MTT溶液(MTT:DMEM=1:8),继续培养4 h。弃上清,每孔加入150 μL酸化异丙醇溶液,充分溶解细胞沉淀,酶标仪570 nm波长处测定吸光值。
1.2.3 中性红法检测巨噬细胞的吞噬活性调整巨噬细胞密度为1×108个·L-1,细胞布板情况及培养条件同上。
设定不同培养时间(6、12、24 h),37℃,5% CO2培养。吸弃细胞上清,每孔加100 μL 1%的中性红溶液,继续培养30 min。弃上清,每孔加入200 μL预温的PBS,清洗细胞,重复操作3次。加入200 μL醋酸-乙醇(1:1)溶解细胞,酶标仪540 nm波长处测定吸光值。
1.2.4 Griess试剂法检测巨噬细胞培养上清液中的NO含量调整巨噬细胞细胞密度为3×108个·L-1,细胞布板情况及培养条件同上。
设定不同孵育时间(6、12、24 h),37℃,5% CO2条件培养。培养结束后,取细胞培养上清液,测定NO含量,按试剂盒说明书的步骤操作。
1.2.5 Real time-PCR法检测巨噬细胞IL-6、IL-10、Toll样受体和信号分子MyD88、TRIF、NF-κB的mRNA表达量 1.2.5.1 总RNA提取结合前几项实验结果,选用SC-FUC效果较为明显的剂量及处理时间(100 mg·L-1,12 h)作用于巨噬细胞。取小鼠巨噬细胞(约0.1 g),加入1 mL TRIzol试剂,进行匀浆处理,匀浆液转入1.5 mL灭酶EP管,室温放置5 min,加入0.2 mL氯仿充分混匀,室温放置10 min以沉淀蛋白。12 000 r·min-1,离心15 min (4℃),转移上清液至新的灭酶EP管中,加入与上清液等体积的异丙醇溶液,充分混匀,室温放置10 min以沉淀RNA。12 000 r·min-1离心10 min (4℃),弃上清,沉淀加入1 mL 75%的预冷乙醇,用灭酶枪头温和吹打进行清洗。10 000 r·min-1离心5 min (4℃),吸弃上清,沉淀于室温下静置晾干。根据沉淀产量添加适量DEPC处理水,充分溶解沉淀,即得到总RNA样品。采用Nanodrop 2000c检测RNA样品纯度和含量,进行核酸电泳确定RNA质量。
1.2.5.2 cDNA合成取2 μg RNA样品进行反转录操作。取稀释到适宜浓度(体积小于10 μL)的RNA样品于200 μL灭酶离心管中,加1 μg随机引物(2 μL),补加DEPC水至12.5 μL。70℃加热5 min,立刻冰浴冷却。加入1.25 μL dNTP (10 mmol·L-1),0.625 μL RNA酶抑制剂(40 U/μL),1 μL M-MLV逆转录酶(200 U/μL),5 μL M-MLV 5×Reaction Buffer,加DEPC处理水,补充总体积为25 μL。进行30℃ 10 min,37℃ 60 min,90℃ 5 min反应,合成cDNA。
1.2.5.3 Real time-PCR反应按照FastStart Univeral SYBR Green Master说明书进行RT-PCR操作。每个反应体系中加入上、下游引物各0.75 μL,SYBR Green试剂12.5 μL,cDNA样品2.5~5 μL,加DEPC处理水,补充总体积为25 μL。反应条件:95℃ 10 min后95℃ 15 s,60℃ 20 s,95℃ 15 s (45个循环),然后由65℃升温至95℃(0.5℃/10 s),检测目的基因产物的单一性。用目的基因与相应β-actin表达量比值表示该基因的mRNA相对表达量,并以正常组为对照,表达量设为100%。基因引物采用Primer Premier 5.0软件设计,并使用Blast程序进行验证,由上海生工生物有限公司合成。IL-6、IL-10、TLR3、TLR4、TLR5、TLR7、TLR9和信号分子MyD88,TRIF,NF-κB及β-actin的特异性引物序列见Tab1。
实验数据用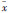 ± s表示,数据分析采用SPSS 18.0软件进行单因素方差分析,同时进行one way anova LSD组间比较。
± s表示,数据分析采用SPSS 18.0软件进行单因素方差分析,同时进行one way anova LSD组间比较。
以不同浓度(25~200 mg·L-1) SC-FUC作用于巨噬细胞,采用MTT法检测细胞的增殖情况。结果显示:作用6 h和12 h后,SC-FUC均可促进巨噬细胞增殖,各剂量SC-FUC处理组细胞数量相比正常组均明显的增多(P<0.01);24 h后,SC-FUC对巨噬细胞无明显的促增殖作用(Fig1)。该结果表明,SC-FUC可以促进巨噬细胞的增殖,且在作用前期(6 h和12 h)效果明显。
|
|
Fig 1
Effects of SC-FUC on macrophage cell proliferation (  ± s,n=6)##P<0.01 vs control ± s,n=6)##P<0.01 vs control
|
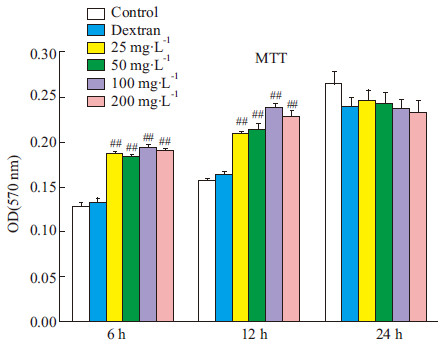
以不同浓度(25~200 mg·L-1)50 ku SC-FUC作用于巨噬细胞,通过中性红吞噬实验检测细胞的吞噬能力变化。结果显示:SC-FUC作用6 h即可明显增强巨噬细胞的吞噬活性,3个较高剂量SC-FUC处理组吞噬中性红的能力相比正常组均明显升高(P<0.01);作用12 h时,SC-FUC处理组巨噬细胞的吞噬活性仍明显高于正常组(Fig2)。该结果提示,SC-FUC可以有效增强巨噬细胞的吞噬能力,且在作用前期(6 h和12 h)效果明显。
|
|
Fig 2
Effects of SC-FUC on macrophage cell
phagocytosis activity ( 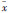 ± s,n=6)
#P<0.05, ##P<0.01 vs control ± s,n=6)
#P<0.05, ##P<0.01 vs control
|
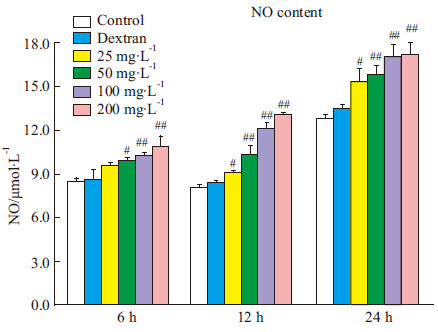
NO是巨噬细胞活化的标志,是巨噬细胞吞噬病原微生物的主要效应因子。实验结果显示,SC-FUC作用于巨噬细胞6h即可激活巨噬细胞,NO分泌量上升,且呈现剂量效应,高剂量SC-FUC的效果最明显;作用12 h和24 h后,SC-FUC处理组巨噬细胞均被明显激活,细胞培养液中NO含量相比正常组均呈现明显增加(P<0.01或P<0.05)(Fig3)。上述结果提示,SC-FUC能够有效激活巨噬细胞,增强巨噬细胞的免疫功能。
|
|
Fig 3
Effects of SC-FUC on macrophage cell NO secretion ( 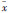 ± s,n=6)
#P<0.05, ##P<0.01 vs control ± s,n=6)
#P<0.05, ##P<0.01 vs control
|
IL-6为M1型巨噬细胞分泌的炎症因子,在机体整体和局部免疫反应中均发挥重要作用;IL-10是为M2型巨噬细胞分泌一种抗炎因子,能够抑制炎症因子的持续过量表达。SC-FUC作用于巨噬细胞12 h后,IL-6和IL-10的基因表达水平均明显上升(Fig4)。该结果提示,SC-FUC能同时诱发巨噬细胞的M1型和M2型免疫反应,促炎因子和抗炎因子之间存在相互调节作用。

|
|
Fig 4
Effects of SC-FUC on macrophage IL-6 and
IL-10 mRNA expression ( 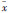 ± s,n=6)
#P<0.05, ##P<0.01 vs control ± s,n=6)
#P<0.05, ##P<0.01 vs control
|
巨噬细胞被激活后,所分泌的细胞因子主要由Toll样受体(Toll-like receptors,TLRs)介导,而TLRs介导的MyD88依赖途径是细胞内激活NF-κB的主要信号通路[10]。因此,本文对TLRs介导的信号通路做了进一步探究,以探讨SC-FUC引起免疫应答的分子途径。实验结果显示,SC-FUC可以促进TLR4、TLR5、TLR9及信号分子MyD88、TRIF、NF-κB的表达量明显上调(P<0.05),而对TLR3、TLR7的表达无影响(Fig5)。该结果提示,SC-FUC可以上调TLR4、TLR5、TLR9的表达,促进MyD88和TRIF的表达,激活NF-κB通路,进而调节巨噬细胞的免疫功能。
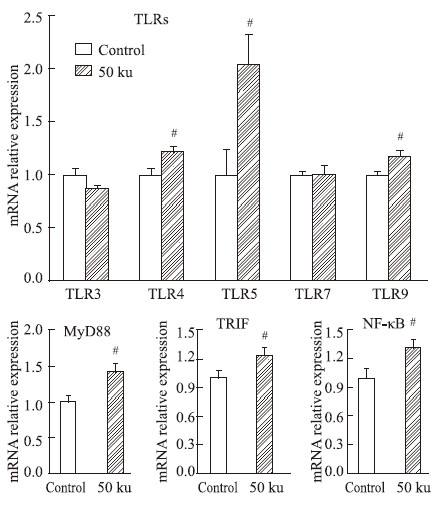
|
|
Fig 5
Effects of SC-FUC on macrophage TLRs and
signaling molecules mRNA expression (  ± s,n=6)
#P<0.05 vs control ± s,n=6)
#P<0.05 vs control
|
多糖主要是通过与免疫细胞的相互作用来发挥免疫调节和抗肿瘤等功能。作用机制为通过细胞内一条或多条信号转导通路的介导,调节免疫细胞分泌细胞因子或生物活性成分,进而产生一系列的生物学效应[11]。为了阐明SC-FUC的免疫调控作用,本文研究了其对巨噬细胞增殖、吞噬功能及细胞因子分泌等细胞行为的影响,并对相关信号通路进行了探讨。
巨噬细胞是机体最重要的免疫细胞之一,在机体预防感染、自身稳定和免疫监视中都起着重要的作用。巨噬细胞分泌的各种免疫活性分子,如NO、TNF-α、IL-6、IL-10等,在先天性免疫预防和获得性免疫应答中有不可替代的作用。巨噬细胞除免疫作用外,还有吞噬作用。巨噬细胞将各类病原微生物、机体衰老死亡的细胞和肿瘤细胞等大颗粒抗原摄入胞内,最后形成吞噬溶酶体,在多种酶的作用下,杀灭和消化抗原性异物[12]。中性红实验结果显示,SC-FUC高剂量组能明显增强巨噬细胞的吞噬活性(P<0.01),从而更有效地吞噬病原菌、保护机体免受其感染。
NO是巨噬细胞分泌的活化巨噬细胞、吞噬病原微生物的主要效应分子,也是一种内源性血管缩张活性因子。有效分泌NO是巨噬细胞发挥免疫功能及抗肿瘤活性的基本条件。SC-FUC作用后,NO的分泌呈剂量效应(P<0.01或P<0.05),表明SC-FUC能够有效激活巨噬细胞,增强巨噬细胞的免疫功能。
IL-6、IL-10分别由M1型和M2型巨噬细胞所分泌,是巨噬细胞发挥免疫功能的重要细胞因子。SC-FUC能引起IL-6、IL-10表达量同时上调,表明能同时诱发巨噬细胞的M1型和M2型免疫反应,促炎因子和抗炎因子之间存在相互调节作用。
Toll样受体是一种表达于巨噬细胞表面的跨膜蛋白,有多种类型。TLRs可以通过各自不同的配基识别相应的病原相关分子模式(PAMPs),激活一系列的信号通路[13]。TLRs识别同源配基后能够激活转录因子NF-κB,并相继激活一系列在免疫反应和炎症反应中发挥重要作用的炎症因子和趋化因子[14]。外界病原菌入侵作用于细胞膜上的TLRs,并使其活化。TLRs转导途径主要包括MyD88依赖性途径和MyD88非依赖性途径(即TRIF/TRAM途径)。前者介导大部分TLRs,后者介导TLR3;TLR4比较特殊,由MyD88和TRIF途径共同介导[15]。本研究结果提示,SC-FUC能上调TLR4,5,9的表达,募集细胞内的接头分子MyD88和TRIF,激活NF-κB通路,进而调节巨噬细胞的功能。
本研究提示,低分子量SC-FUC能够有效激活巨噬细胞,促进其分泌NO、IL-6、IL-10等细胞因子,从而发挥免疫调节作用。该研究结果为低分子量SC-FUC的开发应用提供了理论基础,对低值海参的精深加工具有指导性意义。本文在探讨海参岩藻聚糖硫酸酯调控的可能机制时,仅对通路因子的mRNA表达量进行了检测,进一步验证尚需对相关因子的蛋白表达量进行检测。
| [1] | Costa L S,Fidelis G P,Cordeiro S L,et al.Biological activities of sulfated polysaccharides from tropical seaweeds[J].Biomed Pharmacother,2010,64(1):21-8. |
| [2] | Pomin V H,Mourao P A.Structure,biology,evolution,and medical importance of sulfated fucans and galactans[J].Glycobiology,2008,18(12):1016-27. |
| [3] | 朱昱哲,王静凤,石迪,等.海参岩藻聚糖硫酸酯对长期饮酒小鼠肝脏保护作用的研究[J].营养学报,2012,34(5):474-7.Zhu Y Z,Wang J F,Shi D,et al.The protective effect of sea cucumber fucoidan on the liver of mice in chronic alcoholism[J].Acta Nutrimenta Sin,2012,34(5):474-7. |
| [4] | 张珣,王静风,徐雷,等.海地瓜和冰岛刺参海参岩藻聚糖硫酸酯抗肿瘤作用的比较研究[J].食品科学,2012,33(7):251-5.Zhang X,Wang J F,Xu L,et al.Comparative anti-tumor effects of fucoidan from two sea cucumber species on spontaneous metastasis of lewis lung carcinoma in mouse[J].Food Sci,2012,33(7):251-5. |
| [5] | 常耀光.海参岩藻聚糖硫酸酯及其酶解产物的制备、结构与活性研究[D].中国海洋大学,2010.Chang Y G.Study on the producing,strucuture and activity of sea cucumber fucoidan and its enzymatic degradation products[D].Ocean University of China,2010. |
| [6] | 武晓琳.分子量对海参岩藻聚糖硫酸酯活性和消化吸收的影响研究[D].中国海洋大学,2011. Wu X L.Study on the activity and absorption characterisitic of sea cucumber fucoidan and its partially degradation products[D].Ocean University of China,2011. |
| [7] | Yin X,Chen L,Liu Y,et al.Enhancement of the innate immune response of bladder epithelial cells by Astragalus polysaccharides through upregulation of TLR4 expression[J].Biochem Biophys Res Commun,2010,397(2):232-8. |
| [8] | 陈鹏,方斌,易浪,等.桃红四物汤含药血清对巨噬细胞的影响[J].中国药理学通报,2013,29(4):582-4.[8]Chen P,Fang B,Yi L,et al.Effects of Taohongsiwu decoction on macrophages[J].Chin Pharmacol Bull,2013,29(4):582-4. |
| [9] | Van Ginderachter J A,Movahedi K,Hassanzadeh G G,et al.Classical and alternative activation of mononuclear phagocytes:picking the best of both worlds for tumor promotion[J].Immunobiology,2006,211(6-8):487-501. |
| [10] | Biswas A,Banerjee P,Mukherjee G,et al.Porin of Shigella dysenteriae activates mouse peritoneal macrophage through Toll-like receptors 2 and 6 to induce polarized type I response[J].Mol Immunol,2007,44(5):812-20. |
| [11] | Schepetkin I A,Quinn M T.Botanical polysaccharides:macrophage immunomodulation and therapeutic potential[J].Int Immunopharmacol,2006,6(3):317-33. |
| [12] | 霍德胜,柳忠辉,王世瑶,等.激活素A对小鼠巨噬细胞RAW264.7吞噬活性的促进作用[J].中国生物制品学杂志,2008,21(9):759-61.Huo D S,Liu Z H,Wang S Y,et al.Activin a enhances phagocytosis of murine macrophage cell line RAW2647[J].Chin J Biologicals,2008,21(9):759-61. |
| [13] | Chen W,Wang J,An H,et al.Heat shock up-regulates TLR9 expression in human B cells through activation of ERK and NF-kappa B signal pathways[J].Immunol Lett,2005,98(1):153-9. |
| [14] | Lee S J,Nam W D,Na H J,et al.CT20126,a novel immunosuppressant,prevents collagen-induced arthritis through the down-regulation of inflammatory gene expression by inhibiting NF-kappa B activation[J].Biochem Pharmacol,2008,76(1):79-90. |
| [15] | Tanaka T,Legat A,Adam E,et al.DiC14-amidine cationic liposomes stimulate myeloid dendritic cells through Toll-like receptor 4[J].Eur J Immunol,2008,38(5):1351-7. |
