


食管癌是我国常见的恶性肿瘤之一,发病率居恶性肿瘤第5位,死亡率居第4位[1],5年生存率低于15%[2],但其发病机制尚不十分清楚,且目前的治疗效果不甚理想。
在正常生理状态下,细胞分化与凋亡维持在平衡状态。当细胞不能接受信号启动凋亡,处于无限生长状态就可能引起肿瘤的发生。如抑癌基因p53表达降低与多种肿瘤发生密切相关,包括食管癌。p53可引起细胞周期阻滞、凋亡及维持基因组稳定性从而抑制肿瘤[3],但是p53在食管癌中失活的机制有待进一步阐明。
磷脂酶Cε1(phospholipase C epsilon 1,PLCE1)是近年发现的磷脂酶C家族的新成员,其定位的染色体是最近发现的食管鳞癌易感位点。PLCE1在细胞信号转导过程中起重要作用,调节细胞生长、增殖、分化,影响细胞骨架改变、细胞运动、细胞凋亡、肿瘤生长及发展等生物学行为。本研究拟通过检测PLCE1在食管癌细胞株OE33和CP-C中的表达,验证改变PLCE1表达对食管癌细胞功能的影响,初步阐明PLCE1通过p53途径在食管癌细胞中发挥作用的机制。
1 材料与方法 1.1 试剂PLCE1抗体(sc-28402)、p53抗体(sc-6243)、兔抗羊(sc-276)及羊抗兔二抗(sc-2004)、β-actin抗体(sc-130301)、PLCE1 siRNA(sc-44024)和对照siRNA(sc-37007)购自Santa Cruz Biotech。Annexin V试剂盒购自Sigma。DNA纯化盒购自Promega。甲基化检测盒购自Clontech。转染试剂lipofectamine2000、质粒抽提试剂盒、qRT-PCR和Western blot所用试剂均购自Invitrogen。PLCE1过表达载体(pcDNA3.1-PLCE1 )由中山大学肿瘤医院刘晓萍博士惠赠。
1.2 细胞株、培养及转染食管癌细胞株OE33、CP-C及正常细胞株HEK293均购于中科院上海细胞库,用含10%胎牛血清、2 mmol·L-1谷氨酰胺、100 kU·L-1青霉素和0.1%链霉素的DMEM细胞培养液,在二氧化碳培养箱内(37℃、5%CO2、饱和湿度)连续培养并传代。培养液每3 d换液1次。当细胞长至瓶底80%时进行处理。细胞转染,根据转染试剂说明书进行,分别将siRNA及对照无关系列或PLCE1过表达载体、对照载体转染至食管癌细胞中,并设空白对照;转染48 h后提取总RNA或进行细胞凋亡检测,转染72 h后提取细胞总蛋白。
1.3 实时荧光定量PCR法(qRT-PCR)TRIzol法提取细胞总RNA并定量;按试剂盒说明进行逆转录合成cDNA。应用实时荧光定量RT-PCR检测,β-actin作为内参。PCR引物:p53:上游引物5′-GGAAATCTCACCCCATCCCA-3′,下游引物 5′-CAGTAAGCCAAGATCACGCC-3′;PLCE1:上游引物5′-GAGCTGCAATCGAAGTCTGG-3′,下游引物 5′-AAGGCCTTCTGTGAGTCCTC-3′; β-actin(上游引物5′-CTCCATCCTGGCCTCGCTGT-3′,下游引物 5′-GCTGTCACCTTCACCGTTCC-3′)。反应体系为20 μL,反应条件为95℃ 3 min预变性,95℃ 10 s,55℃ 30 s,39个循环,并在每个循环延伸末端点收集荧光信号,绘制扩增曲线,基因的表达量用2-ΔΔCt表示。
1.4 Western blot预冷PBS洗涤细胞3次,加入全蛋白裂解液后冰上裂解10 min收集蛋白。将抽提蛋白用BCA法定量后,取50 μg于100 V泳道进行SDS-PAGE;电泳结束后,以90 V、90 min将蛋白转移至PVDF膜; 5%TBS牛奶室温封闭1 h,孵育一抗羊抗p53(1 ∶ 1 000)、兔抗PLCE1 (1 ∶ 500)4 ℃过夜,二抗(兔抗羊1 ∶ 5 000、羊抗兔1 ∶ 2 000)室温孵育1 h。每次抗体孵育后用TBST洗膜15 min,共3次。ECL试剂盒进行发光反应,压片、显影、定影,观察蛋白印迹并进行图像分析。
1.5 细胞凋亡检测根据试剂盒进行操作,收集CP-C细胞先用Annexin V染色,再用碘化丙啶 (propidium iodide,PI,5 mg·L-1,15 min)染色。流式细胞仪检测细胞凋亡率,PI+细胞首先被检出,Annexin V+细胞频数在剩余细胞中确定。
1.6 p53甲基化检测用基因组DNA纯化试剂盒提取细胞gDNA,甲基化检测盒重亚硫酸盐法检测p53甲基化状态。p53启动子甲基化引物:上游引物 5′-TTTCGTTTTTAAAGTTAGGTTTCGT-3′,下游引物 5′-TCTCTAAATACTTCCGACGCG-3′;非甲基化引物:上游引物 5′-TTTTGTTTTTAAAGTTAGGTTTTGT-3′,下游引物 5′-CTCTCTAAATACTTCCAACACACC-3′。1%琼脂糖凝胶电泳PCR产物,紫外光检测仪下观察、摄像。
1.7 统计学分析计量数据用 ± s表示。应用统计学软件SPSS For Windows 19.0进行处理,两组间比较用Student t检验,多组间比较用ANOVA检验。
± s表示。应用统计学软件SPSS For Windows 19.0进行处理,两组间比较用Student t检验,多组间比较用ANOVA检验。
本研究检测了食管癌细胞株OE33和CP-C细胞中PLCE1的表达。结果发现,OE33和CP-C细胞中PLCE1的mRNA和蛋白表达水平明显高于正常细胞HEK293,差异有统计学意义(P<0.01)(Fig1)。
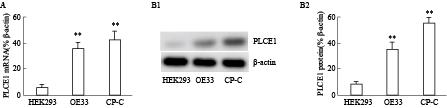
|
| Fig 1 Eca cells express high levels of PLCE1(n=26) A:The bars indicate the relative mRNA levels of PLCE1 of OE33 and CP-C cells;B1-B2:The expression of PLCE1 protein was detected by Western blot,**P<0.01 vs HEK293 cell. |
将PLCE1 siRNA转染至食管癌CP-C细胞中,抑制PLCE1的表达,检测细胞凋亡情况。结果表明,PLCE1 siRNA组细胞凋亡率最高,空白对照组(mock)与转染无关系列组(scramble)差异无显著性,PLCE1 siRNA与其它两组比较差异有统计学意义(P<0.01)(Fig2)。

|
| Fig 2 Suppression of PLCE1 induces apoptosis in CP-C cells(n=26) A:The dot plots indicate the frequency of dead CP-C cells (PI+) and apoptotic cells (Annexin V+);B-C:The bars indicate the summarized data of dead cells (B) and apoptotic cells (C),**P<0.01 vs mock. |
进一步采用qRT-PCR与Western blot检测PLCE1对食管癌CP-C细胞中p53表达的影响。结果发现,抑制CP-C细胞中PLCE1的表达后,p53表达上调。而在HEK293细胞过表达PLCE1后,p53表达下调(Fig3)。
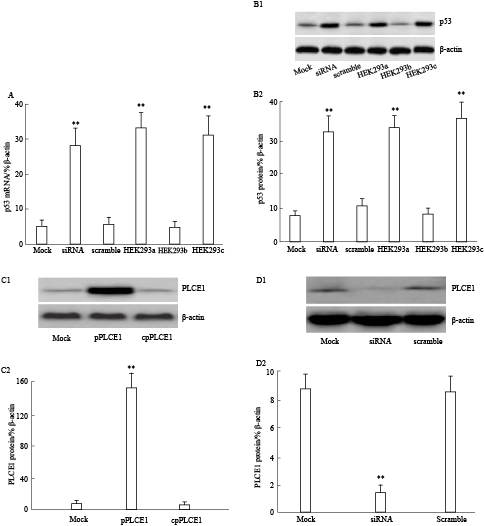
|
| Fig 3 Inhibition of PLCE1 upregulates expression of p53 in Eca cells(n=26) A:PLCE1 inhibited expression of p53 mRNA;B1-B2:The levels of p53 protein was detected by Western blot.C1-C2:The Western blot showed the expression of PLCE1 in HEK293 cells.D1-D2:The PLCE1 gene knockdown results.Mock:Untreated group;siRNA:Treated with PLCE1 siRNA.scramble:Treated with control siRNA.HEK293 cells were treated with mock (HEK293a),or pPLCE1(PLCE1 overexpression plasmid)(HEK293b),or control plasmid (HEK293c).**P<0.01 vs mock. |
甲基化特异性PCR结果提示HEK293细胞中甲基化状态的p53 小于20%,而CP-C细胞中,甲基化状态的p53 大于75%。干扰CP-C细胞中PLCE1表达后,p53启动子甲基化状态明显下调,而HEK293细胞过表达PLCE1后,p53启动子高甲基化(Fig4)。
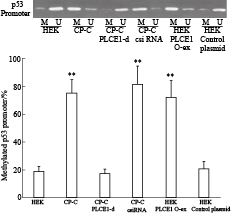
|
| Fig 4 PLCE1 induces p53 promoter methylation(n=26) HEK:HEK293;PLCE1-d:PLCE1 siRNA;csiRNA:Scramble;PLCE1 O-ex:PLCE1 plasmid;M:Methylated primer;U:Un-methylated primer.**P<0.01 vs HEK cells |
食管癌是我国常见的恶性肿瘤之一,其发生发展的分子机制多样。研究表明,基因突变、等位基因高频率杂合性缺失(LOH)、抑癌基因失活等均可促进食管癌的发生发展。如DNA聚合酶β(DNA polymerase β,DNA polβ)启动子发生突变,在食管癌细胞中表达增加[4]。抑癌基因p53所在染色体17p13区域存在LOH,导致表达失活,食管癌发生[5]。
最近两项大样本全基因组关联研究(GWAS)发现了新的食管癌易感基因位点rs2274223,定位于染色体10q23的PLCE1基因[6, 7]。PLCE1是近年发现的磷脂酶C家族的新成员,在细胞信号转导过程中起重要作用,调节细胞生长、增殖、分化,影响细胞骨架改变、细胞运动、细胞凋亡、肿瘤生长及发展等生物学行为[8, 9]。目前有关食管癌中PLCE1表达水平的报道结果不尽一致,Chen 等[10]报道哈萨克族食管癌患者中PLCE1表达升高,其表达水平与肿瘤分期正相关。Hu等[11]则报道食管癌组织中PLCE1 mRNA表达水平下降,免疫染色分析提示基因型rs2274223 GG者 PLCE1染色分数低于AG型。而我们的研究发现PLCE1在食管癌细胞OE33和CP-C中均高表达,与chen的研究结果一致。分析出现这种情况的可能原因有:(1)样本数有差异;(2)种族差异;(3)环境因素。
表观遗传学调控是当今生命科学关注的前沿,在基因调控中起重要作用,其涉及的机制主要包括DNA甲基化、miRNA、组蛋白修饰及染色质重塑等。DNA甲基化是指DNA在甲基转移酶(DNA methyltransferase,DMT) 的催化下,以s-腺苷甲硫氨酸(SAM)为甲基供体,将甲基转移到特定的碱基上的过程。在哺乳动物中DNA甲基化主要发生在5′-CpG-3′的C上生成5-甲基胞嘧啶(5mC)。在真核生物中发现了3类DNA甲基转移酶(Dnmt1、Dnmt2、Dnmt3a、Dnmt3b)。Dnmt1是一种维持性甲基化酶;Dnmt2可与DNA上特异位点结合;Dnmt3a和Dnmt3b是重新甲基化酶,它们使去甲基化的CpG位点重新甲基化,即参与DNA的从头甲基化。众多研究发现,在肿瘤发生发展的过程中,DNA甲基化能关闭某些抑癌基因的活性,去甲基化则诱导了癌基因的重新活化和表达[12]。本研究发现,CP-C细胞中甲基化状态的p53 大于75%,而抑制CP-C细胞中PLCE1的表达后,p53表达上调,p53启动子甲基化状态明显下调,提示抑癌基因p53启动子高甲基化在食管癌的发生发展中发挥重要作用。
细胞凋亡下调是肿瘤发生的重要原因之一,众多因子参与细胞凋亡的调控,如TNF-α促进细胞凋亡[13],GS-459679抑制细胞凋亡[14],SCO2 (细胞色素C氧化酶2合成物)可诱导p53表达从而促进细胞凋亡[15]。大量研究证实[16],p53与细胞凋亡密切相关,p53能通过高尔基复合体转运Fas短暂促进血管平滑肌细胞表面Fas表达并促进Fas-FADD的结合诱导凋亡。肿瘤细胞过表达p53能诱导细胞凋亡,而特异性抑制剂分别抑制caspase-8及caspase-9后均能抑制这种p53依赖的凋亡,表明p53对死亡受体通路和线粒体通路均有影响[17]。通过本研究发现,抑制食管癌细胞中PLCE1的表达可促进p53的表达,进而促进食管癌CP-C细胞凋亡。
综上所述,我们推测,PLCE1通过促进p53启动子区甲基化抑制p53 的表达,从而抑制食管癌细胞凋亡。PLCE1可能成为食管癌治疗的新靶点。
| [1] | Chen W, He Y, Zheng R, et al. Esophageal cancer incidence and mortality in China, 2009 [J]. J Thoracic Dis, 2013, 5 (1):19-26. |
| [2] | Jemal A, Murray T, Ward E, et al. Cancer statistics, 2005 [J]. CA Cancer J Clin, 2005, 55 (1):10-30. |
| [3] | Turner N, Moretti E, Siclari O, et al. Targeting triple negative breast cancer: is p53 the answer[J]? Cancer Treatm Rev,2013, 39 (5):541-50. |
| [4] | Li M, Zang W, Wang Y, et al. DNA polymerase beta promoter mutations and transcriptional activity in esophageal squamous cell carcinoma [J]. Tumour Biol,2013, 34 (5):3259-63. |
| [5] | Egashira A, Morita M, Yoshida R, et al. Loss of p53 in esophageal squamous cell carcinoma and the correlation with survival: analyses of gene mutations, protein expression, and loss of heterozygosity in Japanese patients [J]. J Surg Oncol,2011, 104 (2):169-75. |
| [6] | Wu C, Hu Z, He Z, et al. Genome-wide association study identifies three new susceptibility loci for esophageal squamous-cell carcinoma in Chinese populations [J]. Nat Genet, 2011, 43 (7):679-84. |
| [7] | Wang L D, Zhou F Y, Li X M, et al. Genome-wide association study of esophageal squamous cell carcinoma in Chinese subjects identifies susceptibility loci at PLCE1 and C20orf54 [J]. Nat Genet,2010, 42 (9):759-63. |
| [8] | Ada-Nguema A S, Xenias H, Hofman J M, et al. The small GTPase R-Ras regulates organization of actin and drives membrane protrusions through the activity of PLCepsilon [J]. J Cell Sci, 2006, 119 (Pt 7):1307-19. |
| [9] | Lad Y, McHugh B, Hodkinson P S, et al. Phospholipase C epsilon suppresses integrin activation [J]. J Biol Chem, 2006, 281 (40):29501-12. |
| [10] | Chen Y Z, Cui X B, Hu J M, et al. Overexpression of PLCE1 in Kazakh esophageal squamous cell carcinoma: implications in cancer metastasis and aggressiveness [J]. APMIS, 2013, 121 (10):908-18. |
| [11] | Hu H, Yang J, Sun Y, et al. Putatively functional PLCE1 variants and susceptibility to esophageal squamous cell carcinoma (ESCC): a case-control study in eastern Chinese populations [J]. Ann Surg Oncol, 2012, 19 (7):2403-10. |
| [12] | Suzuki H, Maruyama R, Yamamoto E, et al. Epigenetic alteration and microRNA dysregulation in cancer [J]. Front Genet, 2013, 4 :258. |
| [13] | Chen F H, Lu N, Zhang H W, et al. LYG-202 augments tumor necrosis factor-alpha-induced apoptosis via attenuating casein kinase 2-dependent nuclear factor-kappaB pathway in HepG2 cells [J]. Mol Pharmacol, 2012, 82 (5):958-71. |
| [14] | Toldo S, Breckenridge D G, Mezzaroma E, et al. Inhibition of apoptosis signal-regulating kinase 1 reduces myocardial ischemia-reperfusion injury in the mouse [J]. J Am Heart Associ,2012, 1 (5):e002360. |
| [15] | Stiburek L, Vesela K, Hansikova H, et al. Loss of function of Sco1 and its interaction with cytochrome c oxidase[J]. Am J Physiol, 2009, 296 (5):C1218-26. |
| [16] | Salvesen G S, Dixit V M. Caspases: intracellular signaling by proteolysis [J]. Cell, 1997, 91 (4):443-6. |
| [17] | Bennett M, Macdonald K, Chan S W, et al. Cell surface trafficking of Fas: a rapid mechanism of p53-mediated apoptosis [J]. Science,1998, 282 (5387):290-3. |

