


2.河北以岭医药研究院,国家中医药管理局重点研究室(心脑血管络病),河北 石家庄 050035;
3.河北医科大学附属以岭医院心血管科(国家中医药管理局中医络病学重点学科),河北 石家庄 050091;
4.河北省络病重点实验室,河北 石家庄 050035
2.Dept of Cardiology,Yiling Medical Research Institute of Hebei Province,Key Laboratory of State Administration of Traditional Chinese Medicine (cardio-cerebral vascular network disease),Shijiazhuang 050035,China;
3.Dept of Cadiovascular Diseases,Yiling Hospital of Hebei Medical University,Key Discipline of State Administration of Traditional Chinese Medicine,Shijiazhuang 050091;
4.Key Laboratory of Network Disease of Hebei Province,Shijiazhuang 050035,China
血管外膜在动脉粥样硬化中的作用越来越受到重视[2],血管外膜上有外弹力板、神经的终末分支、滋养血管以及结缔组织等,但近来研究发现在高胆固醇血症猪模型上,新生滋养血管出现及密度增加在动脉粥样硬化早期就已出现[3],滋养血管新生程度与动脉粥样硬化严重程度相关,此外新生的滋养血管能够为促炎物质及促动脉粥样硬化血液成分进入血管壁提供通路[4],易损斑块内的新生血管96.5%来源于血管外膜[5]。以往研究显示通心络[6]和他汀类药物[7]主要通过保护血管内皮、抗炎、抗氧化和调脂等作用发挥抗动脉粥样硬化的作用,阿司匹林[8]则主要通过抑制血小板活化、抗炎、抗氧化等机制延缓动脉粥样硬化的进程。此外通心络[9]、阿托伐他汀[10]、阿司匹林[11]均能够减少斑块内血管新生,起到稳定斑块的作用。根据polypill策略[12],即在固定药物剂量的基础上联合用药,有研究者提出他汀类药物联合应用阿司匹林及中药通心络胶囊,形成有效防治缺血性心脑血管疾病的“金三角”(ATS)优选方案,在减少危险因素的同时未导致不良反应的风险提高,从而减少心脑血管的发病风险。因此,我们试图通过实验验证通心络联合阿托伐他汀、阿司匹林对动脉粥样硬化早期滋养血管新生的干预作用。
1 材料与方法 1.1 材料与设备3k15型高速冷冻离心机(Sigma);T10型匀浆机(德国IKA公司);JB-2A型恒温磁力搅拌器(上海雷磁新泾仪器有限公司);756型紫外分光光度计(美国Thermo Fisher公司);ABI 7300 Real-Time PCR System(美国ABI公司);通心络超微粉(石家庄以岭药业股份有限公司,批号:20120924);阿托伐他汀片(辉瑞制药有限公司,批号:1237179); 阿司匹林(石药集团欧意药业有限公司,批号:018130311);羧甲基纤维素钠( 天津永大化学试剂开发中心,批号:20130418);DYE-TRAK彩色微球(美国Triton Technology公司,批号:15TB0911);VEGF鼠抗兔单克隆抗体(英国Abcam 公司,批号:ab1316);VEGFR-2 山羊多克隆抗体(美国Santa Cruz公司,批号:sc-48161)。
1.2 方法 1.2.1 分组与造模健康新西兰白兔(北京富豪实验动物养殖中心,批号:SCXR[京]2010-0010),单笼饲养于河北省络病重点实验室,体质量(1.8±0.2) kg,适应性饲养1周后,将72只健康清洁级新西兰白兔随机分为对照组、模型组、通心络(TXL)组、阿托伐他汀(ATO)组、阿司匹林(ASP)组、金三角(ATS)组,每组12只。对照组给予普通饲料,其余各组硅胶管包裹后给予高脂饲料(胆 固 醇1%,蛋黄粉7.5%,猪油5%,基础饲料86.5%,由河北医科大学实验动物中心加工定制)喂养[13]。自耳缘静脉注射3%戊巴比妥(1 mL·kg-1),将新西兰白兔仰卧位固定于手术台上,脱毛后常规消毒,铺洞巾,沿其颈部正中线剪开皮肤,逐层钝性分离,右侧颈动脉鞘暴露后,仔细游离出右颈动脉(RCA)约2.5 cm。用准备好的的硅胶管纵向切开后包裹于RCA外,滴加青霉素预防感染。术后,缝合伤口,自主苏醒。术后2次/日,连续3 d局部消毒,以预防感染。对照组家兔不作任何处理。 每天12h间隔照明,温度20℃~25℃,湿度50%~70%,自由饮水和摄食。实验室每日按时通风和消毒。
1.2.2 标本采集和处理喂养4周后,标本采集前12 h禁食禁水,3%戊巴比妥钠耳缘静脉注射麻醉(1 mL·kg-1),腹主动脉取血。严格无菌操作,剃毛后消毒,沿颈部正中线剪开,快速分离并取下包管侧颈动脉,生理盐水洗净,一部分4%多聚甲醛保存,另一部分液氮冻存备用。剩余组织制作石蜡切片,苏木精-伊红(HE)染色。
1.2.3 病理标本光镜观察将已固定标本脱水、石蜡包埋切片(厚度约4 μm),HE染色,光镜观察。
1.2.4 免疫组化法检测血管外膜CD34表达取固定标本,脱水、石蜡包埋,切片,严格按照说明书行CD34免疫组织化学染色。
1.2.5 彩色微球测量管壁微血管血流量 1.2.5.1 测量原理自家兔左心室注入直径约为15 μm的彩色微球,随后微球随体循环至全身并最终嵌顿于微血管中,将待测标本中的彩色微球回收后,再用有机溶剂将彩色微球洗脱干净,利用紫外分光光度计测得吸光度值,用以计算待测标本的微循环血流量。
1.2.5.2 测量方法用3%戊巴比妥钠(30 mg·kg-1)耳缘静脉麻醉后,于右侧腹股沟处脱毛后常规消毒,剥离股动脉并插管(管内充满50 kU·L-1的肝素生理盐水,并与1 mL注射器相连)。胸部脱毛消毒,沿正中线剪开直至暴露心脏,10 s内将微球(500 μL含有1.2×106个黄色微球,最大吸光度波长448 nm)注射于左心室,在注射前5 s于股动脉插管持续采血1 min并抗凝。处死动物后迅速取出包管处颈动脉并放入聚丙烯离心管中,称量血液样本及组织样本重量。最后利用Triton Technology公司的Excel宏文件(Triton1 Plus Control)计算各组标本中管壁微血管血流量值(单位: μL/min·g),实验具体操作方法严格按照说明书进行。
1.2.6 VAGF/VEGFR-2的RT-PCR检测①组织总RNA提取及定量:取50 mg组织用TRIzol试剂(Gibco)提取组织总RNA。751紫外分光光度计测A260和A280值;以检测RNA纯度并定量。 ②RNA完整性鉴定,取总RNA液3 μL,加上样缓冲液1 μL,1%琼脂糖凝胶电泳,紫外灯观察28S和18S条带的完整性。③逆转录-聚合酶链反应,逆转录cDNA的合成反应:取总RNA 6 μg,5×R.T.buffer 4 μL,dNTPs(10 mmol·L-1)2 μL,Random primer 1 μL,RNasin(5×107 U·L-1)0.4 μL,AMV-RT(1×107 U·L-1)1 μL,DEPC-H20 3.6 μL,充分混匀后,42 ℃反转录 40 min,95℃ 5 min灭活反转录酶;引物合成:VEGF(73 bp):上游5′-GCGTTCTCAGTGGTGTTTGA-3′,下游5′-TGGCTTGTTCCTCCTTCTTG-3′;VEGFR-2(141 bp):上游5′-GGTTCAAAGACAACGAGATGC-3′,下游5′-TCACACAGCCAAGGACACTG-3′。GAPDH(92 bp):上游5′-AGAGATTGTGCGGGATGTC-3′,下游5′-CCAGTGAGGAAGATGCTGCT-3′;PCR反应体系(25 μL):R.T.product 5.0 μL,10×PCR buffer 2.5 μL,MgCl2 2.5 μL,primer each 1 μL,Taq DNA polymerase1 μL,DDW 13 μL;反应条件:94℃ 3 min,94℃ 45 s,53℃ 45 s,72℃ 45 s,30个循环;最后72℃延伸5 min。④RT-PCR产物半定量分析:取10 μL产物2%琼脂糖电泳(85 mA,125 V)50 min,用凝胶图像分析管理系统(珠海黑马有限公司)进行拍照和半定量分析,用任意单位(AU)表示凝胶谱带面积×荧光强度值,VEGFR/GAPDH的AU比值代表VEGFmRNA相对表达水平,VEGFR-2/GAPDH的AU比值代表VEGFR-2mRNA相对表达水平。
1.2.7 VAGF/VEGFR-2的Western blot检测取颈动脉组织约100 mg,加入1 mL细胞裂解液,待充分裂解后进行定量,取蛋白样品进行SDS聚丙烯酰胺凝胶电泳完毕后对凝胶进行半干转膜。转膜完毕,取出PVDF膜,置于封闭液中并室温封闭2 h。将封闭后的PVDF膜置入稀释后的一抗溶液中,4 ℃缓慢摇动过夜。室温洗膜后,将PVDF膜置入稀释的辣根过氧化物酶标记的二抗溶液中,室温反应2 h。抗体结合区带用化学发光法检测。以GAPDH作为内参照,以目的基因吸光度值/GAPDH吸光度值的比值表示检测样品中目的蛋白的相对含量进行数据统计分析。
1.3 统计学方法数据均以 ± s表示,应用SPSS 19.0软件统计,采用单因素方差分析进行统计学处理,组间两两比较用LSD法检验,若方差不齐者用Dunnetts T3。
± s表示,应用SPSS 19.0软件统计,采用单因素方差分析进行统计学处理,组间两两比较用LSD法检验,若方差不齐者用Dunnetts T3。
对照组:内皮细胞与内弹力板贴合紧密,内皮细胞连续结构完整。平滑肌细胞排列整齐;模型组:内膜层明显增生,内皮细胞不连续,内可见少量泡沫状巨噬细胞形成;各用药组内膜层部分增厚,但内膜损伤程度减轻,以阿托伐他汀组、通心络组及ATS组改善更为明显。见Fig1。
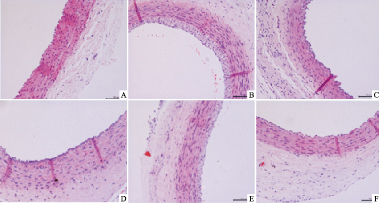
|
| Fig 1 Appearance of carotid artery morphology in all groups(HE staining×400) A:Control group;B:Model group;C:TXL group;D:ATO group;E:ASP group;F:ATS group |
CD34在颈动脉外膜微血管内皮细胞阳性表达呈现棕褐色,凡是呈现棕色的并与邻近组织有明显界限,可视为一个微血管;与空白组比较,模型组CD34在血管外膜新生滋养血管处表达增多;与模型组比较,各用药组外膜新生滋养血管数量减少(Fig2中箭头所示)。
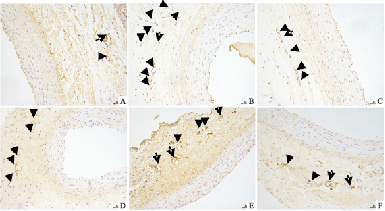
|
| Fig 2 Appearance of CD34 in carotid artery adventitia in all groups (IHC×200) A:Control group;B:Model group;C:TXL group;D:ATO group;E:ASP group;F:ATS group |
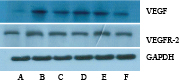
|
| Fig 3 Expression of VEGF and VEGFR-2 protein in the adventitia of common carotid artery in all groups A:Control group;B:Model group;C:TXL group;D:ATO group;E:ASP group;F:ATS group |
与空白组比较,模型组颈动脉微血管血流量增多,差异有统计学意义(P<0.01)。与模型组比较,各用药组颈动脉微血流量减少(P<0.01)。ATS与其余各用药组比较微血管血流量减少明显(P<0.01)。ASP组微血管血流量改变与ATO组比较差异有统计学意义(P<0.05),剩余两组之间比较差异无统计学意义(P>0.05)。见Tab1。
 ± s,n=6)
± s,n=6)
 |
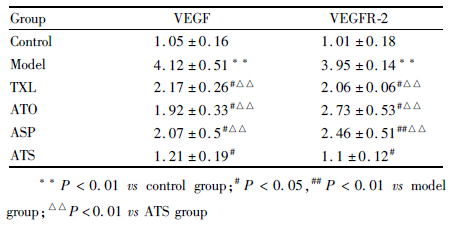
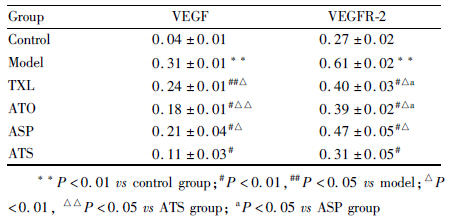
与正常组比较,模型组VEGF mRNA、VEGFR-2 mRNA 表达明显升高(P<0.01)。与模型组比较,TXL、ATO、ASP、ATS组VEGF mRNA、VEGFR-2 mRNA 表达均明显降低 (P<0.01,P<0.05)。ATS组VEGF mRNA、VEGFR-2 mRNA 表达均低于ASP、TXL及ATO组(P<0.01),两组间比较差异无显著性(P>0.05)。见Tab2。
 ± s,n=6)
± s,n=6)
 |
与正常组比较,模型组VEGF蛋白表达明显升高(P<0.01)。与模型组比较,TXL、ATO、ASP、ATS组 VEGF 蛋白表达均明显降低 (P<0.01,P<0.05);ATS组 VEGF 蛋白表达均低于ASP、TXL及ATO组(P<0.01,P<0.05),两组间比较差异无显著性(P>0.05)。
与正常组比较,模型组VEGFR-2蛋白表达明显升高(P<0.01)。与模型组比较,TXL、ATO、ASP、ATS组 VEGFR-2蛋白表达均明显降低 (P<0.01);ATS组VEGFR-2蛋白表达均低于ASP、TXL及ATO组(P<0.01),与ASP组比较,TXL组、ATO组VEGFR-2 蛋白表达均明显降低 (P<0.05),两组间比较差异无显著性(P>0.05)。见Tab3。
 ± s,n=3)
± s,n=3)
 |
随着对动脉粥样硬化研究机制的深入,血管外膜在动脉粥样硬化发生发展中的作用也越来越受到重视,滋养血管作为外膜中的一部分,在动脉粥样硬化斑块形成之前,在动脉粥样硬化早期新生滋养 血管就已出现[14]。新生的滋养血管同时也是炎性物质等进入血管壁的通路[4] 。本实验中单侧颈动脉硅胶管包裹术复合高脂饲料喂养模型[15]是为了建立动脉粥样硬化早期滋养血管新生模型,以验证“金三角”方案对动脉粥样硬化早期滋养血管新生的干预作用。
血管内皮生长因子(VEGF)特异的作用于血管内皮细胞,诱导内皮细胞的增生、迁移,从而发挥生理和病理性促血管新生的作用。VEGF促血管新生的作用主要通过两个特异表达血管内皮细胞的酪氨酸激酶受体:VEGFR-1和VEGFR-2,VEGF主要通过VEGFR-2促进内皮细胞增殖和新生血管形成[16]。VEGFR-2经过自身胞质内酪氨酸残基磷酸化,进而激活下游信号通路,促进内皮细胞的存活、增生和迁移,诱导新生血管形成,VEGF及其受体VEGFR-2通路是血管新生发生的主要通路。在滋养血管新生处可见大量VEGF、VEGFR-2表达[17]。采用彩色微球技术可较为准确的测定局部血流状况[18],本实验采用该技术检测颈动脉上微血管的血流量,以间接证实颈动脉外膜滋养血管新生的程度。CD34可间接反映颈动脉外膜微血管数量[15]。
通心络、他汀类药物、阿司匹林均对斑块内新生血管有一定干预作用,此外,辛伐他汀可通过微血管内皮保护作用发挥抑制滋养血管异常增生的作用,但是他汀类的副作用不可避免,既往研究已证实,“金三角”方案减少西药副作用,上述实验已证实,3药联用组能明显减少VEGF/VEGFR-2基因和蛋白表达,另外3药联用组同时可明显减少颈动脉微血管血流量,其效果优于3药单用。“金三角”方案能够减少血管外膜新生滋养血管数量,使炎性物质进入血管壁的途径减少,从而为延缓动脉粥样硬化进程提供一种新途径。但是“金三角”抑制滋养血管新生的相关机制还有待于进一步研究。
| [1] | 王磊.通心络联合阿托伐他汀、阿司匹林(ATS)对ApoE-/-小鼠动脉粥样硬化早期干预及机制研究[D].河北:河北医科大学,2013.Wang L.Effects and mechanism of Tongxinluo combined with atorvastatin and aspirin (ATS) on early atherosclerosis lesions in ApoE-/- mouse[D].HeBei:Hebei Medical University,2013. |
| [2] | 刘子懿,孔炜.血管外膜在动脉粥样硬化中的作用[J].生理科学进展,2010,41(3):177-82.Liu Z Y,Kong W.The role of adventitia in atherosclerosis[J].Progr Physiol Sci,2010,41(3):177-82. |
| [3] | Heistad D D,Marcus M L,Martins J B.Effects of neural stimuli on blood flow through vasa vasorum in dogs[J].Circulat Res,1979,45(5):615-20. |
| [4] | Gössl M,Versari D,Lerman L O,et al.Low vasa vasorum densities correlate with inflammation and subintimal thickening:Potential role in location-determination of atherogenesis[J].Atherosclerosis,2009,206(2):362-8. |
| [5] | Kumamoto M,Nakashima Y,Sueishi K.Intimal neovascularization in human coronary atherosclerosis:its origin and pathophysiological significance[J].Hum Pathol,1995,26(4):450-6. |
| [6] | 毕轶,马亚兵,高海青.通心络抗动脉粥样硬化研究进展[J].中国心血管杂志,2005,10(2):142-3.Bi Y,MA Y B,Gao H Q.Research Progress of anti-atherosclerosis mechanism of Tong xin luo[J].Chin J Cardiovasc Med,2005,10(2):142-3. |
| [7] | 温宝书,傅洁民,王慧.他汀类药物抗动脉粥样硬化机制的研究进展[J].解放军药学学报,2005,21(3):213-6.Wen B S,Fu J M,Wang H.Research progress of anti-atherosclerosis mechanism of statins[J].Pharm J Chin People′s Liber Army,2005,21(3):213-6. |
| [8] | 邱满堂,吴晓燕,戚晓红.阿司匹林抑制动脉粥样硬化作用机制的研究进展[J].现代生物医学进展,2010,10(9):3757-9.Qiu M T,Wu X Y,Qi X H.Progress on the mechanism of aspirin's anti-atherosclerotic effects[J].Progr Mod Biomed,2010,10(9):3757-9. |
| [9] | 张路,吴宗贵,廖德宁,等.通心络对实验性家兔主动脉粥样斑块内血管内皮生长因子表达的影响[J].中国动脉硬化杂志,2004,12(2):177-82.Zhang L,Wu Z G,Liao D N,et al.Effects of tongxinluo on the expression of vascular endothelial growth factor in rabbit aortic atherosclerotic plaques[J].Chin J Arterioscl,2004,12(2):177-82. |
| [10] | 马晔,马建芳,关瑞锦.阿托伐他汀对兔动脉粥样硬化斑块的干预作用[J].中国循证心血管医学杂志,2013,5(6):390-4.Ma Y,Ma J F,Guan R J.Intervention effect of atorvastatin on vascular endothelial growth factor in atherosclerotic plaque in rabbits[J].Chin J Evide-Bases Cardiovasc Med,2013,5(6):390-4. |
| [11] | 薛洁,华轶男,顾振纶,等.阿司匹林抑制兔腹主动脉粥样斑块破裂及MMP-2表达的研究[J].中国药理学通报,2008,24(10):1335-9.Xue J,Hua Y N,Gu Z L,et al.Study of aspirin on inhibiting the atherosclerotic plaque rupture and MMP-2 expression of abdominal aorta in atherosclerotic rabbits[J].Chin Pharmacol Bull,2008,24(10):1335-9. |
| [12] | Yusuf S,Pais P,Afzal R,et al.Effects of a poly pill (Poly cap) on risk factors in middle-aged individuals without cardiovascu-lar disease (TIPS):a phase,double-blind,randomized trial[J].Lancet,2009,373(9672):1341-51. |
| [13] | 肖维刚,张秋艳,郎艳松,等.通心络对高脂血症兔甲襞微循环血流速度的影响[J].微循环学杂志,2013, 23(4):8-11.Xiao W G,Zhang Q Y,Lang Y S,et al.Effects of Tongxinluoon on nail fold microcirculation in hyperlipemia rabbit[J].Chin J Microcircul,2013,23(4):8-11. |
| [14] | Herrmann J,Lerman L O,Rodriguez-Porcel M,et al.Coronary vasa vasorum neovascularization precedes epicardial endothelial dysfunction in experimental hypercholesterolemia[J].Cardiovasc Res,2001,51(4):762-6. |
| [15] | 肖维刚.动脉管壁"孙络-微血管"滋生在动脉粥样硬化早期病变中的作用及通络干预研究[D].河北:河北医科大学,2014.Xiao W G.The role of vasa vasorum angiogenesis in early atherosclerosis and intervention studies with tongxinluo[D].Hebei:Hebei Medical University,2014. |
| [16] | 张伟丽,惠汝太.VEGF及其受体在动脉粥样硬化中的作用[J].中国分子心脏病学杂志,2005,5(3):568-73.Zhang W L,Hui R T.The biological role of VEGF and its receptors in atherosclerosis[J].Mol Cardiol China,2005,5(3):568-73. |
| [17] | Gössl M,Herrmann J,Tang H,et al.Prevention of vasa vasorum neovascularization attenuates early neointima formation in experimental hypercholesterolemia[J].Basic Res Cardiol,2009,104(6):695-706. |
| [18] | 沈伟,范维琥,施海明.微球技术在血管新生研究领域中的应用进展[J].心血管病学进展,2007,28(5):763-6.Shen W,Fan W H,Shi H M.Application improvement of microspheres in angiogenesis research[J].Advances Cardiovasc Dis,2007,28(5):763-6. |

