


磷酸化蛋白50[ezrin/radixin/moesin (ERM)-binding phosphoprotein 50,EBP50]是一个多功能连接蛋白,可以通过PDZ-1结构域、PDZ-2结构域及EB结构域与其他蛋白相互结合,参与细胞的多种生物活动。近年来的研究表明,EBP50的表达与乳腺癌的增殖和转移密切相关。EBP50在乳腺癌细胞MDA-MB-231中含量较低,而在乳腺癌细胞MCF-7中表达较高[1];上调EBP50的表达可以降低乳腺癌细胞的增殖及侵袭能力[2]。而一项针对222例乳腺癌患者的研究表明,EBP50的低表达可导致患者存活率降低[3]。以上的文献说明,在乳腺癌中,EBP50具有潜在的抗肿瘤能力,但抗肿瘤能力并未在上皮样乳腺癌细胞MCF-7细胞中得到验证。
有丝分裂原激活激酶(mitogen-activated kinase,MAPK)信号通路在多个物种中高度保守,是重要的细胞增殖与分化的调节信号通路。细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)是MAPK信号通路中的主要作用分子,参与并调控多种肿瘤的发生发展进程[4]。ERK持续活化可以促进信号传导与转录活化因子(signal transducers and activators of transcription,STAT1)降解,从而抑制其促凋亡、抗肿瘤能力[5]。
在本研究中,我们构建了稳定干扰EBP50表达的乳腺癌MCF-7细胞株,并对其增殖能力及潜在作用机制进行探讨。我们发现,EBP50可以抑制上皮样乳腺癌细胞MCF-7的增殖,这种抑制增殖的能力可能是通过抑制ERK1/2的活性实现的。本研究补充了EBP50抑制乳腺癌细胞增殖的分子机制研究,为研究乳腺癌发生机制提供了一定的理论依据。
1 材料 1.1 实验细胞乳腺癌MCF-7细胞购于中国医学科学基础医学研究所细胞培养中心。MCF-7细胞使用 DMEM培养基,10% FBS培养。每隔2 d传代1次,细胞培养条件为 37 ℃,5% CO2。
1.2 主要试剂DMEM细胞培养基、进口血清FBS和胰酶购于美国Gibco公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;真核表达载体pGPU6/Neo为本实验室保存载体;磺酰罗丹明B试剂盒购于美国Sigma公司;抗人β-actin、EBP50、p-ERK1/2及ERK1/2抗体购自美国Cell Signaling Technology公司;RIPA裂解液、BCA蛋白浓度定量试剂盒购于碧云天生物科技研究所。
2 方法 2.1 稳定干扰EBP50表达载体构建实验方法参考文献所示[6],在线设计针对 EBP50的siRNA序列,逆转录合成有效靶序列的DNA,合成序列为:5′-CACCGACCAGAAACGCAGCAGCAAACTTCAAGAGA GTTTGCTGTGGTTTTTTTG-3′。将合成的小片段DNA经酶切后与载体pGPU6/Neo相连接,用于构建稳定干扰EBP50的稳转细胞系。
2.2 稳定干扰EBP50细胞系的建立实验方法参考文献[6],具体步骤如下:预先在培养皿中培养细胞,使细胞在贴壁24 h后处于指数生长期。将构建好的载体经大提质粒试剂盒提纯后,使用Lipofectamine 2000转染试剂转染进入细胞中,待转染后24 h更换为含有真核筛选抗性的培养基。培养约2周后,将细胞消化、重悬,经梯度稀释后接种于96孔板中,继续培养。当细胞在培养孔中形成单克隆集落时,转移至48孔板中扩大培养。
2.3 Western blot取适量培养细胞,加入RIPA裂解液后振荡混匀,冰上放置30 min,间或振荡;4 ℃、4 560×g,离心15 min。取上清,使用蛋白定量试剂盒测定蛋白浓度,其具体步骤参照说明书进行。调节蛋白至相同浓度,分装,加入5倍上样缓冲液,96 ℃变性10 min,用于SDS电泳;使用Amersham显色系统显色,经Western blot分析软件测出各条带的光密度值并分析[6]。
2.4 磺酰罗丹明B(sulforhodamine B,SRB)法检测细胞增殖实验参考文献方法[7],具体步骤如下:在每孔加入50 μL 4℃预冷的TCA溶液固定细胞,TCA溶液的终浓度为10%。静置5 min移入4℃冰箱中固定1 h,取出,用去离子水冲洗5遍,室温晾干。待96孔板室温下晾干后,每孔加入0.4%的SRB染液70 μL,染色30 min后倒掉染液,用1%乙酸冲洗4次,去除未结合的染料,室温晾干。用100 μL非缓冲Tris-base碱液溶解与细胞蛋白结合的染料,水平摇床上振荡20 min,采用酶标仪540 nm处测定光吸收值。
2.5 统计学处理实验结果以 ± s表示,两样本均数间比较采用t检验。
± s表示,两样本均数间比较采用t检验。
将合成的小片段DNA经酶切后与载体pGPU6/Neo相连接,转化进大肠杆菌DH5α中进行扩增。然后分别提纯空载体Mock以及sh-EBP50质粒,进行测序,结果如下图所示(Fig1A),经DNA-MAN软件比对后证明测序结果正确(Fig1B),说明载体构建成功。
|
| Fig 1 Construction of sh-EBP50 plasmid A: The sequencing results of sh-EBP50 plasmid; B: The comparison results of sh-EBP50 plasmid with application of DNA-MAN. |
在稳定干扰EBP50细胞株形成的单克隆细胞中,挑选6个克隆细胞检测其EBP50的蛋白表达水平,以确定其干扰效果。使用空载体Mock组作为空白对照,实验结果显示,与Mock组相比,单克隆A1、A2、A3、B1、B2以及B3细胞株中的EBP50表达有所降低,其中A3以及B3中EBP50表达的降低差异具有显著性(P<0.01),而A1及 B1中EBP50的降低差异具有显著性(P<0.01),上述结果说明单克隆A1、A3、B1以及B3细胞株是可以稳定干扰EBP50表达的乳腺癌细胞株(Fig2)。在后续的研究中,我们选择A1细胞株作为研究对象(简称为sh-EBP50)。

|
Fig 2
Screening and identification of sh-EBP50 breast cancer cells ( ± s, n=3)
A and B: The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of EBP50 was detected by Western blot. **P<0.01 vs Mock. ± s, n=3)
A and B: The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of EBP50 was detected by Western blot. **P<0.01 vs Mock.
|
研究表明,EBP50与乳腺癌的增殖密切相关,上调EBP50的表达可以降低乳腺癌细胞MDA-MB-231的增殖能力[1]。因此,我们检测了敲除EBP50后对MCF-7乳腺癌细胞增殖的影响。使用SRB实验结果显示,敲除EBP50(Fig3A)可以明显地促进乳腺癌细胞的增殖能力(Fig3B);而Western blot实验显示,敲除EBP50可以促进增殖信号标志分子c-myc的表达(Fig3C)。以上的实验结果显示,在乳腺癌MCF-7细胞中敲除EBP50可以促进其增殖能力。
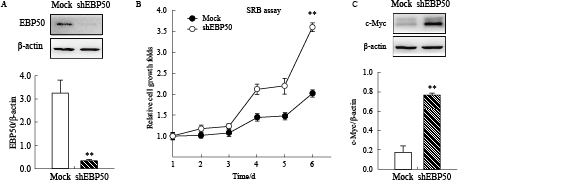
|
Fig 3
Silencing EBP50 promotes proliferation of breast cancer in MCF-7 cell line ( ± s, n=3)
A: The expression of EBP50 was reduced through stably transfecting the sh-EBP50 plasmid. The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of EBP50 was detected by Western blot; B: Silencing EBP50 promotes the proliferation of breast cancer in MCF-7 cell line. The proliferation of sh-EBP50 cells was detected by SRB assay; C: Silencing EBP50 increases the expression of c-myc. The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of c-myc was detected by Western blot. **P<0.01 vs Mock. ± s, n=3)
A: The expression of EBP50 was reduced through stably transfecting the sh-EBP50 plasmid. The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of EBP50 was detected by Western blot; B: Silencing EBP50 promotes the proliferation of breast cancer in MCF-7 cell line. The proliferation of sh-EBP50 cells was detected by SRB assay; C: Silencing EBP50 increases the expression of c-myc. The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of c-myc was detected by Western blot. **P<0.01 vs Mock.
|
ERK包括ERK1与ERK2两种亚型,均可参与并调控多种肿瘤的发生发展进程[4]。在本研究中,干扰EBP50表达后可以上调ERK1和ERK2激酶的磷酸化水平,同时不影响ERK1和ERK2激酶原型的蛋白表达量(Fig4),上述实验结果说明,敲除EBP50可以激活乳腺癌中ERK1/2的活性。

|
Fig 4
Silencing EBP50 stimulates phosphorylation of ERK1/2 in MFC-7 breast cancer cell( ± s, n=3)
The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of phosphorylation of ERK1/2 and ERK1/2 was detected by Western blot. **P<0.01 vs Mock. ± s, n=3)
The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of phosphorylation of ERK1/2 and ERK1/2 was detected by Western blot. **P<0.01 vs Mock.
|
大量研究表明,EBP50参与了乳腺癌的增殖和转移。上调EBP50的表达可以降低乳腺癌细胞的侵袭能力,敲除EBP50可以促进T47D细胞的增殖[2]。此外,EBP50缺失还可以诱导上皮细胞发生上皮间质转化(epithelial-mesenchymal transition,EMT)[8]。而在原发性乳腺癌以及乳腺癌细胞系MDA-MD-231中,EBP50基因发生错义突变[2]。本研究中,我们发现了敲除EBP50可以促进MCF-7细胞增殖,本文的研究结果与上述文献报道相符,本研究补充了EBP50抑制乳腺癌增殖的研究。此外,也有文献表明,EBP50具有一定的促进肿瘤细胞生长与转移的能力。在胃癌细胞中,EBP50在胞质和胞核中均高表达,其表达量与肿瘤的大小呈正相关[9]。在肝细胞癌中,EBP50主要分布于细胞核中,并且可以促进肝细胞癌的生长[10]。在肾细胞癌中,EBP50可以与Ezrin结合形成蛋白质复合物,通过激活Rac1-ARHGEF7信号通路,促进肾细胞癌转移过程[11]。上述文献表明,EBP50对于肿瘤的调控作用具有组织差异性,在乳腺癌中,EBP50主要发挥抑制肿瘤生长和转移的作用,提示EBP50可以作为研究治疗乳腺癌发生发展机制的特异性靶点。
myc基因家族是较早发现的一组癌基因,包括c-myc、n-myc、l-myc。myc基因家族及其产物可促进细胞增殖、永生化、去分化和转化,因而在多种肿瘤形成过程中处于重要地位;而c-myc参与了多种乳腺癌的发生发展进程。肿瘤抑制因子(breast cancer susceptibility gene 1,BRCA1)可以抑制c-myc的转录活性以及其转化活性,当BRCA1缺失可以导致c-myc的过量表达,从而诱导乳腺癌的发生[12]。此外,c-myc还是雌激素受体(estrogen receptor,ER)以及表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路的下游效应分子,因而c-myc的高表达还是导致乳腺癌对辅助治疗发生耐受的重要原因[13]。上述文献表明,c-myc是乳腺癌细胞增殖过程中重要的生物学标志物,直接反映了乳腺癌细胞的增殖能力,因此在本研究中,我们除了使用SRB染色方式评价乳腺癌细胞的细胞活力以外,还检测了c-myc的蛋白表达量,共同评价EBP50缺失后对乳腺癌细胞增殖能力的影响。
EBP50还参与了其他多种分子介导的肿瘤增殖过程,例如EGFR[14]、Ⅱ型神经纤维瘤分子(neurofibromatosisⅡ,NF2)[15]、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)[16]等。当EGF刺激激活EGFR诱导MDA-MD-231细胞增殖,过量表达EBP50可以抑制ERK的激酶活性从而抑制MDA-MD-231细胞的增殖[4],说明EBP50的抑制肿瘤作用可能是通过抑制ERK信号通路实现。此外,抑制ERK还可以降低肿瘤细胞的集落形成[17],然而上调EBP50的表达可以通过抑制ERK的激酶活性,降低肿瘤细胞的集落形成[4]。上述研究表明,上调EBP50的表达可以通过降低ERK的活性,从而抑制肿瘤细胞的增殖与集落形成。在本研究中,我们发现EBP50缺失后可以促进乳腺癌的增殖,同时上调ERK1/2的磷酸化水平,我们的实验结果从EBP50缺失的角度证明了EBP50可以通过抑制ERK的活性,继而影响乳腺癌细胞的增殖,补充了EBP50对ERK活性调节的关系,及其对乳腺癌细胞增殖的影响。
综上所述,本研究通过构建稳定干扰EBP50表达的MCF-7乳腺癌细胞株,探讨EBP50对乳腺癌增殖的影响及潜在的机制。本研究的结果说明,EBP50可以抑制乳腺癌细胞MCF-7的增殖能力,这可能是通过抑制ERK1/2的活性实现的。本研究补充了EBP50抑制乳腺癌增殖的研究,为阐明乳腺癌的发生发展机制提供了一定的指导意义。
| [1] | Yao W,Feng D,Bian W,et al.EBP50 inhibits EGF-induced breast cancer cell proliferation by blocking EGFR phosphorylation[J].Amino Acids,2012,43(5):2027-35. |
| [2] | Pan Y,Wang L,Dai J L.Suppression of breast cancer cell growth by Na+/H+exchanger regulatory factor 1(NHERF1)[J].Breast Cancer Res,2006,8(6):R63. |
| [3] | Paradiso A,Scarpi E,Malfettone A,et al.Nuclear NHERF1 expression as a prognostic marker in breast cancer[J].Cell Death Dis,2013,4:e904. |
| [4] | Zheng J F,Sun L C,Liu H,et al.EBP50 exerts tumor suppressor activity by promoting cell apoptosis and retarding extracellular signal-regulated kinase activity[J].Amino Acids,2010,38(4):1261-8. |
| [5] | Soond S M,Townsend P A,Barry S P,et al.ERK and the F-box protein betaTRCP target STAT1 for degradation[J].J Biol Chem,2008,283(23):16077-83. |
| [6] | 花芳,余娇娇,孙巍,等.TGF-β/Smad3信号参与介导TRB3的促肿瘤作用[J].中国药理学通报,2013,29(3):323-7.Hua F,Yu J J,Sun W,et al.TGF-β/Smad3 signaling participates in and mediates tumor progression of TRB3[J].Chin Pharmacol Bull,2013,29(3):323-7. |
| [7] | 张彩霞,刘虹,宫玉艳,等.SphK1抑制剂SKI II抑制肝癌HepG2细胞周期及细胞侵袭[J].药学学报,2014,49(2):204-8.Zhang C X,Liu H,Gong Y Y,et al.Inhibitions of SphK1 inhibitor SKI II on cell cycle progression and cell invasion of hepatoma HepG2 cells[J].Acta Pharm Sin,2014,49(2):204-8. |
| [8] | Clapéron A,Guedj N,Mergey M,et al.Loss of EBP50 stimulates EGFR activity to induce EMT phenotypic features in biliary cancer cells[J].Oncogene,2012,31(11):1376-88. |
| [9] | Lv XG1,Lei X F,Ji M Y,et al.Clinical significance of EBP50 overexpression assessed by quantum dot analysis in gastric cancer[J].Oncol Lett,2013,5(6):1844-8. |
| [10] | Shibata T,Chuma M,Kokubu A,et al.EBP50,a beta-catenin-associating protein,enhances Wnt signaling and is over-expressed in hepatocellular carcinoma[J].Hepatology,2003,38(1):178-86. |
| [11] | Hsu Y H,Lin W L,Hou Y T,et al.Podocalyxin EBP50 ezrin molecular complex enhances the metastatic potential of renal cell carcinoma through recruiting Rac1 guanine nucleotide exchange factor ARHGEF7[J].Am J Pathol,2010, 176(6):3050-61. |
| [12] | Wang Q,Zhang H,Kajino K,et al.BRCA1 binds c-Myc and inhibits its transcriptional and transforming activity in cells[J].Oncogene,1998,17(15):1939-48. |
| [13] | Butt A J,McNeil C M,Musgrove E A,et al.Downstream targets of growth factor and oestrogen signalling and endocrine resistance:the potential roles of c-Myc,cyclin D1 and cyclin E[J].Endocr Relat Cancer,2005,12 Suppl 1:S47-59. |
| [14] | Goel A,Prasad A K,Parmar V S,et al.7,8-Dihydroxy-4-methylcoumarin induces apoptosis of human lung adenocarcinoma cells by ROS-independent mitochondrial pathway through partial inhibition of ERK/MAPK signaling[J].FEBS Lett,2007,581(13):2447-54. |
| [15] | James M F,Beauchamp R L,Manchanda N,et al.A NHERF binding site links the betaPDGFR to the cytoskeleton and regulates cell spreading and migration[J].J Cell Sci,2004,117(Pt 14):2951-61. |
| [16] | Maudsley S,Zamah A M,Rahman N,et al.Platelet-derived growth factor receptor association with Na (+)/H (+) exchanger regulatory factor potentiates receptor activity[J].Mol Cell Biol,2000,20(22):8352-63. |
| [17] | Bessard A,Frémin C,Ezan F,et al.RNAi-mediated ERK2 knockdown inhibits growth of tumor cells in vitroand in vivo [J].Oncogene,2008,27(40):5315-25. |

