酒精性肝病是指长期大量饮用各种含乙醇的饮料所导致的肝脏损害性病变[1]。在酒精性肝纤维化发生过程中,乙醇可通过代谢毒性产物、氧化应激、细胞因子相互作用等多种因素激活肝星状细胞(hepatic stellate cell,HSC)。乙醇在酒精脱氢酶的作用下转化成乙醛,接着在乙醛脱氢酶作用下转化成醋酸,最后分解为二氧化碳和水。根据文献报道,乙醛在酒精性肝纤维化的形成中起到关键作用。HSC的活化增殖是肝纤维化的核心环节,肝脏受损时HSC活化增殖转化为肌样成纤维化细胞,α-SMA合成与分泌细胞外基质(extracellular matrix,ECM)增多,导致ECM合成与降解失衡[2, 3]。腺苷受体(adenosine receptors,ARs)家族包括A1、A2A、A2B和A3受体,属于G蛋白偶联受体超家族,广泛存在于HSC、枯否细胞(kupffer cell,KC)和肝细胞中[4]。在酒精性脂肪肝以及肝纤维化发展过程中,腺苷和ARs激活的作用受到众多研究者的关注。其中A1受体(A1 receptor,A1R)和A2A受体(A2A receptor,A2AR)为高表达受体,也是4种ARs中最主要的2种亚型[5]。有研究表明,在肝纤维化的发病机制中,腺苷受体活化扮演着重要的角色,有望成为预防和治疗肝纤维化的一个新颖的靶点[6]。但ARs在酒精性肝纤维化中的重要调节功能仍未完全明确。本研究在采用乙醛诱导HSC-T6细胞建立离体大鼠酒精性肝纤维化HSC模型的基础上,运用RNA干扰技术,通过构建针对A1R和A2AR基因的小干扰RNA,特异性降低A1R和A2AR的表达,观察靶向抑制A1R和A2AR基因的表达对HSC活化增殖及对α-SMA、Collagen I表达的影响,为酒精性肝纤维化的防治提供新的靶点。
1 材料 1.1 实验细胞株大鼠肝星状细胞株(HSC-T6),购自中国科学院上海细胞研究所。
1.2 试剂和仪器新生牛血清(杭州四季青生物工程材料有限公司,中国),DMEM培养液、TRIzol Reagent RNA 提取试剂(Gibco公司,美国),脂质体转染试剂LipofectamineTM 2000 (Invitrogen公司,美国),乙醛(质量分数40%,天津大茂化学试剂厂,中国),胰蛋白酶、RIPA、PMSF(碧云天公司,中国),逆转录试剂盒(Fermentas 公司,美国),SYBR Green,ECL化学发光试剂盒(Thermo公司,美国),A1R、A2AR抗体(安博公司,中国),α-SMA、Collagen I(博奥森公司,中国),β-actin抗体(中山金桥公司,中国),HRP标记的辣根过氧化物酶二抗(中山金桥公司,中国),引物(捷瑞公司,中国),siRNA序列(上海吉玛公司,中国)。Thermo forma 3111型培养箱(Thermo公司,美国),倒置荧光显微镜(OLYMPUS公司,日本),酶标仪(BiotekEL,美国)
2 方法 2.1 HSC-T6细胞的培养大鼠肝星状细胞系(HSC-T6)以10%小牛血清DMEM培养基培养,另外加抗生素(1×105 U·L-1青霉素、100 mg·L-1链霉素)。置于CO2培养箱(5%CO2、37℃)中,1~2 d换液,2~3 d细胞传代,换液用PBS冲洗3次,传代时用0.25%的胰酶消化细胞1~2 min。
2.2 siRNA的设计与合成A1R和A2AR的siRNA序列由上海吉玛公司设计并合成,该序列经BLAST查询,确认所设计siRNA序列的唯一性。另合成一对带FAM标记的阴性对照siRNASRC序列。(A1R siRNA上游引物序列:5′-CCA GCA UUC UGA UCU ACA UTT -3′,下游引物为:5′-AUG UAG AUC AGA AUG CUG GTT -3′。 A2AR siRNA 上游引物序列:5′-GUG GCU GUA UGA AGU UGA ATT-3′,下游引物为:5′-UUC AAC UUC AUA CAG CCA CTT-3′。siRNASCR 上游引物序列:5′-UUC UCC GAA CGU GUC ACG UTT-3′,下游引物为:5′-ACG UGA CAC GUU CGG AGA ATT-3′)。
2.3 A1R及A2AR siRNA转染取对数生长期HSC-T6细胞,用含10%新生牛血清不含抗生素的DMEM接种于培养瓶中,调整细胞浓度至每毫升4×105个。参照脂质体LipofectamineTM 2000说明书进行siRNA转染。首先转染FAM标记阴性对照siRNA并在荧光显微镜下观察转染效率。实验分为正常组、模型组、转染组、阴性对照组。正常组不经任何处理,模型组、转染组、阴性对照组加入终浓度为200 μmol·L-1的乙醛,并且每12 h补充1次。转染组转染A1R或A2AR siRNA,A1R及A2AR siRNA终浓度均为200 nmol·L-1。阴性对照组转染FAM标记的阴性对照siRNA。按照上海吉玛制药技术有限公司siRNA说明书进行操作,用Opti-MEM(Invitrogen) 脂质体转染试剂进行转染,于37℃、5%CO2细胞培养箱中转染6 h后每组将转染培养基换为含10%血清培养基,继续培养不同时间后收集。采用荧光倒置显微镜观察各组转染后细胞形态及其形态学变化,判断转染效果。
2.4 细胞增殖实验收集对数生长期细胞,胰酶消化后进行细胞计数,调整细胞浓度至每毫升1×105 个接种于96孔板,每孔终体积100 μL,分为4组:正常组(常规培养);模型组(200 μmol·L-1乙醛刺激);siRNA组(200 μmol·L-1乙醛+siRNA 200 nmol·L-1);阴性对照组(200 μmol·L-1乙醛+siRNASCR),进行细胞转染,6 h后弃去转染培养基,每孔加入200 μL含10%血清培养基置37℃、5%CO2培养箱中培养48 h后加MTT(5 g·L-1)20 μL/孔,继续培养4 h,弃上清,加DMSO 100 μL/孔,避光振荡10 min,使结晶充分溶解后,待结晶充分溶解后,使用酶联仪在492 nm波长处测各孔的吸光度。
2.5 Real-time qPCR法检测A1R、A2AR、α-SMA、Collagen Ⅰ mRNA表达收集培养48 h的细胞,采用TRIzol法提取HSC总RNA,采用分光光度法测定其含量及纯度(A260/A280>1.8)。取2 μg总RNA,参照Fermentas公司的RNA PCR Kit试剂盒说明书进行反转录合成cDNA。10 μL PCR反应体系,用PIKO REAL 96 进行实时定量PCR扩增,以β-actin作为内参。下列引物(Tab1)均由上海捷瑞生物技术服务有限公司合成。
收集培养48 h的细胞,每组加1 mL细胞裂解液(含10 μL PMSF),于冰上裂解30 min后置于4℃离心机上12 000×g,离心30 min。取上清,用BCA试剂盒进行蛋白定量。加入上样缓冲液,100℃,加热10 min使蛋白变性。每孔上样20 μL总蛋白,进行SDS-聚丙烯酰胺凝胶电泳(浓缩胶电压80V,分离胶120V)。电泳结束后用BioRAD湿转仪器将蛋白转移到PVDF膜上。膜在室温下用含5%脱脂奶粉的TBST缓冲液封闭3 h后,用TBST清洗3次,每次15 min。加入第一抗体(1 ∶ 500),4 ℃中孵育过夜,再与HRP偶联第二抗体(1 ∶ 10 000)室温孵育1 h,ECL发光试剂盒显影,以β-actin为内参,分别以相应蛋白与β-actin光密度比值表示该蛋白相对表达水平。以上实验结果至少重复3次。
2.7 统计学分析实验数据采用SPSS 17.0软件进行统计学处理,所有数据结果均以 ± s表示,组间比较采用One-Way ANOVA检验。
± s表示,组间比较采用One-Way ANOVA检验。
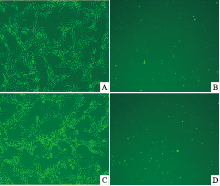
FAM标记siRNA转染HSC-T6细胞48 h后荧光显微镜下观察,可见转染成功的HSC-T6细胞内有绿色荧光,而未转染成功的细胞则无荧光,在同一位置经普通倒置显微镜和荧光显微镜对比观察,转染48 h后转染效率可达70%以上,见Fig1。
|
| Fig 1 Transfection efficiency of siRNA on HSC-T6 cells under fluorescence microscopy(×100) A,B:A1R;C,D:A2AR. |
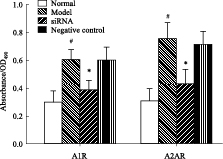
转染siRNA 48 h后,细胞增长明显减慢,MTT比色法结果显示:与正常组比较,模型组和阴性对照组显示,200 μmol·L-1的乙醛对HSC-T6细胞有明显的增殖作用(P<0.05),siRNA组抑制率与模型组比较差异具有统计学意义(P<0.05)。表明A1和A2A受体siRNA对乙醛诱导的HSC细胞的增殖具有明显抑制作用,见Fig2。
|
Fig 2
Proliferation inhibitory effect of siRNA on HSC-T6 cells ( ± s,n=5)
#P<0.05 vs normal group;*P<0.05 vs model group. ± s,n=5)
#P<0.05 vs normal group;*P<0.05 vs model group.
|
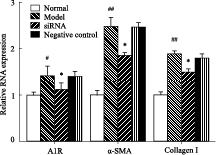
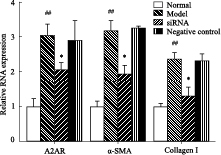
采用相对定量法测定转染siRNA后的HSC-T6细胞内A1R、A2AR基因相对于β-actin内参基因的表达变化。与正常组比较,乙醛作用48 h后,A1R、A2AR、α-SMA、Collagen I mRNA的表达明显增强(P<0.01)。瞬时转染A1R、A2AR siRNA 48h后,A1R、A2AR mRNA表达降低(P<0.05),与模型组相比差异有显著性(P<0.05);同时,siRNA组α-SMA、Collagen I mRNA表达也降低(P<0.05),与模型组相比差异有显著性(P<0.05) 模型组与阴性对照组之间的差异无显著性(P>0.05),见Fig3、4。
|
Fig 3
mRNA expression levels of A1R,α-SMA,Collagen I in HSC-T6 cells at 48h post infection A1R siRNA ( ± s,n=3)
#P<0.05,##P<0.01 vs normal group;*P<0.05 vs model group. ± s,n=3)
#P<0.05,##P<0.01 vs normal group;*P<0.05 vs model group.
|
|
Fig 4
mRNA expression levels of A2AR,α-SMA,Collagen I in HSC-T6 cells at 48h post infection A2AR siRNA( ± s,n=3)
##P<0.01 vs normal group;*P<0.05 vs model group. ± s,n=3)
##P<0.01 vs normal group;*P<0.05 vs model group.
|
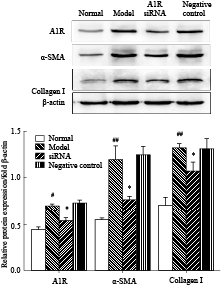
Western blot检测结果表明,200 μmol·L-1的乙醛对HSC-T6细胞增殖具有促进作用,模型组的A1R、A2AR、α-SMA、Collagen I蛋白表达明显增强,与正常组比较差异有显著性(P<0.05)。瞬时转染A1R、A2AR siRNA 48 h后,A1R、A2AR蛋白表达降低(P<0.05),与模型组相比差异有显著性(P<0.05),同时,siRNA组α-SMA、Collagen Ⅰ蛋白表达也降低(P<0.05),与模型组相比差异有显著性(P<0.05)。阴性对照组与空白对照组之间的差异无显著性(P>0.05),见Fig5、6。
|
Fig 5
Protein expression levels of A1R,α-SMA,Collagen Ⅰ in HSC-T6 cells at 48h post infection A1R siRNA( ± s,n=3)
#P<0.05,##P<0.01 vs normal group;*P<0.05 vs model group. ± s,n=3)
#P<0.05,##P<0.01 vs normal group;*P<0.05 vs model group.
|

|
Fig 6
Protein expression levels of A2AR,α-SMA,Collagen I in HSC-T6 cells at 48h post infection A2AR siRNA( ± s,n=3)
#P<0.05,##P<0.01 vs normal group;*P<0.05 vs model group. ± s,n=3)
#P<0.05,##P<0.01 vs normal group;*P<0.05 vs model group.
|
HSC是位于大鼠肝Disses间隙内,紧贴肝窦内皮细胞与肝细胞,是肝内的贮脂细胞,正常情况下HSC表现为富含脂滴的静止状态,但当肝脏受到炎症或机械刺激损伤时,HSC可被活化,HSC的激活是肝纤维化发生发展的中心环节[7]。酒精在生物体内经乙醇脱氢酶可代谢为乙醛,再经乙醛脱氢酶代谢为乙酸。乙醛作为乙醇的直接代谢产物,是激活HSC并导致酒精性肝纤维化发生的关键分子[8]。根据本课题组前期研究结果,选用200 μmol·L-1的乙醛作用48 h作为体外大鼠酒精性肝纤维化的细胞模型是较为理想的[9, 10, 11]。
腺苷作为一种内源性嘌呤核苷,主要通过结合并激活与 G 蛋白偶联的ARs,对机体的许多系统及组织发挥着重要的作用。目前已发现,ARs亚型包括 A1、A2A、A2B和A3受体,其中 A1受体和 A2A受体为高表达受体,也是 4种 ARs中最主要的2种亚型。 Peng等[12]2009年研究表明缺乏或阻断A1R 可阻止小鼠酒精性脂肪肝的发生;Yang等[13]2010年研究报道长期注射 CCl4 诱发的肝纤维化在 A1R 缺乏的小鼠体内减轻,且伴有胶原沉积和 HSC 活化明显减少。亦有研究表明经乙醇诱导后的HSC通过激活A2AR,释放大量腺苷,促进大鼠和人HSC胶原的合成,在Hashmi等[14]和Sohail等[15]的研究也证实了腺苷通过激活A2AR在HSC活化致肝纤维化中的作用。Che等[16]2007年也报道,A2AR通过其偶联的Gs蛋白上调 cAMP-PKA 信号途径,再分别经由其下游信号通路PKA-Src-ERK1/2 MAPK和p38 MAPK诱导LX-2人肝星形状细胞株Ⅰ型胶原和Ⅲ型胶原的生成。
鉴于ARs的重要生理功能,本实验采用特异性A1R和A2AR siRNA转染HSC-T6细胞,并从多角度观察转染效果,成功建立A1R和A2AR siRNA转染HSC-T6细胞的方法,为后续研究打下基础。
观察A1R和A2AR siRNA转染后其mRNA和蛋白的表达,结果显示不论是A1R或A2AR的mRNA及蛋白表达水平均明显减少,说明转染成功。200 μmol·L-1乙醛作用48 h可激活HSC-T6细胞,使α-SMA、Collagen Ⅰ mRNA和蛋白的表达明显增高,但A1R或A2AR siRNA转染对乙醛诱导的HSC-T6细胞的增殖具有抑制作用,转染A1R或A2AR siRNA 48 h后,细胞增长明显减慢,且转染后可明显抑制α-SMA、Collagen Ⅰ的mRNA和蛋白的表达,再次证明转染成功,且表明沉默A1R或A2AR可使HSC的活化增殖受到抑制。
综上所述,本研究通过利用腺苷A1R或A2AR siRNA下调A1R及A2AR基因的表达,可明显抑制乙醛诱导的HSC-T6细胞的活化,抑制α-SMA,Collagen Ⅰ的产生。提示A1R和A2AR在肝纤维化的形成过程中发挥了重要作用,有望成为防治酒精性肝纤维化的靶点之一。但肝纤维化形成是一个复杂的多因素过程,ARs如何调控相关信号通路抑制HSC的活化和增殖,尚需进一步深入研究。
| [1] | Reyes-Gordillo K,Shah R,Arellanes-Robledo J,et al.Mechanisms of action of Acetaldehyde in the up-regulation of the human α2(I) collagen gene in hepatic stellate cells:Key roles of Ski,SMAD3,SMAD4,and SMAD7[J]. Am J Pathol, 2014,184(5):1458-67. |
| [2] | Hernandez-Gea V,Friedman S L.Pathogenesis of liver fibrosis.Annual review of pathology[J]. Mechan Dis ,2011,6:425-56. |
| [3] | 陶辉,黄成,杨晶晶,等.RNAi介导MeCP2基因沉默对HSC-T6细胞活化增殖的影响[J].中国药理学通报,2012,28(3):333-6.Tao H,Huang C,Yang J J,et al.Experimental study of proliferation and activation of HSC-T6 cells through RNA inference targeting MeCP2[J].Chin Pharmacol Bull ,2012,28(3):333-6. |
| [4] | Sands W A,Palmer T M.Adenosine receptors and the control of endothelial cell function in inflammatory disease[J]. Immunol Lett ,2005,101(1):1-11. |
| [5] | Gessi S,Merighi S,Varani K,et al.Adenosine receptors in health and disease[J]. Adv Pharmacol,2011,61:41-75. |
| [6] | Chan E S,Cronstein B N.Adenosine in fibrosis[J]. Mod Rheumatol,2010,20(2):114-22. |
| [7] | Cohen J,Nagy L E.Pathogenesis of alcoholic liver disease:interactions between parenchymal and non-parenchymal cells[J]. J Dig Dis ,2011,12(1):3-9. |
| [8] | 邱萍,李相,孔德松,等.酒精性肝病发病机制研究的新进展[J].中国药理学通报,2014,30(2):160-3.Qiu P,Li X,Kong D S,et al.Research progress on pathogenesis of alcoholic liver disease[J].Chin Pharmacol Bull ,2014,30(2):160-3. |
| [9] | 杨万枝,吕雄文,余世春,等.cAMP-PKA-CREB信号通路在大鼠酒精性肝纤维化星状细胞模型中的作用[J].安徽医药,2012,16(6):729-31.Yang W Z,Lv X W,Yu S C,et al.Effect of cAMP-PKA-CREB signal pathway in the model of alcoholic hepatic fibrosis stellate cells isolated from rats[J]. Anhui Med Pharm J ,2012,16(6):729-31. |
| [10] | 管文婕,吕雄文,杨万枝,等.咖啡因对乙醛诱导的HSC-T6中TGF-β1,CTGF信号转导通路的影响[J].安徽医药,2012,16(8):1060-3.Guan W J,Lv X W,Yang W Z,et al.Effect of caffeine on signaling transduction of TGF-1 and CTGF in hepatic stellate cell-T6 stimulated by acetaldehyde[J]. Anhui Med Pharm J ,2012,16(8):1060-3. |
| [11] | Wang H,Guan W,Yang W,et al.Caffeine inhibits the activation of hepatic stellate cells induced by acetaldehyde via adenosine A2A receptor mediated by the cAMP/PKA/SRC/ERK1/2/p38 MAPK signal pathway[J].PloS one,2014,9(3):e92482. |
| [12] | Peng Z,Borea P A,Varani K,et al.Adenosine signaling contributes to ethanol-induced fatty liver in mice[J]. J Clin Invest ,2009,119(3):582-94. |
| [13] | Yang P,Han Z,Chen P,et al.A contradictory role of A1 adenosine receptor in carbon tetrachloride and bile duct ligation induced liver fibrosis in mice[J]. J Pharmacol Exp Ther ,2010,332(3):747-54. |
| [14] | Hashmi A Z,Hakim W,Kruglov E A,et al.Adenosine inhibits cytosolic calcium signals and chemotaxis in hepatic stellate cells[J].Am J Physiol Gastrointest Liver Physiol ,2007,292(1):395-401. |
| [15] | Sohail M A,Hashmi A Z,Hakim W,et al.Adenosine induces loss of actin stress fibers and inhibits contraction in hepatic stellate cells via Rho inhibition[J]. Hepatology, 2009,49(1):185-94. |
| [16] | Che J,Chan E S,Cronstein B N.Adenosine A2A receptor occupancy stimulates collagen expression by hepatic stellate cells via pathways involving protein kinase A,Src,and extracellular signal-regulated kinases 1/2 signaling cascade or p38 mitogen-activated protein kinase signaling pathway[J]. Mol Pharmacol ,2007,72:1626-36. |