


孔维佳(1972-),男,博士,研究员,博士生导师,研究方向:分子医学与药物。Email:wjkong894@163.com
随着我国社会经济的发展和城乡人民生活水平的不断提高,非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)等代谢性疾病的患病率逐年增加。据统计,在2013年,NAFLD在我国的患病率已达15%[1]。NAFLD的主要病理特征是肝脏实质细胞脂肪蓄积和脂肪变性,如不加以干预,会影响肝功能并最终发展为肝硬化及肝癌[1] ,严重危害人民健康。
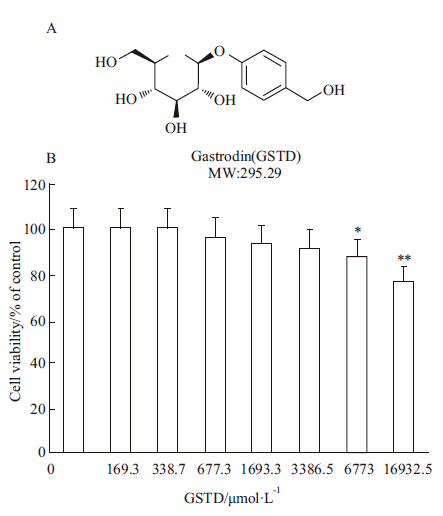
天麻又名赤箭,属兰科植物,以其根茎入药。天麻在我国已有上千年的应用历史,目前临床上主要用于治疗眩晕、癫痫等神经系统疾病[2] 。天麻具有多种药理作用,如降血脂、降血糖、抗血小板聚集等[3, 4] 。另外,我们前期研究工作发现,天麻在NAFLD大鼠模型中能明显减少动物的肝脏脂肪蓄积并改善肝功能[5] 。天麻所含成分较复杂,如天麻素、天麻多糖、多种苷类和生物碱等[2] ,目前其改善NAFLD的分子机制和细胞信号通路尚不明确。因此在本文中,我们利用油酸(oleic acid,OA)诱导建立了体外培养的肝细胞的脂肪变性模型,并研究了天麻的主要有效成分天麻素(gastrodin,GSTD)减少细胞脂肪蓄积的作用及其信号通路,GSTD化学结构式见Fig1A。
|
Fig 1
Chemical structure of GSTD (A) and its influence on cell viability in HL-7702 cells after treatment for 24 h (B) ( ± s, n =5)
MW: Molecular weight;* P <0.05,** P<0.01 vs GSTD 0 ± s, n =5)
MW: Molecular weight;* P <0.05,** P<0.01 vs GSTD 0
|
正常人肝细胞HL-7702细胞系购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.1.2 主要试剂、药物和仪器DMEM培养液和胎牛血清购自美国Gibco-Invitrogen公司;GSTD由浙江诚意药业有限公司提供,以灭菌生理盐水溶解;噻唑蓝(MTT)细胞增殖及细胞毒性检测试剂盒购自江苏碧云天生物技术研究所;Steatosis Colorimetric Assay Kit购自美国Cayman化学公司;三酰甘油(triglyceride,TG)试剂盒购自南京建成生物工程研究所;牛血清白蛋白(BSA)、二甲基亚砜(DMSO)、OA和compound C购自美国Sigma-Aldrich公司;β-actin、AMP活化蛋白激酶α(AMPKα)、磷酸化AMPKα(p-AMPKα)、乙酰辅酶A羧化酶(ACC)、磷酸化乙酰辅酶A羧化酶(p-ACC)单克隆抗体,辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG以及Western blot stripping buffer均购自美国Santa Cruz公司;蛋白Marker、M-PER Mammalian Protein Extraction Reagent 和BCA Protein Assay kit均购自美国ThermoFisher公司;PVDF膜和ECL试剂盒购自美国Millipore公司;VICTOR X4 Multilabel酶标仪购自美国PerkinElmer公司;Olympus BX50光学显微镜和拍照系统购自日本奥林巴斯公司;电泳仪和电转槽购自美国Bio-Rad公司。
1.2 方法 1.2.1 细胞培养HL-7702细胞常规培养于含10%胎牛血清、1%非必需氨基酸和抗生素的DMEM培养液中,置于37℃、5%CO2培养箱中培养。待细胞生长至80%融合时,以0.25%胰蛋白酶-EDTA消化传代。取对数生长期细胞接种于6孔细胞培养板,培养24 h后弃去原培养液,换用含0.5%胎牛血清、1%非必需氨基酸和抗生素的DMEM培养液,血清饥饿24 h后进行试验。
1.2.2 细胞存活率测定细胞血清饥饿24 h后,以浓度为0~16 932.5 μmol·L-1的GSTD(每个浓度重复5次)处理24 h;以MTT细胞增殖及细胞毒性检测试剂盒按照说明书测定GSTD毒性,以酶标仪测定570 nm处吸光值(OD570)。细胞存活率/%(OD570给药-OD570空白)/(OD570对照-OD570空白)×100%。
1.2.3 OA诱导细胞脂肪变性OA溶于PBS缓冲液+5%BSA中[6] ,分装后置-20℃储存。细胞血清饥饿24 h后,加入浓度为1 mmol·L-1的OA孵育24 h诱导脂肪变性[6] 。
1.2.4 药物处理在脂肪染色和细胞TG测定实验中,加OA的同时在培养液中加入0、67.7、169.3或338.7 μmol·L-1的GSTD(每个浓度重复3次)共同孵育24 h。AMPK和ACC磷酸化试验中,细胞血清饥饿24 h后,以169.3 μmol·L-1的GSTD处理0~12 h,或以0~338.7 μmol·L-1的GSTD处理3 h。在使用compound C的实验中,细胞血清饥饿24 h后,某些组别的细胞以浓度为10 μmol·L-1[7](溶于DMSO中)的compound C预处理30 min,其后除对照组外,所有细胞均加入1 mmol·L-1的OA(同时加入或不加入169.3 μmol·L-1的GSTD)。共同孵育12 h后,Western blot测定AMPK和ACC磷酸化水平;或孵育24 h后测定细胞内TG含量。
1.2.5 细胞脂肪染色和定量利用Steatosis Colorimetric Assay Kit并参考说明书进行实验。简述如下:细胞弃去培养液,加入试剂盒中所提供固定液室温孵育15 min,洗涤后加入油红O(ORO)室温孵育20 min;弃去ORO,洗涤并干燥后加入苏木精,镜下观察结果并照相。脂肪蓄积定量则不加苏木精,代以Dye Extraction Solution,孵育30 min后以酶标仪测定500 nm处吸光值,每个浓度重复3次,脂肪蓄积量以对照组细胞的倍数表示。
1.2.6 细胞内TG含量测定细胞做相应处理后以胰蛋白酶-EDTA消化,收集细胞后参考文献报道[8] ,以冻融法裂解细胞。取上清,以试剂盒测定TG浓度,并以BCA法测定蛋白浓度,细胞中TG含量以每g细胞蛋白中所含TG量(μmol·g-1)表示。
1.2.7 Western blot细胞做相应处理后提取总蛋白,以BCA法测定蛋白浓度,每个样品取50 μg蛋白,采用8%分离胶,进行聚丙烯酰胺凝胶电泳(SDS-PAGE)。用电转法将蛋白质转移到PVDF膜上后,5%脱脂奶粉4 ℃封闭过夜。根据蛋白Marker将膜剪成小条,依次与β-actin(1 ∶1 000)、p-AMPKα(1 ∶500)和p-ACC(1 ∶500)单克隆抗体室温摇动孵育2 h,洗涤后与HRP标记的山羊抗小鼠IgG(1 ∶2 500)室温摇动孵育1 h,再洗涤后ECL试剂盒进行化学显色并拍照。利用Western blot stripping buffer将用于检测p-AMPKα和p-ACC的膜上结合的抗体洗脱后,重新与AMPKα(1 ∶500)和ACC(1 ∶500)单克隆抗体进行孵育以检测其总表达水平。每个实验重复3次,蛋白条带以Gel-PRO ANALYZER gel analysis and electrophoresis analysis software (美国Media Cybernetics公司)定量分析,计算p-AMPKα/AMPKα以及p-ACC/ACC的比值,以百分数表示。
1.2.8 统计学分析数据以 ± s表示,采用SPSS 13.0统计软件进行数据处理和分析。多组间的比较采用方差分析,两两比较采用LSD-t检验。
± s表示,采用SPSS 13.0统计软件进行数据处理和分析。多组间的比较采用方差分析,两两比较采用LSD-t检验。
由Fig1B可见,当GSTD浓度≤3 386.5 μmol·L-1时,对肝细胞没有明显毒性;当其浓度≥6 773 μmol·L-1时,细胞存活率的下降,差异有统计学意义。
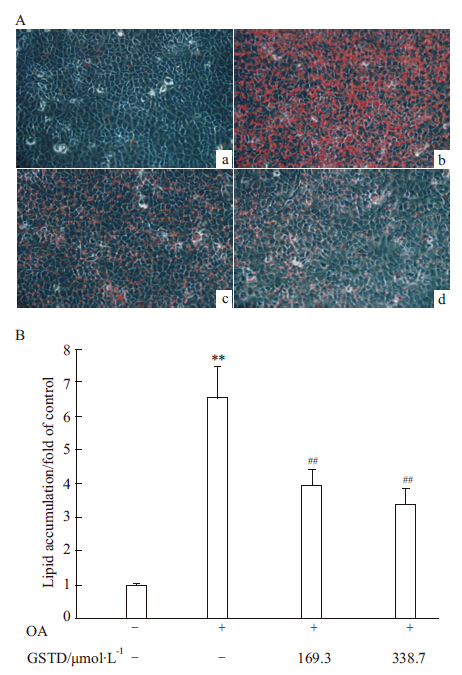
2.2 GSTD对OA诱导的HL-7702细胞脂肪蓄积的抑制作用如Fig2A所示,对照细胞形态正常,只有很少量脂肪被红染;而浓度为1 mmol·L-1的OA处理24 h后,ORO染色肝细胞中出现大量脂滴蓄积,表现为红染面积明显增加。脂肪定量结果与镜下观察结果一致,如Fig2B所示,OA孵育后,HL-7702细胞中脂肪蓄积量较对照细胞增加6倍以上(P&lt;0.01),提示建模成功。浓度为169.3或338.7 μmol·L-1的GSTD与OA共同加入细胞中孵育24 h后,细胞中脂滴蓄积明显减少,表现为镜下ORO红染面积明显减少(Fig2A)。脂肪定量结果与镜下观察相符合。如Fig2B所示,与OA处理的细胞比较,169.3或338.7 μmol·L-1的GSTD使细胞中脂肪蓄积量分别平均下降40.3%(P&lt;0.01)和48.6%(P&lt;0.01)。
|
Fig 2
Fat staining by ORO in HL-7702 cells after OA and GSTD treatment for 24 h as determined by light microscope (200×) (A) as well as quantitative analysis (B) ( ± s, n=3)
a:Control;b:OA;c:OA+GSTD 169.3 μmol·L-1;d:OA+GSTD 338.7 μmol·L-1,**P<0.01 vs control;##P<0.01 vs OA alone. ± s, n=3)
a:Control;b:OA;c:OA+GSTD 169.3 μmol·L-1;d:OA+GSTD 338.7 μmol·L-1,**P<0.01 vs control;##P<0.01 vs OA alone.
|
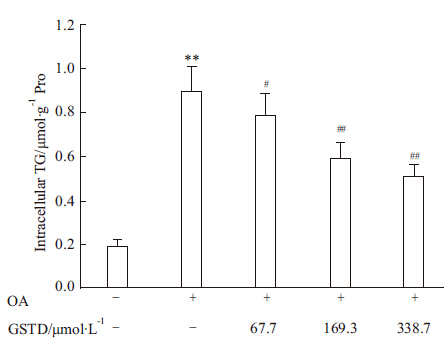
我们进一步测定了HL-7702细胞中的TG含量,结果如Fig3所示。OA处理24 h后使细胞中TG量平均增加4.74倍(与对照细胞比较P&lt;0.01);GSTD在浓度为67.7 μmol·L-1时处理24 h即对肝细胞TG含量增加有明显抑制作用,与OA处理的细胞比较,可使TG含量平均下降12.7%(P&lt;0.05)。浓度为169.3或338.7 μmol·L-1的GSTD处理24 h后可使细胞中TG含量分别平均下降35%和43.6%(与OA处理的细胞比较均为P&lt;0.01)。
|
Fig 3
Effects of GSTD on intracellular TG contents in HL-7702 cells after treatment for 24 h ( ± s, n=3)
**P<0.01 vs control;#P<0.05,##P<0.01 vs OA alone ± s, n=3)
**P<0.01 vs control;#P<0.05,##P<0.01 vs OA alone
|
细胞中的TG含量测定的结果与脂肪染色相符合,以上这些实验结果提示GSTD对OA诱导的肝细胞脂肪蓄积有明显的抑制作用。
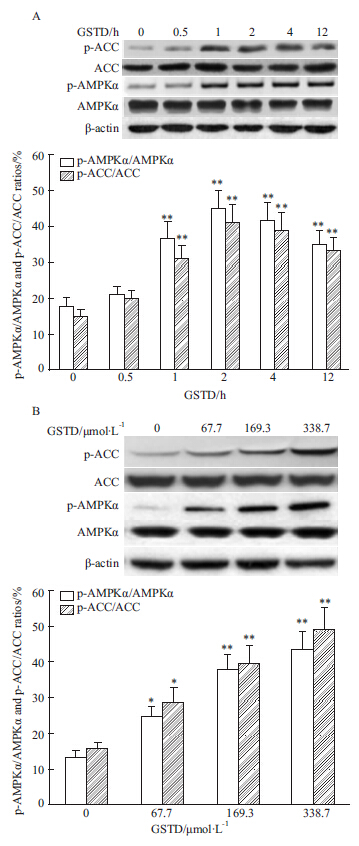
2.3 GSTD对HL-7702细胞的AMPK通路的激活作用天麻和天麻素减少肝脏组织或细胞脂肪蓄积的具体机制尚不明确。由于细胞的AMPK信号通路在脂肪代谢中发挥关键作用[9] ,我们检测了GSTD是否能直接激活肝细胞AMPK。结果如Fig4A所示,GSTD处理后能时间依赖性激活细胞AMPK,表现为p-AMPKα的水平和p-AMPKα/AMPKα比值增加。浓度为169.3 μmol·L-1的GSTD处理1 h后即出现p-AMPKα/AMPKα的比值有统计意义的增加(与对照细胞比较P<0.01),并且至少维持12 h以上;GSTD对AMPKα总蛋白表达水平没有影响。GSTD对AMPK的激活作用也是浓度依赖的,如Fig4B所示,67.7 μmol·L-1的GSTD处理3 h即可明显增加p-AMPKα水平和p-AMPKα/AMPKα比值(与对照细胞比较P<0.05)。作为AMPK的下游激酶,ACC的磷酸化水平在GSTD处理后也相应增加,并且呈时间(Fig4A)和浓度(Fig4B)依赖性,其趋势与AMPK的磷酸化一致。以上这些实验结果提示,GSTD作用于肝细胞后能直接激活AMPK信号通路。
|
Fig 4
Time (A) and dose (B) dependent effects of GSTD on AMPKα and ACC phosphorylation in HL-7702 cells ( ± s, n=3)
*P<0.05,**P<0.01 vs control ± s, n=3)
*P<0.05,**P<0.01 vs control
|
为了证实AMPK通路在GSTD减少肝细胞脂肪蓄积的药理作用中的关键角色,我们使用了一种AMPK特异性抑制剂compound C,并与OA和GSTD共同处理细胞。如Fig5A所示,细胞培养液中加入OA后,p-AMPKα/AMPKα和p-ACC/ACC的比值较对照细胞明显减少(P<0.05),与文献报道一致[10] ;compound C预处理并与OA共同孵育后进一步减少细胞的p-AMPKα和p-ACC水平(与单加OA的细胞比较P<0.05)。GSTD与OA共同孵育后明显增加p-AMPKα/AMPKα和p-ACC/ACC的比值(与单加OA的细胞比较P<0.01),提示GSTD在OA存在的情况下也能激活细胞的AMPK通路。浓度为10 μmol·L-1的compound C预处理30 min并与OA和GSTD共同孵育后完全阻断了GSTD对AMPK的激活作用,表现为p-AMPKα/AMPKα和p-ACC/ACC的比值较OA+GSTD处理细胞明显减少(P<0.01)。
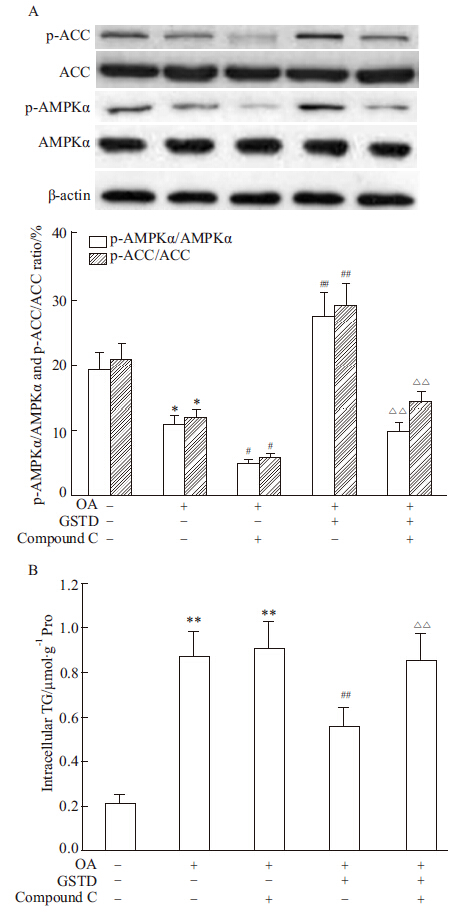
|
Fig 5
Compound C abolished stimulating activity of GSTD on AMPKα/ACC pathway (A) and blocked its inhibitory effect on intracellular TG accumulation (B) in HL-7702 cells ( ± s, n=3)
*P<0.05,**P<0.01 vs control;# P <0.05,## P <0.01 vs OA alone;ΔΔ P <0.01 vs OA+GSTD ± s, n=3)
*P<0.05,**P<0.01 vs control;# P <0.05,## P <0.01 vs OA alone;ΔΔ P <0.01 vs OA+GSTD
|
更为重要的是,我们发现GSTD减少肝细胞脂肪蓄积的作用依赖于AMPK通路的激活。如Fig5B所示,单加compound C对OA诱导的肝细胞TG含量增加没有任何作用;而用compound C预处理细胞并与OA+GSTD共同孵育后能完全阻断GSTD减少肝细胞TG含量的药效(与OA+GSTD组细胞比较P<0.01)。
3 讨 论本研究中,我们应用HL-7702细胞探讨了天然产物GSTD减少肝细胞脂肪蓄积的药理作用及可能的分子机制,并首先报道了GSTD对细胞 AMPK信号通路的激活作用。
我们的结果显示,GSTD对肝细胞的毒性很低,在浓度≥6 773 μmol·L-1的条件下才影响细胞存活率,这与我们先前报道的天麻粉的毒性研究结果相吻合[11] 。天麻粉在小鼠和大鼠中的最大耐受剂量(MTD)均超过15.0 g·kg-1体重,并且长期给药对肝脏等器官未见明显毒性[11] ,下一步我们还将进行GSTD在动物中的毒理学研究。
本研究应用了OA来建立肝细胞脂肪变性模型,OA作为一种游离脂肪酸被认为能较好地在体外模拟NAFLD的病理变化[12] 。我们的结果显示GSTD对OA诱导的肝细胞脂肪蓄积和TG含量增加有明显的抑制作用,这与我们先前的报道天麻明显改善脂肪乳诱导的大鼠NAFLD相吻合[5] ,因为GSTD是天麻的主要有效成分。
本研究最主要的发现是GSTD减轻肝细胞脂肪蓄积的作用依赖于细胞 AMPK信号通路的激活。AMPK是肝脏、脂肪组织和肌肉等代谢器官能量平衡和代谢调控的中枢性和关键分子,也是治疗糖尿病、胰岛素抵抗、血脂紊乱和NAFLD的重要靶点[9]。AMPK能磷酸化并抑制其下游激酶ACC,使丙二酰辅酶A合成减少[9] 。丙二酰辅酶A是脂肪酸β氧化限速酶肉毒碱棕榈酰基转移酶1(CPT1)的别构抑制剂,AMPK激活后能增加CPT1的活性,促进脂肪酸进入线粒体进行β氧化,从而促进脂肪的燃烧和代谢[9] 。
AMPK通路还对脂肪的合成和分解代谢有全面影响,如通过下调固醇调节元件结合蛋白1c(SREBP1c)来抑制脂肪合成,并通过上调过氧化物酶体增殖物激活受体α(PPARα)来促进脂肪分解[13] 。因此我们实验室下一步的研究重点将放在GSTD对脂肪酸β氧化的影响,以及对SREBP1c和PPARα等分子的作用上,包括一系列体外实验和动物实验,从而深入全面地阐明GSTD抑制肝细胞脂肪蓄积的分子机制。
另外,GSTD是如何激活AMPK的尚不清楚。有一些天然药物如小檗碱通过抑制线粒体中ATP的生物合成来激活AMPK从而改善代谢[14] ,另有一些药物如二甲双胍能通过活化AMPK的上游激酶肝激酶B1(LKB1)来激活AMPK[15] 。GSTD激活AMPK的具体机制是值得深入研究的。
综上所述,本研究首次报道了GSTD通过激活AMPK信号通路来减少肝细胞脂肪蓄积的有益作用。由于目前临床上NAFLD缺乏针对性药物治疗,本研究将为GSTD用于治疗NAFLD提供科学依据。
| [1] | Fan J G. Epidemiology of alcoholic and nonalcoholic fatty liver disease in China [J] . J Gastroenterol Hepatol, 2013, 28 (Suppl 1): 11-7. |
| [2] | 陶云海. 天麻药理研究新进展 [J] . 中国中药杂志, 2008, 33 (1) : 108-10. Tao Y H. Recent progress on pharmacological effects of Gastrodia elata [J] . China J Chin Mat Med, 2008, 33 (1) : 108-10. |
| [3] | 于 滨, 左增艳, 蒋建东. 天麻细粉和天麻素降血脂作用的实验研究 [J] . 中国医药生物技术, 2010, 5 (6): 415-8. Yu B, Zuo Z Y, Jiang J D. Experimental study on the antihyperlipidemia effect of Gastrodina commen-pulverization and Gastrodin [J] . Chin Med Biotechnol, 2010, 5 (6): 415-8. |
| [4] | 孟保华, 李文军, 淤泽溥, 等. 天麻素对家兔体外血小板聚集的影响 [J] . 中药药理与临床, 2006, 22 (3-4): 46-7. Meng B H, Li W J, Yu Z P, et al. Effects of Gastrodine on rabbit platelets aggregation in vitro [J] . Pharmacol Clin Chin Mater Med, 2006, 22 (3-4): 46-7. |
| [5] | 耿亚娜, 于 滨, 左增艳, 等. 天麻粉改善脂肪乳剂灌胃大鼠肝脏脂肪变性的实验研究 [J] . 中国医药导报, 2013, 10 (30): 11-5. Geng Y N, Yu B, Zuo Z Y, et al. Experimental study of Gastrodia powder in improving hepatic steatosis in rats intragastrically administered with fat emulsion [J] . China Med Her, 2013, 10 (30): 11-5. |
| [6] | Okamoto Y, Tanaka S, Haga Y. Enhanced GLUT2 gene expression in an oleic acid-induced in vitro fatty liver model [J] . Hepatol Res, 2002, 23(2):138-44. |
| [7] | Quan H Y, Kim D Y, Kim S J, et al. Betulinic acid alleviates non-alcoholic fatty liver by inhibiting SREBP1 activity via the AMPK-mTOR-SREBP signaling pathway [J] . Biochem Pharmacol, 2013, 85 (9):1330-40. |
| [8] | 王俊杰, 龙 婷, 曹 欣, 等. 荷叶黄酮对油酸孵育的HepG2细胞甘油三酯代谢的影响 [J] . 中国药理学通报, 2010, 26 (12): 1626-30. Wang J J, Long T, Cao X, et al. The influence of Flavonoids extracted from lotus on the triglyceride metabolism of HepG2 cells incubated in oleic acid [J] . Chin Pharmacol Bull,2010,26 (12): 1626-30. |
| [9] | Hardie D G. AMPK: a key regulator of energy balance in the single cell and the whole organism [J] . Int J Obes (Lond), 2008, 32 (Suppl 4) : 7-12. |
| [10] | Niu Y, Li S, Na L, et al. Mangiferin decreases plasma free fatty acids through promoting its catabolism in liver by activation of AMPK [J]. PLoS One, 2012, 7 (1): e30782. |
| [11] | 于滨, 左增艳, 孔维佳. 天麻细粉片毒性及安全性的实验研究 [J]. 中国当代医药, 2014, 21 (21): 6-10. Yu B, Zuo Z Y, Kong W J. Experimental studies of the toxicity and safety of Gastrodina elata powder tablets [J]. China Mod Med, 2014, 21 (21): 6-10. |
| [12] | Cui W, Chen S L, Hu K Q. Quantification and mechanisms of oleic acid-induced steatosis in HepG2 cells [J]. Am J Transl Res, 2010, 2(1): 95-104. |
| [13] | Liao C C, Ou T T, Huang H P, et al. The inhibition of oleic acid induced hepatic lipogenesis and the promotion of lipolysis by caffeic acid via up-regulation of AMP-activated kinase [J]. J Sci Food Agric, 2014, 94 (6): 1154-62. |
| [14] | Yin J, Gao Z, Liu D, et al. Berberine improves glucose metabolism through induction of glycolysis [J]. Am J Physiol Endocrinol Metab, 2008, 294 (1) : 148-56. |
| [15] | Bang S, Chen Y, Ahima R S, et al. Convergence of IPMK and LKB1-AMPK signaling pathways on metformin action [J]. Mol Endocrinol, 2014, 28(7): 1186-93. |
