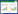文章信息
- 姚晨, 黄鑫, 李钢, 李增沛, 李征
- YAO Chen, HUANG Xin, LI Gang, LI Zengpei, LI Zheng
- 敲低PTGS2抑制肿瘤相关巨噬细胞M2极化在鼻咽癌治疗中的应用价值
- Effects of PTGS2 knockdown in nasopharyngeal carcinoma treatment by inhibiting tumor-associated macrophage M2 polarization
- 中国医科大学学报, 2025, 54(7): 613-618
- Journal of China Medical University, 2025, 54(7): 613-618
-
文章历史
- 收稿日期:2024-04-15
- 网络出版时间:2025-07-07 10:03:26
2. 南阳市第一人民医院胃肠外科一病区, 河南 南阳 473000;
3. 南阳市第一人民医院耳鼻咽喉科一病区, 河南 南阳 473000
2. Gastrointestinal Surgery Ward 1, Nanyang First People's Hospital, Nanyang 473000, China;
3. Otolaryngology Ward 1, Nanyang First People's Hospital, Nanyang 473000, China
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种发生于鼻咽黏膜的上皮性肿瘤,常见于咽隐窝[1]。2018年全球NPC新发病例约1.9万例[2-3]。NPC与EB病毒感染密切相关[4-5]。同步放化疗是NPC的主要治疗方法之一[6],但化疗耐药已成为NPC复发患者治疗的障碍,需要寻找新的治疗靶点和治疗策略[7]。
肿瘤微环境对于肿瘤的恶性进展至关重要[8]。肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)是一类关键的免疫调节细胞。TAM分为经典的M1表型和M2表型。M1表型TAM具有抑制肿瘤的作用,可以分泌经典的炎性细胞因子,如白细胞介素-12(interleukin-1,IL-12),通过促进肿瘤细胞坏死和免疫细胞的浸润抑制肿瘤。相反,M2表型TAM具有强大的免疫抑制功能和促进肿瘤恶性进展的作用,包括分泌免疫抑制细胞因子,如IL-10和转化生长因子β(transforming growth factor β,TGF-β),募集免疫抑制细胞,促进肿瘤上皮-间质转化(epithelial-mesenchymal transition,EMT),分泌胞外基质降解酶,破坏基底膜,促进血管生成等,从而进一步促进肿瘤进展和远端转移[8-9]。
前列腺素-内过氧化物合酶(prostaglandin-endoperoxide synthase,PTGS2),又称环氧合酶,不仅能促进肿瘤的发生、发展,还在促进肿瘤干细胞存活、EMT和调节肿瘤免疫耐受中发挥重要作用[10]。但其在NPC中的表达和作用尚未见深入研究。本研究拟通过测定NPC组织样本中PTGS2 mRNA的相对表达水平,评估其高表达与NPC疾病进展的相关性,并通过体外细胞实验,探讨敲低PTGS2在NPC治疗中的应用价值。
1 材料与方法 1.1 材料裸鼠18只,3~4周龄,体重13~16 g,购自河南省实验动物中心。1例新鲜NPC组织(Ⅲ期)样本来自我院耳鼻咽喉科NPC切除手术标本。原代NPC细胞分离委托武汉普诺赛生命科技有限公司代为完成。腺病毒载体pADV-U6-shRNA-CMV-EGFP购自和元生物技术(上海)股份有限公司,腺病毒颗粒包装也委托其代为完成。人单核细胞系THP-1购自武汉普诺赛生命科技有限公司。Dynabeads Untouched人CD8+T细胞试剂盒(货号11348D)、IL-12 p70 Human ProQuantum Immunoassay Kit(货号A35591)和Human IL-10 ProQuantum Immunoassay Kit(货号A35590)购自美国Thermo Fisher Scientific公司。人TGF-β1 ELISA试剂盒(货号ab100647)购自英国abcam公司。CCK-8试剂盒(货号BB-4202)购自长沙贝博生物科技有限公司。
1.2 方法 1.2.1 原代NPC细胞培养用4 ℃无菌PBS短暂冲洗新鲜NPC组织后,立即移至装有4 ℃含10%胎牛血清RPMI 1640完全培养液的细胞培养瓶中,并委托武汉普诺赛生命科技有限公司完成原代NPC细胞分离。分离获得的原代NPC细胞用RPMI 1640完全培养液于37 ℃、5%CO2细胞培养箱中培养。
1.2.2 THP-1细胞培养和极化将THP-1细胞培养于6孔板中,加入100 ng/mL佛波醇-12-肉豆蔻酸-13-乙酸酯处理24 h后,加入100 ng/mL脂多糖(lipopolysaccharide,LPS)+5 μmol/L腺苷(adenosine,A),刺激使其极化为TAM。将极化的TAM置于含100 ng/mL LPS+5 μmol/L A的RPMI 1640完全培养液中维持培养。
1.2.3 CD8+T细胞分离和培养采集健康志愿者全血,通过密度梯度离心法从全血中分离出人外周血单核细胞。使用Dynabeads Untouched人CD8+T细胞试剂盒分离和纯化人CD8+T细胞,将其培养于RPMI 1640完全培养液中。
1.2.4 腺病毒介导的PTGS2 shRNA敲低使用pADV-U6-shRNA-CMV-EGFP腺病毒载体构建Adv-PTGS2 shRNA,介导PTGS2 shRNA敲低,其敲低对照组为Adv-shRNA NT。PTGS2 shRNA序列:5’-GAAGCCTTCTCTAACCTCTCC-3’。shRNA NT序列:5’-ATACTGTGCGTACACACGCAA-3’。向原代NPC细胞中加入1×109 PFU/mL腺病毒颗粒进行转染操作。
1.2.5 建立原代NPC细胞与TAM的共培养体系向24孔板下层培养孔中种入原代NPC细胞,或对其进行腺病毒介导的PTGS2 shRNA敲低处理后,上层细胞小室中接种极化的TAM,建立共培养体系。添加含100 ng/mL LPS+5 μmol/L A的RPMI 1640完全培养液,对共培养体系进行维持培养。
1.2.6 制备3D明胶水凝胶微球(gelatin hydrogel microsphere,GM)取30 mL等电点为5.0、平均分子量为100×103的10%明胶水溶液,置于40 ℃水浴中加热充分乳化。随后置于4 ℃冷却,使其自然凝胶化成为GM。用4 ℃预冷的丙酮洗GM 3次。用32 μm筛网对GM进行过筛处理。用丙酮重悬GM,悬液置于4 ℃风干,随后置于140 ℃真空烘箱脱水并热交联。将30 μL含有5 μmol/L A的PBS与3 mg交联GM混合,置于37 ℃水浴中孵育过夜,获得3D GM-A。
1.2.7 建立原代NPC细胞与TAM的3D共培养物和CD8+T细胞的混合培养体系在24孔板的下层培养孔中预先制备聚乙烯醇[A poly(vinyl alcohol),PVA]预涂膜。向100 μL(1×103/mL)3D GM-A悬液中分别加入50 μL(2×106/mL)TAM和原代NPC细胞,然后加入1 mL含100 ng/mL LPS+5 μmol/L A的RPMI 1640完全培养液,形成3D细胞混悬液,加入PVA预涂膜的24孔板下层培养孔中。向上层细胞小室中接种CD8+T细胞(1×106/mL),建立原代NPC细胞与TAM的3D共培养物和CD8+T细胞的混合培养体系。
1.2.8 ELISA取共培养物的培养上清液,使用人IL-12、IL-10和TGF-β1 ELISA试剂盒,按照说明书检测上清液中的细胞因子含量。
1.2.9 实时定量PCR取24孔板上层细胞小室中CD8+T细胞,用TRIzol裂解液裂解细胞。用EasyPure RNA Kit试剂盒提取总RNA。使用EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒反转录合成cDNA。使用TransStart Green qPCR Super Mix UDG试剂盒进行实时定量PCR反应。PCR引物序列如下:γ干扰素(interferon-γ,IFN-γ),正向5’-CTTTTCAGCTCTGCATCGTT-3’,反向5’-TCTGCATTATTTTTCTGTCA-3’;颗粒酶B(granzyme B,GZMB),正向5’-AGGGCAGCCTTCCTGAGAAG-3’,反向5’-GGCCTCATGTCCCCCGATG-3’;GAPDH,正向5’-GTAAAGTGGATATTGTTGC-3’,反向5’-TCTCCATGGTGGTGAAGACG-3’。
1.2.10 Western blotting取1.2.5中的共培养物,去掉上层小室(TAM细胞),留取下层小室原代NPC细胞培养物。加入含蛋白酶抑制剂的RIPA裂解液(0.8 mL/孔)裂解细胞,随后合并2孔细胞裂解液,并提取总蛋白。进行SDS-PAGE,转至PVDF膜。室温下用含5%脱脂奶粉TBST封闭PVDF膜1 h。滴加一抗工作液[兔抗人MMP-2(1∶2 000),MMP-9(1∶2 000),GAPDH(1∶1 500)],4 ℃孵育过夜。次日,滴加二抗工作液[HRP标记IgG(H+L)二抗(1∶6 000)],室温孵育1 h。ECL发光显影。
1.2.11 CCK-8检测取1.2.7中24孔板上层细胞小室的CD8+T细胞,转移至下层培养室无细胞培养物的新24孔板中。使用CCK-8试剂盒测定细胞增殖能力,测定450 nm处吸光度值。
1.2.12 裸鼠荷瘤实验将18只4周龄裸鼠随机分为control组、Adv-PTGS2 shRNA组和Adv-shRNA NT组,每组6只。将1×106个TAM和0.5×106个CD8+T细胞混合,再与1×106个control组、Adv-PTGS2 shRNA组(Adv-PTGS2 shRNA转染)、Adv-shRNA NT组(Adv-shRNA NT转染)原代NPC细胞混合,制成200 μL细胞悬液。分别皮下注射接种至裸鼠背部。每隔3 d使用游标卡尺监测1次肿瘤大小。在皮下注射后第21天,采用颈椎脱臼法处死裸鼠,采集肿瘤组织,测定其体积和质量。本研究中动物实验获得我院实验动物伦理委员会批准(伦理号SY202202-02)。
1.3 统计学分析采用GraphPad Prism 8软件进行统计学分析。计量资料以x±s表示。3组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 原代NPC细胞敲低PTGS2抑制TAM M2极化在原代NPC细胞与极化的TAM建立的共培养物中,Adv-PTGS2 shRNA组M1表型巨噬细胞标志物IL-12平均荧光强度(mean of fluorescent intensity,MFI)水平高于control组(P < 0.05),见图 1A。Adv-PTGS2 shRNA组M2表型巨噬细胞标志物IL-10、TGF-β MFI水平低于control组(P < 0.05),见图 1B、1C。与control组相比,Adv-PTGS2 shRNA组MMP-2和MMP-9的蛋白表达水平降低(P < 0.05),见图 1D。Adv-shRNA NT组和control组上述所有指标测定结果无统计学差异(P > 0.05)。
|
| A to C,the levels of IL-12(A),IL-10(B)and TGF-β(C)in control group,Adv-PTGS2 shRNA group and Adv-shRNA NT group of the co-cultured primary NPC cells and TAMs were determined with ELISA;D,Western blotting was used to determine the expression levels of MMP-2 and MMP-9 in primary NPC cells. * P < 0.05. 图 1 原代NPC细胞敲低PTGS2抑制M2巨噬细胞极化 Fig.1 PTGS2 knockdown in primary NPC cells inhibited M2 macrophage polarization |
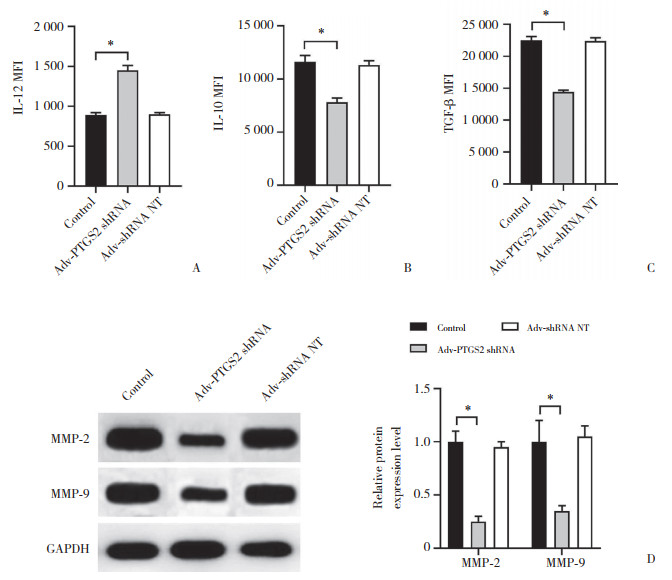
2.2 敲低PTGS2的原代NPC细胞与TAM的3D共培养物促进CD8+T细胞增殖
在原代NPC细胞与TAM的3D共培养物和CD8+T细胞的混合培养体系中,与control组相比,Adv-PTGS2 shRNA组CD8+T细胞增殖能力增强(P < 0.05),见图 2A。与control组相比,Adv-PTGS2 shRNA组CD8+T细胞内表型标志物IFN-γ和GZMB mRNA的表达水平上调(P < 0.05),见图 2B。Adv-shRNA NT组和control组上述所有指标测定结果无统计学差异(P > 0.05)。
|
| A,the proliferation ability of CD8+T cells in the control group,Adv-PTGS2 shRNA group,and Adv-shRNA NT group of 3D co-culture of primary NPC cells with TAMs and CD8+T cells were determined by CCK-8 method;B,the relative expression levels of IFN-γ and GZMB mRNA in CD8+T cells were measured by real time quantitative PCR analysis. *P < 0.05. 图 2 敲低PTGS2的原代NPC细胞与TAM的3D共培养物促进CD8+T细胞的增殖 Fig.2 3D co-cultured of knockdown PTGS2 in primary NPC cells with TAMs and CD8+T cells could promote the proliferation of CD8+T cells |
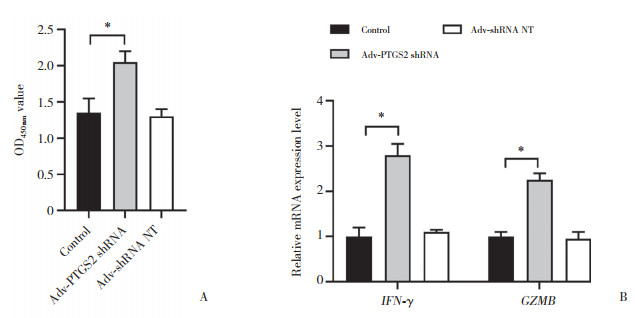
2.3 敲低PTGS2抑制NPC的在体增殖
与control组相比,Adv-PTGS2 shRNA组裸鼠荷瘤生长缓慢(P < 0.05),见图 3A。与control组相比,Adv-PTGS2 shRNA组瘤体质量较低(P < 0.05),见图 3B。Adv-shRNA NT组和control组裸鼠荷瘤生长情况和瘤体质量无统计学差异(P > 0.05)。
|
| A,xenografts growth curves of control group,Adv-PTGS2 shRNA group,and Adv-shRNA NT group were monitored for 21 d;B,tumor mass was measured at day 21. *P < 0.05 vs. control group. 图 3 在体裸鼠荷瘤实验瘤体生长情况测定 Fig.3 Tumor growth was measured in nude mice xenografts |
3 讨论
肿瘤微环境主要由肿瘤细胞、肿瘤相关成纤维细胞、血管细胞和浸润性免疫细胞组成。非肿瘤细胞的肿瘤微环境细胞能够对肿瘤细胞的侵袭产生决定性影响[11]。M1表型TAM具有抗肿瘤活性,如激活CD8+T细胞和自然杀伤细胞等,对肿瘤细胞实施杀伤和清除[12]。而M2表型TAM则介导机体对肿瘤的免疫耐受[13],同时还会促进分泌TGF-β,介导免疫逃逸和化疗耐药[14]。因此,如何重塑肿瘤微环境,将TAM的表型从M2表型重编程为M1表型至关重要[15-16]。
由PTGS2生成的前列腺素E2(prostaglandin E,PGE2)具有促进肿瘤细胞增殖和调节免疫细胞群形成免疫耐受性肿瘤微环境的功能[17]。如PGE2通过EP4/PI3K/Akt/NF-κB/通路上调PD-1的表达,抑制CD8+T细胞增殖和对肿瘤细胞的细胞毒作用,促进结直肠腺癌进展[18]。在多种肿瘤细胞中,IL-17通过激活PTGS2/PGE2通路使TAM极化为M2表型,并介导免疫耐受[19]。TAM可通过上调PGE2增加巨噬细胞集落刺激因子1的丰度,促进肝细胞癌进展[20]。本研究发现,在原代NPC细胞中敲低PTGS2后,能够抑制TAM向M2方向极化,下调IL-10和TGF-β的水平,抑制自身胞内MMP-2和MMP-9的表达。CD8+T细胞浸润能够增加NPC对放化疗联合治疗的敏感性[21]。放疗可通过上调癌细胞中CCL22的表达,增强CD8+T细胞向肿瘤的浸润,进一步增强其对NPC的杀伤作用[22]。本研究还进一步探讨了敲低PTGS2是否影响CD8+T细胞的功能,结果显示,与control组相比,Adv-PTGS2 shRNA组CD8+T细胞增殖能力增强。IFN-γ和GZMB都属于细胞毒细胞因子。GZMB是效应性CD8+T细胞活化的关键激活因子[23-24]。效应性CD8+T细胞会大量分泌IFN-γ以维持其免疫激活状态,并同时招募自然杀伤细胞在肿瘤内浸润,营造抗肿瘤免疫微环境[25-26]。本研究结果显示,与control组相比,Adv-PTGS2 shRNA组CD8+T细胞IFN-γ和GZMB mRNA的相对表达水平上调,说明为效应性CD8+T细胞激活状态。进一步在体裸鼠的荷瘤实验结果也证明,皮下注射Adv-PTGS2 shRNA组原代NPC细胞、TAM和CD8+T细胞混合培养物,连续生长21 d,瘤体体积和质量明显低于control组。
总之,尽管本研究尚未深入探讨敲低PTGS2对TAM和效应性CD8+T细胞的细胞毒功能的调节是否涉及外泌体途径,但本研究结果表明,敲低PTGS2可抑制TAM向M2表型极化,并调节肿瘤微环境为免疫激活状态,抑制NPC的生长。
| [1] |
LEE HM, OKUDA KS, GONZÁLEZ FE, et al. Current perspectives on nasopharyngeal carcinoma[J]. Adv Exp Med Biol, 2019, 1164: 11-34. DOI:10.1007/978-3-030-22254-3_2 |
| [2] |
CHEN YP, CHAN ATC, LE QT, et al. Nasopharyngeal carcinoma[J]. Lancet, 2019, 394(10192): 64-80. DOI:10.1016/S0140-6736(19)30956-0 |
| [3] |
周勇, 陈浩, 窦前, 等. 基于5种EB病毒抗体评估广州地区人群患鼻咽癌的危险度[J]. 实用医学杂志, 2023, 39(5): 602-606, 612. DOI:10.3969/j.issn.1006-5725.2023.05.013 |
| [4] |
VASUDEVAN HN, YOM SS. Nasopharyngeal carcinoma and its association with Epstein-Barr virus[J]. Hematol Oncol Clin North Am, 2021, 35(5): 963-971. DOI:10.1016/j.hoc.2021.05.007 |
| [5] |
纪越, 王志海, 张茏. EB病毒四项抗体联合EB病毒DNA检测在鼻咽癌早期诊断中的应用价值[J]. 中国医刊, 2023, 58(3): 291-294. DOI:10.3969/j.issn.1008-1070.2023.03.018 |
| [6] |
GUAN SZ, WEI JR, HUANG LK, et al. Chemotherapy and chemo-resistance in nasopharyngeal carcinoma[J]. Eur J Med Chem, 2020, 207: 112758. DOI:10.1016/j.ejmech.2020.112758 |
| [7] |
LI WT, DUAN XB, CHEN XX, et al. Immunotherapeutic approaches in EBV-associated nasopharyngeal carcinoma[J]. Front Immunol, 2023, 13: 1079515. DOI:10.3389/fimmu.2022.1079515 |
| [8] |
白洋洋, 陈瑞廷, 孙继建, 等. 免疫原性细胞死亡相关基因对膀胱癌预后分型及免疫治疗的影响[J]. 中国医科大学学报, 2023, 52(5): 426-433. DOI:10.12007/j.issn.0258-4646.2023.05.008 |
| [9] |
DENG R, LU J, LIU X, et al. PD-L1 expression is highly associated with tumor-associated macrophage infiltration in nasopharyngeal carcinoma[J]. Cancer Manag Res, 2020, 12: 11585-11596. DOI:10.2147/CMAR.S274913 |
| [10] |
TONG DL, LIU QL, WANG LN, et al. The roles of the COX2/PGE2/EP axis in therapeutic resistance[J]. Cancer Metastasis Rev, 2018, 37(2/3): 355-368. DOI:10.1007/s10555-018-9752-y |
| [11] |
HINSHAW DC, SHEVDE LA. The tumor microenvironment innately modulates cancer progression[J]. Cancer Res, 2019, 79(18): 4557-4566. DOI:10.1158/0008-5472.CAN-18-3962 |
| [12] |
刘松华, 荣耀, 唐明政, 等. FBXO43在泛癌中的表达及其与免疫细胞浸润和预后的关系[J]. 中国医科大学学报, 2024, 53(9): 834-844. DOI:10.12007/j.issn.0258-4646.2024.09.012 |
| [13] |
LIU Q, YANG CG, WANG SY, et al. Wnt5a-induced M2 polarization of tumor-associated macrophages via IL-10 promotes colorectal cancer progression[J]. Cell Commun Signal, 2020, 18(1): 51. DOI:10.1186/s12964-020-00557-2 |
| [14] |
PAN YY, YU YD, WANG XJ, et al. Tumor-associated macrophages in tumor immunity[J]. Front Immunol, 2020, 11: 583084. DOI:10.3389/fimmu.2020.583084 |
| [15] |
夏天亮, 宋世键, 胡正勇, 等. 肿瘤相关巨噬细胞促进鼻咽癌细胞转移的机制研究[J]. 热带医学杂志, 2017, 17(3): 333-336, 342, 414. DOI:10.3969/j.issn.1672-3619.2017.03.014 |
| [16] |
XIANG XN, WANG JG, LU D, et al. Targeting tumor-associated macrophages to synergize tumor immunotherapy[J]. Signal Transduct Target Ther, 2021, 6(1): 75. DOI:10.1038/s41392-021-00484-9 |
| [17] |
贺旸知歌, 姜旭, 张志文, 等. PTGS2调控细胞增殖及抗氧化能力影响结肠癌患者预后[J]. 基础医学与临床, 2024, 44(11): 1522-1529. DOI:10.16352/j.issn.1001-6325.2024.11.1522 |
| [18] |
WEI J, ZHANG JY, WANG DZ, et al. The COX-2-PGE2 pathway promotes tumor evasion in colorectal adenomas[J]. Cancer Prev Res, 2022, 15(5): 285-296. DOI:10.1158/1940-6207.CAPR-21-0572 |
| [19] |
LI QL, LIU LX, ZHANG QY, et al. Interleukin-17 indirectly promotes M2 macrophage differentiation through stimulation of COX-2/PGE2 pathway in the cancer cells[J]. Cancer Res Treat, 2014, 46(3): 297-306. DOI:10.4143/crt.2014.46.3.297 |
| [20] |
ZHANG J, ZHANG HY, DING XL, et al. Crosstalk between macrophage-derived PGE2 and tumor UHRF1 drives hepatocellular carcinoma progression[J]. Theranostics, 2022, 12(8): 3776-3793. DOI:10.7150/thno.69494 |
| [21] |
KAWAGUCHI T, ONO T, SATO F, et al. CD8+T cell infiltration predicts chemoradiosensitivity in nasopharyngeal or oropharyngeal cancer[J]. Laryngoscope, 2021, 131(4): E1179-E1189. DOI:10.1002/lary.29097 |
| [22] |
LI HH, CHEN X, ZENG WJ, et al. Radiation-enhanced expression of CCL22 in nasopharyngeal carcinoma is associated with CCR4+ CD8 T cell recruitment[J]. Int J Radiat Oncol Biol Phys, 2020, 108(1): 126-139. DOI:10.1016/j.ijrobp.2020.05.001 |
| [23] |
ZANGARI B, TSUJI T, MATSUZAKI J, et al. Tcf-1 protects anti-tumor TCR-engineered CD8+T-cells from GzmB mediated self-destruction[J]. Cancer Immunol Immunother, 2022, 71(12): 2881-2898. DOI:10.1007/s00262-022-03197-2 |
| [24] |
VEMULAWADA C, RENAVIKAR PS, CRAWFORD MP, et al. Disruption of IFNγ, GZMB, PRF1, or LYST results in reduced suppressive function in human CD8+T cells[J]. J Immunol, 2024, 212(11): 1722-1732. DOI:10.4049/jimmunol.2300388 |
| [25] |
ST PAUL M, OHASHI PS. The roles of CD8+T cell subsets in antitumor immunity[J]. Trends Cell Biol, 2020, 30(9): 695-704. DOI:10.1016/j.tcb.2020.06.003 |
| [26] |
WEN TY, SUN GY, JIANG WX, et al. Histone deacetylases inhibitor chidamide synergizes with humanized PD1 antibody to enhance T-cell chemokine expression and augment Ifn-γ response in NK-T cell lymphoma[J]. EBioMedicine, 2023, 87: 104420. DOI:10.1016/j.ebiom.2022.104420 |
 2025, Vol. 54
2025, Vol. 54