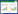文章信息
- 赵斌, 刘继攀, 张丽, 刘亚彬
- ZHAO Bin, LIU Jipan, ZHANG Li, LIU Yabin
- 乳酸激活肿瘤相关巨噬细胞中SOX9-TRAF2信号通路促进结肠癌化疗耐药
- Lactic acid activates the SOX9-TRAF2 signaling pathway in tumor-associated macrophages to promote chemotherapy resistance in colon cancer
- 中国医科大学学报, 2025, 54(7): 595-602
- Journal of China Medical University, 2025, 54(7): 595-602
-
文章历史
- 收稿日期:2024-04-16
- 网络出版时间:2025-07-07 10:16:48
2. 衡水学院化学系,河北 衡水 053010;
3. 河北医科大学第四医院普外二科,石家庄 050011
2. Department of Chemistry, Hengshui University, Hengshui 053010, China;
3. Department of General Surgery, The Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China
结肠癌是全球范围内常见的消化道恶性肿瘤。我国结肠癌发病率和死亡率均位居前列[1]。癌细胞耐药对结肠癌临床治疗的影响日益凸显,不仅降低了化疗药物的治疗效果,还可能加剧不良反应,影响患者的生活质量[2]。研究[3]表明,肿瘤来源的乳酸(lactic acid Lac)对结肠癌进展具有显著影响;缺氧环境下结直肠癌细胞中Lac水平升高,这不仅促进了癌细胞的生长和转移,还促进了肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)M2极化。
SRY盒转录因子9(SRY-box transcription factor 9,SOX9)是一种重要的转录因子,参与多种生理病理调控。近年来研究[4]发现SOX9在肺癌中通过促进细胞干性、迁移和侵袭,以及参与糖酵解过程促进了肺癌进展。肿瘤坏死因子受体相关因子2(tumor necrosis factor receptor-associated factor 2,TRAF2)作为Wnt/β-连环蛋白信号传导的关键调节因子,通过靶向TRAF2能够抑制致癌Wnt/β-连环蛋白信号传导,在结肠癌的发生和进展中起到了重要作用[5]。在抗病毒信号转导中,SOX9通过抑制TRAF2泛素化促进TRAF2的表达[6]。然而,SOX9-TRAF2信号通路在结肠癌中的作用机制尚未明确。本研究探讨Lac激活TAMs中SOX9-TRAF2信号通路对结肠癌化疗耐药的影响。
1 材料与方法 1.1 材料与仪器15只5~6周龄、体重22~22g BALB/c雄性小鼠[赛业(苏州)生物科技有限公司,许可证号SCXK(苏)2022-0016];人结肠癌细胞系SW480、人单核细胞白血病细胞系THP-1、RPMI 1640培养基(武汉普诺赛生命科技有限公司,CL-0223A、CL-0233、PM150110P);5-氟尿嘧啶(5 -fluorouracil,5-FU)、佛波醇-12-十四酸酯-13-乙酸酯(phorbol-12-myristate-13-acetate,PMA)[西格玛奥德里奇(上海)贸易有限公司,F6627、P8139];lipofectamine 3000转染试剂(美国赛默飞世尔科技公司,11668030);si-SOX9质粒(上海吉玛制药技术有限公司);MTT试剂盒、TUNEL试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)、超敏ECL化学发光试剂盒(上海碧云天生物技术股份有限公司,C0009S、C1086、P0009、P0012、FFP19、P0018);MG-132、RIPA裂解液(美国MedChemExpress公司,HY-13259、HY-K1001);LDHA抗体、LAMP2抗体(美国Cell Signaling Technology公司,2012S、34141S);SOX9抗体、TRAF2抗体、GAPDH抗体、山羊抗兔IgG H&L(英国abcam公司,ab26414、ab308019、ab181602、ab6702);人转化生长因子β(human transforming growth factor β,TGF-β)、精氨酸酶1(arginase 1,Arg1)ELISA试剂盒(上海酶联科技生物有限公司,ml064258、ml038176);电泳系统、多功能酶标仪(美国Bio-Rad公司);电子显微镜(日本Olympus公司)。
1.2 方法 1.2.1 生物信息学预测利用GEPIA数据库(http://gepia.cancer-pku.cn/detail.php)预测SOX9在结肠癌中的表达水平以及SOX9和TRAF2在结肠癌中表达的相关性。利用Ubibrowser网站(http://ubibrowser.bio-it.cn/ubibrowser/home/index)预测与SOX9存在泛素化连接关系的分子。
1.2.2 5-FU耐药细胞系建立SW480细胞培养在含有10%FBS+1%P/S的DMEM培养基中,培养条件为5% CO2、37℃。采用梯度暴露法构建结肠癌耐药细胞系(SW480-R)。首先,将SW480细胞暴露于5μmol/L~2 mmol/L递增浓度的5-FU。在初始阶段,向细胞生长培养基中加入低浓度5-FU,随后移除因药物作用而死亡的细胞。然后将存活的细胞培养在不含5-FU的正常培养基中,直至细胞融合达到70%~80%,再次向培养基中加入更高浓度5-FU。重复上述步骤,直至细胞逐渐适应高浓度5-FU环境,建立对5-FU具有耐药性的细胞系。
1.2.3 细胞培养与处理THP-1细胞培养在含有10% FBS、1%P/S、0.05mmol/L β-巯基乙醇的RPMI 1640培养基中,培养条件为95%空气、5%CO2、37℃。在37 ℃条件下,用150nmol/L PMA处理THP-1细胞,持续48 h,诱导M0巨噬细胞。
将M0巨噬细胞与不同浓度(0、5、10、20mmol/L)Lac共同孵育6h,分析Lac对巨噬细胞极化的影响。300 g离心10min收集SW480和SW480-R细胞上清液,进一步以2000 g离心20min获得条件培养基(conditioned medium,CM;SW480-CM、SW480-R-CM)并干预M0巨噬细胞。0、20mmol/LLac处理M0细胞,300 g离心10min收集细胞上清液,进一步以2000 g离心20 min获得对应的CM(0mmol/L Lac-CM、20mmol/L Lac-CM)并干预SW480和SW480-R细胞24h。Lac浓度梯度以及Lac的处理时间参考文献[3]。
1.2.4 细胞转染按照lipofectamine 3000转染试剂说明书将si-SOX9质粒转染至M0巨噬细胞与SW480-R细胞中,转染持续48h。
1.2.5 MTT检测细胞活力根据MTT试剂盒说明书配制浓度为5mg/mL的MTT溶液。随后,在96孔板的每个孔中加入100μL细胞悬液(2000个细胞)。接着向孔中加入经过Lac处理的M0细胞CM,或者不同浓度的5-FU(1、2、3、4mmol/L)。然后向每孔加入100 μL MTT溶液,将培养板放入细胞培养箱中孵育4h。孵育结束后,每孔加入100μL溶解液,混匀孵育直至紫色结晶完全溶解。最后使用酶标仪在570nm波长处测量各孔的吸光度值。
1.2.6 Transwell检测细胞迁移当细胞生长至约80%融合时,将培养基更换为无血清培养基。12h后根据实验分组对细胞进行相应处理,24h后对细胞进行消化和离心。使用无血清培养基悬浮细胞,并调整细胞浓度至5×105/mL。在Transwell上室加入200μL细胞悬液,下室则加入含有10%胎牛血清的培养基。将细胞在培养箱中孵育24h后取出上室,轻轻擦去上室内面未迁移的细胞。接着,使用无水甲醇固定细胞10min,随后用0.1%结晶紫染色。显微镜下随机选择6个视野,拍照并记录细胞迁移情况。以空白对照组的细胞迁移数量作为基准(设为100%),统计并计算各实验组细胞迁移数量的百分比。
1.2.7 His pull-down实验测定泛素化水平His pulldown实验用于验证SOX9对TRAF2的泛素化修饰。首先使用His pull-down裂解缓冲液对转染SOX9过表达质粒的M0巨噬细胞进行裂解,裂解时间2h。之后在裂解物中加入50μL Ni NTA珠并在室温孵育6h。His pull-down缓冲液对珠子进行洗脱,并且借助30 μL 2×SDS缓冲液煮沸,最后进行Western blotting检测。
1.2.8 Western blotting检测收集各组细胞并使用含有蛋白酶和磷酸酶抑制剂的RIPA裂解液进行处理,裂解获得的蛋白样品经过BCA蛋白浓度测定试剂盒测定浓度。随后,将40μg蛋白样本加载到10%SDSPAGE凝胶中,通过电泳分离蛋白质。接着,将分离后的蛋白质从凝胶转移至PVDF膜上。室温下使用5%BSA将膜封闭1~2h。将膜与特异性一抗[LDHA抗体(1 ∶ 1 000)、LAMP2抗体(1 ∶ 1 000)、SOX9抗体(1 ∶ 1 000)、TRAF2抗体(1 ∶ 1 000)、GAPDH抗体(1 ∶ 10 000)] 在新鲜封闭缓冲液中4℃孵育过夜,PBS洗涤去除未结合的一抗。将膜与山羊抗兔IgG H&L(1 ∶ 1 000)室温下孵育1h,使用超敏ECL化学发光试剂盒进行化学发光检测,对目的蛋白进行可视化分析。
1.2.9 ELISA检测TGF-β和Arg1收集各组细胞样品,1000 g离心20min,获得上清液。收集小鼠结肠癌组织,按照1∶9重量体积比加入PBS,使用匀浆器将组织于冰上研磨充分,超声破碎,5000g离心10 min,获得上清液。按照ELISA试剂盒说明书检测上清液中TGF-β和Arg1水平。
1.2.10 异种移植肿瘤模型将15只BALB/c雄性小鼠喂养在无特定病原体(SPF)环境中,模拟12h明暗周期。喂养1周后在小鼠腋窝处皮下注射1×107个SW480细胞诱导异种移植瘤。1周后局部剃毛测量肿瘤体积,小鼠肿瘤体积约为100mm3提示建模成功。然后将小鼠分为对照组(每隔3d腹腔注射与5-FU等体积的生理盐水)、5-FU组(每隔3d腹腔注射25mg/kg的5-FU)、5-FU+Lac组(每隔3d腹腔注射25 mg/kg的5-FU,并同时向肿瘤周围注射20mmol/L Lac),每组5只。
从干预第1天开始,每隔3d测量肿瘤体积(体积=长径/2×短径2),连续治疗3周后静脉注射戊巴比妥钠(15mg/kg)处死小鼠,分离肿瘤组织并称重,用于后续检测。本研究获得河北医科大学第四医院医学伦理委员会批准(批号2021KY174)。
1.2.11 免疫组织化学检测肿瘤组织中SOX9和TRAF2阳性表达收集各组肿瘤组织样本并固定处理,固定后的组织样本切片(厚度4μm)。将组织切片置于二甲苯中脱蜡,梯度乙醇水化后进行常规微波抗原修复、过氧化氢溶液处理切片等步骤,加入特异性SOX9和TRAF2抗体孵育24h。然后加入二抗IgG。DAB显色,苏木精复染,然后使用中性树胶封片并在显微镜下观察染色结果。
1.3 统计学分析使用Graphpad Prism 9.5软件进行统计分析,计量资料采用x±s表示,2组比较采用Student’s t检验,多组比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 SW480-R细胞中Lac代谢相关蛋白表达增加,并促进巨噬细胞M2极化结果显示,经过相同浓度5-FU处理,与SW480细胞相比,SW480-R细胞对5-FU敏感性显著降低,迁移能力明显增强(均P < 0.05),见图 1A~1C。进一步对Lac相关蛋白LDHA和LAMP2检测发现,SW480-R细胞中LDHA和LAMP2表达均较SW480细胞显著增加(均P < 0.05),见图 1D。
|
| A, cell viability; B, C, cell migration (×400); D, protein expressions of LDHA and LAMP2; E, levels of TGF-β and Arg1 by ELISA. **P < 0.01 vs. SW480 group; ##P < 0.01 vs. SW480-CM group. 图 1 W480-R细胞中Lac代谢相关蛋白表达增加,促进巨噬细胞M2极化 Fig.1 The expression of Lac metabolism-related proteins increased in W480-R cells, which promoted the M2 polarization of macrophages |
此外,从SW480和SW480-R细胞中分离CM并干预M0巨噬细胞,结果显示,SW480-R-CM组细胞上清液中TGF-β和Arg1水平明显高于SW480-CM组(均P < 0.05),见图 1E。
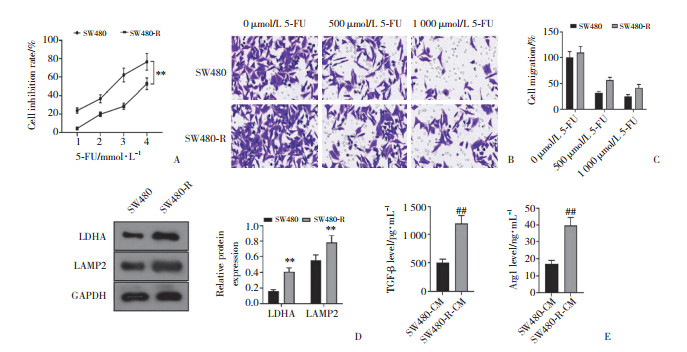
2.2 Lac促进巨噬细胞M2极化并增强SW480-R细胞耐药不同浓度Lac干预M0巨噬细胞后,细胞上清液中TGF-β和Arg1水平明显升高,其中20 mmol/L Lac效果最为显著(均P < 0.05,图 2A)。0、20 mmol/L Lac处理M0巨噬细胞,并收集CM(0 mmol/L Lac-CM、20 mmol/L Lac-CM)干预SW480和SW480-R细胞。结果发现,Lac处理能够增强SW480与SW480-R细胞活力与迁移能力,这些效应在SW480-R细胞中更加显著(均P < 0.05,图 2B、2C)。
|
| A, levels of TGF-β and Arg1 by ELISA; B, cell viability; C, cell migration (×400).*P < 0.05, ***P < 0.001 vs. 0 mmol/L Lac group; #P < 0.05, ##P < 0.01 vs. 0 mmol/L Lac-CM+SW480 group; ΔP < 0.05, ΔΔ P < 0.01 vs. 0 mmol/L Lac-CM+SW480-R group. 图 2 Lac促进巨噬细胞M2极化,并降低SW480和SW480-R细胞对5-FU的敏感性 Fig.2 Lac promoted the M2 polarization of macrophages and decreased the 5-FU sensitivity in SW480 and SW480-R cells |
2.3 Lac促进巨噬细胞中SOX9蛋白表达
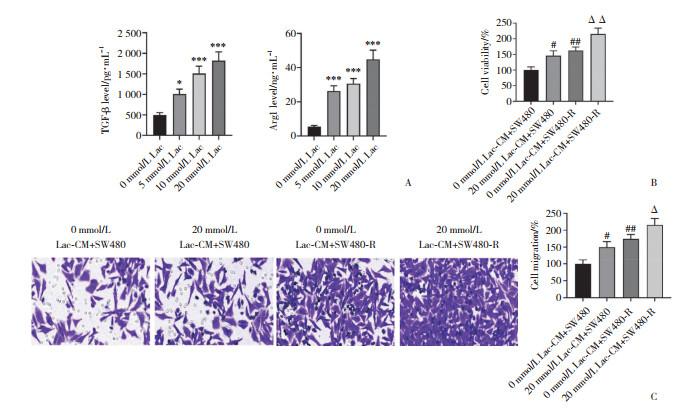
GEPIA数据库预测结果显示,与癌旁正常组织比较,结肠癌组织中SOX9蛋白高表达(P < 0.05,图 3A)。Lac处理的M0巨噬细胞中SOX9蛋白表达检测结果显示,与0 mmol/L Lac组比较,20 mmol/L Lac组SOX9蛋白表达显著增加(P < 0.05,图 3B)。
|
| A, the results in GEPIA database; B, SOX9 protein expression. *P < 0.05; ##P < 0.01 vs. 0 mmol/L Lac group. 图 3 结肠癌组织中SOX9蛋白高表达,Lac促进M0巨噬细胞中SOX9蛋白表达 Fig.3 SOX9 protein was highly expressed in colon cancer tissues, and Lac promoted SOX9 protein expression in M0 macrophages |
2.4 敲减SOX9抑制Lac对SW480-R细胞生物学行为的影响
与0 mmol/L Lac组相比,20 mmol/L Lac干预M0巨噬细胞后TGF-β和Arg1水平升高,然而敲减SOX9后TGF-β和Arg1水平降低(均P < 0.05,图 4A)。进一步分离各组样品CM(0 mmol/L Lac-CM、20 mmol/L Lac-CM、20 mmol/L Lac+si-SOX9-CM)干预SW480-R细胞,检测细胞生物学行为。结果表明,与0 mmol/L Lac-CM组比较,20 mmol/L Lac-CM组SW480-R细胞活力与迁移能力增加;敲减SOX9后细胞活力与迁移能力明显抑制(均P < 0.05,图 4B、4C)。
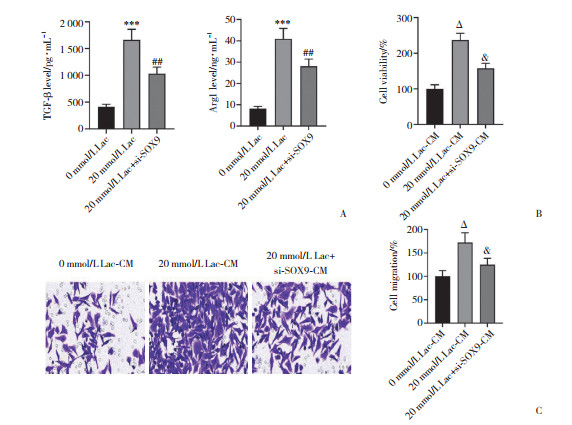
|
| A, levels of TGF-β and Arg1 by ELISA; B, cell viability; C, cell migration (×400). ***P < 0.001 vs. 0 mmol/L Lac group; ##P < 0.01 vs. 20 mmol/L Lac group; ΔP < 0.01 vs. 0 mmol/L Lac-CM group;&P < 0.05 vs. 20 mmol/L Lac-CM group. 图 4 敲减SOX9抑制Lac对SW480-R细胞生物学行为的影响 Fig.4 The effect of knock-down SOX9 to inhibit Lac on the biological behavior of SW480-R cells |
2.5 SOX9表达影响TRAF2泛素化
Ubibrowser网站预测结果显示,SOX9可能与TRAF2泛素化存在关联(图 5A)。GEPIA数据库显示,SOX9和TRAF2在结肠癌中表达呈正相关(图 5B)。Western blotting结果显示,与0 mmol/L Lac组比较,20 mmol/L Lac组TRAF2表达显著增加(P < 0.01;图 5C)。His pull-down结果显示,与加入了TRAF2和His-Ubi抗体的M0巨噬细胞比较,加入了TRAF2、HisUbi以及SOX9抗体后M0巨噬细胞中TRAF2泛素化水平降低(图 5D)。进一步Western blotting结果显示,与0 mmol/L Lac-CM组、20 mmol/L Lac-CM组TRAF2蛋白表达增加,敲减SOX9则TRAF2蛋白表达显著降低(均P < 0.05,图 5E)。
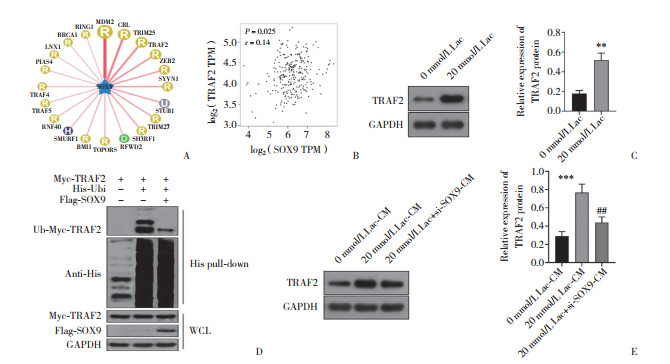
|
| A, the molecules of ubiquitization relationship with SOX9 in the Ubibrowser website; B, correlation between SOX9 and TRAF2 expression in colon cancer in GEPIA website; C, TRAF2 expression between 0 and 20 mmol/L Lac groups; D, ubiquitination modification between SOX9 and TRAF2;E, TRAF2 expression in each group. ** P < 0.01, ***P < 0.001 vs. 0 mmol/L Lac-CM group; ##P < 0.01 vs. 20 mmol/L Lac-CM group. 图 5 Lac干预与敲减SOX9对TRAF2蛋白表达的影响 Fig.5 The effects of Lac intervention and SOX9 knock-down on TRAF2 protein expression |
2.6 Lac抑制5-FU的抗肿瘤作用
结果显示,与对照组相比,5-FU组小鼠成瘤体积较小、重量较轻;肿瘤组织中TGF-β和Arg1水平降低。与5-FU组相比,5-FU+Lac组小鼠成瘤体积与重量增加;TGF-β和Arg1水平升高(均P < 0.05,图 6A、6B)。免疫组织化学检测结果显示,与对照组相比,5-FU组小鼠SOX9与TRAF2阳性表达明显减少;而Lac干预后SOX9与TRAF2阳性表达显著增加(图 6C)。
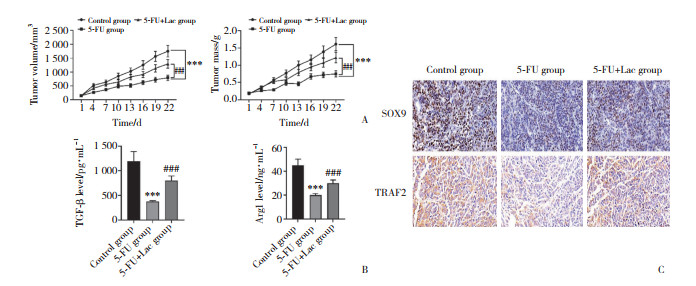
|
| A, tumor volume and tumor mass; B, levels of TGF-β and Arg1 by ELISA; C, positive expression of SOX9 and TRAF2 by immunohisto chemistry (×400). ***P < 0.001 vs. control group; ###P < 0.001 vs. 5-FU group. 图 6 Lac抑制5-FU的抗肿瘤作用 Fig.6 Lac inhibited the anti-tumor effect of 5-FU |
3 讨论
目前,结肠癌的主要治疗策略包括手术、化疗、辅助放疗以及免疫治疗等。然而,由于缺乏针对肿瘤的高效靶向药物,化疗的耐药性使结肠癌患者死亡率居高不下[7-8]。已有研究[9]显示,癌细胞的耐药性对结肠癌的进展具有显著影响,不仅削弱了化疗药物的治疗效果,还促进了疾病的恶化。本研究结果显示,肿瘤来源的Lac可能通过促进巨噬细胞M2极化,并激活SOX9-TRAF2信号通路,从而加剧了结肠癌的化疗耐药性。
以往研究[10]已证实,Lac累积源于细胞的恶性转化和代谢重编程,特别是有氧糖酵解的增强,这种代谢变化不仅促进了肿瘤细胞的增殖,还显著增强了其对化疗药物的耐药性。关于结肠癌的研究[11]也表明,通过调控糖酵解过程和Lac生成,山柰酚能有效逆转结肠癌细胞对5-FU的耐药性,进而提升化疗效果。此外,巨噬细胞极化能够调节肿瘤的免疫微环境,从而影响肿瘤的发展和化疗耐药性,在结直肠癌耐药性中发挥关键作用[12]。在TAMs中,Lac通过AKT/ERK信号通路诱导M2极化,并进一步分泌CCL8,在结直肠癌的发展过程中发挥调节作用[13]。本研究结果显示,SW480-R细胞通过降低化疗敏感性、增强迁移能力和减少凋亡等方式展现出耐药性。同时,Lac产生增加以及Lac相关蛋白表达增加可能影响了巨噬细胞极化,进而促进了肿瘤的生长和耐药性。进一步使用Lac干预的M0巨噬细胞CM处理SW480-R细胞,结果证实了Lac对结肠癌耐药性的促进作用。
SOX9作为一种干细胞相关因子,在顺铂耐药的头颈部鳞状细胞癌细胞中表达水平上升;进一步功能实验提示,通过调节SOX9表达或功能,可能有效抑制癌症干细胞的活性,进而克服癌症的耐药性[14]。在结肠癌领域,SOX9亦扮演关键角色,通过参与代谢重编程及与其他分子的相互作用,推动结肠癌的进展与恶化[15]。作为CS3亚型的特异性标志物,SOX9与结直肠癌的预后和耐药性密切相关[16]。在胃癌中,SOX9与巨噬细胞极化、有氧糖酵解及Lac生成紧密相连,SOX9的激活可促进巨噬细胞M2极化与有氧糖酵解过程,加速胃癌进展与转移[17-18]。以往研究[19]发现调控SOX9表达能够影响巨噬细胞极化。本研究结果进一步证实,Lac通过促进巨噬细胞中SOX9表达,可能诱导巨噬细胞M2极化,最终增强结肠癌细胞的耐药性和侵袭性。因此,通过抑制SOX9表达或阻断Lac/SOX9/巨噬细胞极化通路,可能有助于逆转结肠癌的耐药性,提高治疗效果。
TRAF2在癌症中的作用复杂、多变,其致癌或肿瘤抑制活性取决于癌症类型、微环境及其在信号通路中的具体作用。实体瘤中TRAF2可能通过与其他癌基因的相互作用来促进肿瘤的生长和进展[20];尤其在结肠癌中,TRAF2通过促进Wnt/β-连环蛋白信号传导充当癌基因的角色[21]。有关病毒感染的研究[6]表明,SOX9能够靶向MAVS,抑制MAVS与TRAF2结合,进而可能影响MAVS介导的TRAF2泛素化过程,调控抗病毒信号转导。本研究发现SOX9可能通过调控TRAF2泛素化状态来影响其功能和表达。同时,Lac也可能通过SOX9来调控TRAF2表达和泛素化。推测SOX9可能通过调控MAVS的表达影响MAVS-TRAF2复合体形成,进而改变TRAF2的泛素化状态;Lac通过SOX9调控TRAF2的泛素化,从而影响肿瘤的进展和耐药性。
综上所述,Lac能够增强TAMs中SOX9和TRAF2表达,进而促进结肠癌细胞的化疗耐药性,其作用机制可能是通过激活TAMs中的SOX9-TRAF2信号通路来完成的。本研究为开发新的治疗方法提供了潜在的干预策略:(1)开发特异性阻断SOX9与TRAF2结合的多肽或小分子化合物,可能有效破坏其功能复合体;(2)针对Lac生成的关键酶使用抑制剂,可减少肿瘤微环境中Lac的积累,从而抑制SOX9表达和巨噬细胞极化;(3)通过去泛素化酶抑制剂选择性增强TRAF2的泛素化降解,逆转化疗耐药性。然而,当前研究主要聚焦于Lac对TAMs的影响,而Lac与结肠癌细胞的直接作用关系仍需进一步论证。
| [1] |
史江颖, 毕彩, 纪晓丹, 等. miR-149通过促进线粒体融合诱导结肠癌HT-29细胞的凋亡效应[J]. 中国生物化学与分子生物学报, 2023, 39(1): 121-129. DOI:10.13865/j.cnki.cjbmb.2022.12.1406 |
| [2] |
PANJETA A, KAUR K, SHARMA R, et al. Human intestinal defensin 5 ameliorates the sensitization of colonic cancer cells to 5-fluorouracil[J]. Arch Med Res, 2024, 55(2): 102966. DOI:10.1016/j.arcmed.2024.102966 |
| [3] |
GAO XY, ZHOU SQ, QIN ZF, et al. Upregulation of HMGB1 in tumorassociated macrophages induced by tumor cell-derived lactate further promotes colorectal cancer progression[J]. J Transl Med, 2023, 21(1): 53. DOI:10.1186/s12967-023-03918-w |
| [4] |
YAN F, TENG Y, LI XY, et al. Hypoxia promotes non-small cell lung cancer cell stemness, migration, and invasion via promoting glycolysis by lactylation of SOX9[J]. Cancer Biol Ther, 2024, 25(1): 2304161. DOI:10.1080/15384047.2024.2304161 |
| [5] |
YAN R, ZHU HY, HUANG P, et al. Liquidambaric acid inhibits Wnt/β-catenin signaling and colon cancer via targeting TNF receptor-associated factor 2[J]. Cell Rep, 2022, 38(5): 110319. DOI:10.1016/j.celrep.2022.110319 |
| [6] |
JIANG X, XU LG. SOX9 negatively regulates the RLR antiviral signaling by targeting MAVS[J]. Virus Genes, 2022, 58(2): 122-132. DOI:10.1007/s11262-022-01886-9 |
| [7] |
ZHOU JN, ZHUANG ZQ, GAO R, et al. β-Glycosidase sensitive oral nanoparticles for combined photothermal and chemo treatment of colorectal cancer[J]. J Mater Chem B, 2024, 12(6): 1624-1635. DOI:10.1039/d3tb02393a |
| [8] |
RENDóN-BARRóN MJ, PéREZ-ARTEAGA E, DELGADO-WALDO I, et al. Laherradurin inhibits tumor growth in an azoxymethane/dextran sulfate sodium colorectal cancer model in vivo[J]. Cancers, 2024, 16(3): 573. DOI:10.3390/cancers16030573 |
| [9] |
GUI YP, QIAN XP, DING YX, et al. C-Fos regulated by TMPO/ERK axis promotes 5-FU resistance via inducing NANOG transcription in colon cancer[J]. Cell Death Dis, 2024, 15(1): 61. DOI:10.1038/s41419-024-06451-w |
| [10] |
YAN RC, JI WB, GAO C, et al. SGMS1-AS1/MicroRNA-106a-5p/CPT2 axis as a novel target for regulating lactate metabolism in colon cancer[J]. Technol Cancer Res Treat, 2023, 22: 15330338231212071. DOI:10.1177/15330338231212071 |
| [11] |
WU HL, DU JE, LI CL, et al. Kaempferol can reverse the 5-FU resistance of colorectal cancer cells by inhibiting PKM2-mediated glycolysis[J]. Int J Mol Sci, 2022, 23(7): 3544. DOI:10.3390/ijms23073544 |
| [12] |
DENG ZZ, WU N, SUO QS, et al. Fucoidan, as an immunostimulator promotes M1 macrophage differentiation and enhances the chemotherapeutic sensitivity of capecitabine in colon cancer[J]. Int J Biol Macromol, 2022, 222(Pt A): 562-572. DOI:10.1016/j.ijbiomac.2022.09.201 |
| [13] |
ZHOU H, YAO JY, ZHONG ZZ, et al. Lactate-induced CCL8 in tumor-associated macrophages accelerates the progression of colorectal cancer through the CCL8/CCR5/mTORC1 axis[J]. Cancers, 2023, 15(24): 5795. DOI:10.3390/cancers15245795 |
| [14] |
MURAKAMI K, UMEMURA N, ADACHI M, et al. ABCG2, CD44 and SOX9 are increased with the acquisition of drug resistance and involved in cancer stem cell activities in head and neck squamous cell carcinoma cells[J]. Exp Ther Med, 2022, 24(6): 722. DOI:10.3892/etm.2022.11658 |
| [15] |
LIANG JX, LIU Q, XIA LZ, et al. Rac1 promotes the reprogramming of glucose metabolism and the growth of colon cancer cells through upregulating SOX9[J]. Cancer Sci, 2023, 114(3): 822-836. DOI:10.1111/cas.15652 |
| [16] |
ZHONG CQ, XIE TJ, CHEN L, et al. Immune depletion of the methylated phenotype of colon cancer is closely related to resistance to immune checkpoint inhibitors[J]. Front Immunol, 2022, 13: 983636. DOI:10.3389/fimmu.2022.983636 |
| [17] |
FAN YB, LI Y, YAO XD, et al. Epithelial SOX9 drives progression and metastases of gastric adenocarcinoma by promoting immunosuppressive tumour microenvironment[J]. Gut, 2023, 72(4): 624-637. DOI:10.1136/gutjnl-2021-326581 |
| [18] |
ZHANG YX, WU YJ, SU XB. PLOD1 promotes cell growth and aerobic glycolysis by regulating the SOX9/PI3K/Akt/mTOR signaling pathway in gastric cancer[J]. Front Biosci, 2021, 26(8): 322-334. DOI:10.52586/4946 |
| [19] |
SHENG MW, WENG YQ, CAO YL, et al. Caspase 6/NR4A1/SOX9 signaling axis regulates hepatic inflammation and pyroptosis in ischemia-stressed fatty liver[J]. Cell Death Discov, 2023, 9(1): 106. DOI:10.1038/s41420-023-01396-z |
| [20] |
SIEGMUND D, WAGNER J, WAJANT H. TNF receptor associated factor 2 (TRAF2) signaling in cancer[J]. Cancers, 2022, 14(16): 4055. DOI:10.3390/cancers14164055 |
| [21] |
MASUDA M, UNO Y, OHBAYASHI N, et al. TNIK inhibition abrogates colorectal cancer stemness[J]. Nat Commun, 2016, 7: 12586. DOI:10.1038/ncomms12586 |
 2025, Vol. 54
2025, Vol. 54