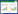文章信息
- 雷燕, 冯春, 邹倩, 董毅, 廉红梅, 杜欣
- LEI Yan, FENG Chun, ZOU Qian, DONG Yi, LIAN Hongmei, DU Xin
- 马钱苷通过调控NFE2L2-FTH1-GPX4影响谷氨酰胺代谢介导的宫颈癌细胞生物学行为
- Effects of loganin on the biological behavior of cervical cancer cells mediated by glutamine metabolism via regulation of the NFE2L2-FTH1-GPX4 pathway
- 中国医科大学学报, 2025, 54(7): 583-589
- Journal of China Medical University, 2025, 54(7): 583-589
-
文章历史
- 收稿日期:2024-06-26
- 网络出版时间:2025-07-07 10:07:58
宫颈癌作为女性生殖系统最常见的恶性肿瘤,严重威胁女性健康[1]。马钱苷(loganin,Log)是山茱萸的药效成分,能够促进宫颈癌细胞凋亡并抑制其增殖[2],但Log能否影响宫颈癌中的谷氨酰胺代谢尚不清楚。谷氨酰胺作为肿瘤细胞的主要能量和生物合成前体,对其快速增殖至关重要[3]。核因子红细胞2相关因子2(nuclear factor red blood cell 2 related factor 2,NFE2L2)作为关键转录因子,可能介导谷氨酰胺代谢,加速肿瘤细胞增殖[3],但是其在宫颈癌中的作用仍有待证实。铁蛋白重链多肽1(ferritin heavy chain 1,FTH1)是铁蛋白的一种亚基,谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)是一种抗氧化酶,两者均是NFE2L2的下游分子,在NFE2L2激活时表达增强[4]。虽然Log能够通过活化NFE2L2抑制炎症和氧化应激[5],但其在癌症中的调控关系尚无报道。本研究旨在深入探讨Log通过NFE2L2-FTH1- GPX4通路对谷氨酰胺代谢的调控及其在宫颈癌进展中的作用。
1 材料与方法 1.1 材料体重12~14 g的4周龄雌性BALB/C小鼠购自湖北省实验动物中心,许可证号:SYXK(鄂)2020-0018;人宫颈癌Hela细胞与C-33A细胞购自广州源井生物科技有限公司;人宫颈癌HT-3细胞、人子宫颈上皮细胞(human cervical epithelial cells,HCECs)购自武汉普诺赛生命科技有限公司;Log购自美国MCE公司;顺铂(cisplatin,DDP)购自齐鲁制药有限公司;基质胶购自翌圣生物科技(上海)股份有限公司;D-hanks液、0.1%结晶紫购自北京兰杰柯科技有限公司;RIPA缓冲液、一步法TUNEL细胞凋亡检测试剂盒(绿色荧光)购自上海碧云天生物技术股份有限公司;4%~12%的Bis-Tris梯度凝胶、PVDF膜、Supersignal West Femto化学发光试剂购自美国赛默飞世尔科技公司;谷氨酰胺酶1(glutaminase 1,GLS1)、谷氨酸脱氢酶1(glutamic dehydrogenase 1,GLUD1)、NFE2L2、FTH1与GPX4抗体购自美国Cell Signaling Technology公司;辣根过氧化物酶偶联的二抗购自英国abcam公司;细胞增殖及细胞毒性检测试剂盒(cell counting Kit-8,CCK-8)、谷氨酸含量检测试剂盒(比色法)购自生工生物工程(上海)股份有限公司;谷氨酰胺含量测定试剂盒(比色法)购自上海雅吉生物科技有限公司;Transwell小室购自美国康宁公司;荧光显微镜购自德国徕卡公司;酶标免疫检测仪购自美国赛默飞世尔科技公司;Chemidoc XRS+成像系统购自北京龙跃生物科技发展有限公司。
1.2 方法 1.2.1 生物信息学分析从美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)的GEO数据库中获取GSE6791、GSE63678、GSE39001数据集,并筛选3个数据库中P < 0.05且|log2FC|>1的宫颈癌差异表达基因,用SwissTargetPrediction(http://www.swisstargetprediction.ch/)、TargetNet(http://targetnet.scbdd.com/)和Prediction(https://prediction.charite.de/)等平台预测Log靶点,结合MsigDB(https://www.gsea-msigdb.org/)及文献[6-8]的谷氨酰胺代谢基因,用Venn网站(http://bioinformatics.psb.ugent.be/)取交集。利用String数据库(https://string-db.org/)分析交集靶点的蛋白质- 蛋白质相互作用(protein-protein interaction,PPI)网络。利用PubChem、Chemdraw和ChemBio 3D获取Log的三维结构,与NFE2L2晶体结构(AutoDock vina处理)对接,选择最低结合能模式,PYMOL可视化Log与NFE2L2相互作用。
1.2.2 细胞培养与分组Hela细胞与C-33A细胞培养于含10%FBS的90%DMEM、90%MEM培养基中,HT-3细胞培养于含有10%FBS、1%P/S、McCoy’s 5A的培养基中,HCECs培养于含FBS、生长添加剂、青霉素、链霉素等的培养基中,置于37 ℃、5%CO2培养箱。将细胞接种至96孔板中(5×103/孔)。过夜后随机分组:空白(Blank)组(仅使用基础培养基,不添加任何药物和溶剂),对照(Ctrl)组(加入与药物处理组浓度一致的DMSO),Log组(Log 10、50、100、200、500 μg/mL),DDP组(DDP 10 μmol/L),TBHQ组(NFE2L2激活剂10 μmol/L),ML385组(NFE2L2抑制剂5 μmol/L)及TBHQ+Log组(TBHQ 10 μmol/L+Log 200 μg/mL),加入含不同药物的培养基继续培养24 h。
1.2.3 细胞增殖活力检测按照CCK-8试剂盒说明书,将各组细胞常规孵育24 h后,向每孔中加入10 μL CCK-8溶液,继续孵育1 h,使用酶标免疫检测仪在450 nm波长下测定各孔吸光度。
1.2.4 细胞凋亡检测按照试剂盒说明书步骤收集各组细胞,PBS洗涤后以4%多聚甲醛固定30 min。加入0.3% Triton X-100孵育5 min,TUNEL检测液孵育1 h,DAPI染细胞核,荧光显微镜下观察绿色荧光即为标记的凋亡细胞。
1.2.5 细胞侵袭检测将基质胶与D-hanks液按1 ∶ 9混合,取20 μL加入Transwell上室,37 ℃孵育4 h。取各组细胞悬液200 μL加入上室,下室加入500 μL含血清培养基,37 ℃培养24 h。4%多聚甲醛固定、0.1% 结晶紫染色,PBS洗涤,显微镜随机选取5个视野计数。
1.2.6 谷氨酰胺与谷氨酸含量测定按照谷氨酰胺及谷氨酸含量测定试剂盒说明书,收集细胞,离心后弃上清,PBS重悬,冰浴超声破碎细胞,再次离心后取上清,测定谷氨酰胺及谷氨酸浓度。
1.2.7 异种移植瘤模型与药物干预24只BALB/C雌性小鼠饲养于SPF级动物房,温度22~26 ℃,湿度40%~60%,遵循12 h光照周期。收集对数生长期的Hela细胞,将其配置成浓度为1×107/mL的细胞悬液,并在小鼠左侧前肢皮下注射(0.2 mL),第7天触及瘤体即为建模成功[9]。将小鼠随机分为4组(每组6只):Model组(等量生理盐水灌胃),Log低、中、高剂量(Log-L、Log-M、Log-H)组(分别灌胃20、50、100 mg/kg Log,1次/d,连续5周)。实验结束后处死小鼠,分离肿瘤组织。
1.2.8 Western blotting收集细胞与小鼠肿瘤组织,用含蛋白酶抑制剂的RIPA缓冲液裂解释放蛋白,提取10 μg蛋白质样品,电泳分离后固定在PVDF膜上,5%脱脂牛奶封闭。PVDF膜与稀释1 000倍的一抗(GLS1、GLUD1、NFE2L2、FTH1、GPX4)4 ℃孵育过夜,加HRP偶联的二级抗体孵育1 h。用化学发光试剂孵育膜,Chemidoc XRS+系统可视化并分析蛋白质条带。
1.2.9 免疫组织化学染色肿瘤标本经10%甲醛室温固定24 h后进行石蜡包埋、切片(4 μm)。切片经脱蜡和再水化,与3% H2O2在甲醇中室温孵育10 min。之后行常规免疫组织化学染色检测,一抗为NFE2L2、FTH1与GPX4,二抗为IgG。DAB显色和苏木精复染后,显微镜下观察。采用ImageJ软件计算平均光密度值,以评价各组肿瘤组织中NFE2L2、FTH1和GPX4阳性表达。
1.3 统计学分析采用GraphPad Prism 8.0软件进行统计分析,计量资料以x±s表示,组间比较采用t检验和单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 Log抑制宫颈癌细胞生长与Ctrl组相比,不同浓度Log和DDP干预能够明显抑制宫颈癌细胞增殖活力(P < 0.05),但对HCECs无明显毒性作用(P > 0.05),见表 1。在200 μg/mL浓度下,Log对Hela细胞活力的抑制效果最为明显,继续使用此浓度的Log干预Hela细胞进行后续实验发现,与Blank组相比,Log组与DDP组细胞侵袭能力明显降低(P < 0.05)、细胞凋亡率明显增加(P < 0.05),见 表 2、图 1。
| Group | n | HCECs | Hela | C-33A | HT-3 |
| Ctrl | 3 | 100.00±11.39 | 100.00±11.51 | 100.00±11.41 | 100.00±11.34 |
| Log 10 μg/mL | 3 | 99.68±11.36 | 62.17±7.091) | 82.85±8.871) | 75.26±8.581) |
| Log 50 μg/mL | 3 | 97.85±11.38 | 59.14±6.741) | 75.04±7.981) | 67.72±7.721) |
| Log 100 μg/mL | 3 | 102.09±11.46 | 56.06±6.391) | 71.13±7.421) | 63.35±7.221) |
| Log 200 μg/mL | 3 | 99.96±11.40 | 50.62±5.771) | 65.07±6.851) | 59.86±6.821) |
| Log 500 μg/mL | 3 | 100.16±11.49 | 55.98±6.381) | 66.87±7.401) | 59.23±6.751) |
| DDP | 3 | 98.91±11.39 | 42.07±4.801) | 49.76±5.671) | 45.71±5.211) |
| 1)P < 0.05 vs. Ctrl group. | |||||
| Group | Number of invading cells | Apoptosis rate(%) |
| Blank | 122.74±13.99 | 4.22±0.85 |
| Log | 82.27±9.381) | 10.13±1.471) |
| DDP | 65.05±7.871) | 16.55±2.261) |
| 1)P < 0.05 vs. Blank group. | ||
|
| 图 1 Log抑制宫颈癌细胞生长并促进其凋亡×400 Fig.1 Log inhibits the growth of cervical cancer cells and promotes their apoptosis ×400 |
2.2 Log抑制宫颈癌细胞的谷氨酰胺代谢
与Blank组相比,Log组与DDP组谷氨酰胺与谷氨酸含量均下降(P < 0.05)、GLS1与GLUD1蛋白表达均减弱(P < 0.05),并且DDP组更显著,见表 3、图 2。
| Group | Glutamine(μg/mL) | Glutamate(μmol/mL) | Relative protein expression of GLS1 | Relative protein expression of GLUD1 |
| Blank | 1 045.3±119.16 | 0.26±0.03 | 0.89±0.11 | 1.25±0.14 |
| Log | 611.73±69.741) | 0.18±0.021) | 0.53±0.071) | 0.81±0.091) |
| DDP | 510.93±58.251) | 0.11±0.021) | 0.41±0.061) | 0.39±0.051) |
| 1)P < 0.05 vs. Blank group. | ||||

|
| 1, Blank group; 2, Log group; 3, DDP group. 图 2 Log抑制GLS1与GLUD1蛋白表达 Fig.2 Log inhibits the expression of GLS1 and GLUD1 proteins |
2.3 Log抑制宫颈癌细胞中NFE2L2的异常表达
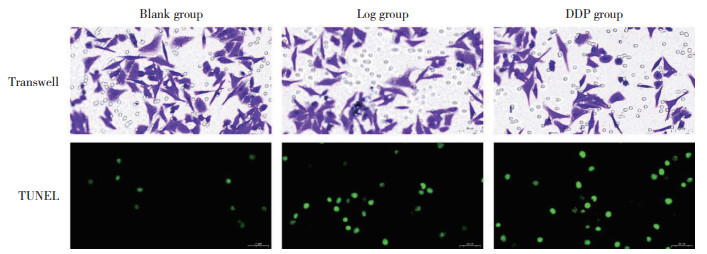
生物信息学分析结果显示,Log、谷氨酰胺代谢与宫颈癌共存在9个靶点蛋白交集,分别为BCL2、PIK3CA、MTOR、AKT3、NFE2L2、JAK2、MET、NOS1、EGLN1。PPI分析结果显示,交互作用最强的5个靶点蛋白分别为BCL2、PIK3CA、MTOR、NFE2L2、AKT3。分子对接结果显示,Log和NFE2L2之间的结合关系最强(结合能为-8.7 kcal/mol)。Western blotting结果显示,与HCECs(0.13±0.01)相比,Hela细胞中NFE2L2蛋白表达明显增强(0.56±0.07,P < 0.05),而Log能够显著抑制NFE2L2表达(0.29±0.03,P < 0.05),见图 3。
|
| 1, HCECs group; 2, Hela group; 3, Hela+Log group. 图 3 Log抑制宫颈癌细胞中NFE2L2的表达 Fig.3 Log inhibits expression of NFE2L2 in cervical cancer cells |
2.4 NFE2L2表达影响宫颈癌细胞生长及谷氨酰胺代谢
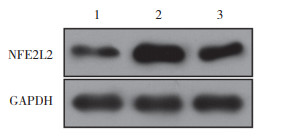
与Ctrl组相比,TBHQ组NFE2L2蛋白表达增加,Hela细胞增殖活力与侵袭能力增加,凋亡细胞率降低,谷氨酰胺与谷氨酸含量升高,GLS1与GLUD1蛋白表达增强(P均 < 0.05);而ML385组NFE2L2蛋白表达减弱,Hela细胞增殖活力与侵袭能力降低,细胞凋亡率增加,谷氨酰胺与谷氨酸含量下调,GLS1与GLUD1蛋白表达降低(P均 < 0.05),见表 4、5,图 4~6。
| Group | Relative protein expression of NFE2L2 | Cell viability(%) | Number of invading cells | Apoptosis rate(%) |
| Ctrl | 0.46±0.05 | 100.00±11.23 | 121.65±13.87 | 6.35±0.84 |
| TBHQ | 1.17±0.211) | 146.83±16.741) | 167.27±17.931) | 3.17±0.461) |
| ML385 | 0.28±0.051) | 58.78±6.021) | 76.72±8.751) | 15.21±2.071) |
| 1)P < 0.05 vs. Ctrl group. | ||||
| Group | Glutamine(μg/mL) | Glutamate(μmol/mL) | Relative protein expression of GLS1 | Relative protein expression of GLUD1 |
| Ctrl | 1 027.23±117.15 | 0.29±0.04 | 0.82±0.11 | 0.49±0.07 |
| TBHQ | 1 514.09±172.611) | 0.42±0.051) | 1.45±0.181) | 1.25±0.161) |
| ML385 | 630.04±71.821) | 0.08±0.011) | 0.69±0.081) | 0.31±0.081) |
| 1)P < 0.05 vs. Ctrl group. | ||||

|
| 1, Ctrl group; 2, TBHQ group; 3, ML385 group. 图 4 Western blotting测定NFE2L2蛋白表达 Fig.4 Western blotting assay for NFE2L2 protein expression |
|
| 图 5 NFE2L2表达与宫颈癌细胞生存相关×400 Fig.5 Correlation between NFE2L2 expression and the survival of cervical cancer cells ×400 |
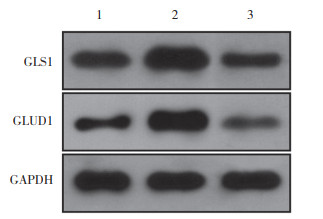
|
| 1, Ctrl group; 2, TBHQ group; 3, ML385 group. 图 6 Western blotting测定GLS1与GLUD1蛋白表达水平 Fig.6 Western blotting analysis of protein expression levels for GLS1 and GLUD1 |
2.5 Log通过靶向NFE2L2抑制FTH1与GPX4表达
Western blotting结果显示,与Ctrl组(0.34±0.04、0.49±0.04、0.45±0.07)相比,Log组NFE2L2、FTH1与GPX4蛋白表达均减弱(0.17±0.02、0.21±0.03、0.24±0.02,P < 0.05);而TBHQ组NFE2L2、FTH1与GPX4蛋白表达均增强(1.12±0.12、0.92±0.10、0.97±0.11,P < 0.05);与TBHQ组相比,Log干预抑制了NFE2L2、FTH1与GPX4的蛋白表达(0.82±0.08、0.65±0.07、0.76±0.04,P < 0.05),见图 7。

|
| 1, Ctrl group; 2, Log group; 3, TBHQ group; 4, TBHQ+Log group. 图 7 Western blotting测定NFE2L2、FTH1与GPX4蛋白表达 Fig.7 Western blotting analysis of NFE2L2, FTH1, and GPX4 protein expression |
2.6 Log抑制移植瘤小鼠宫颈癌进展
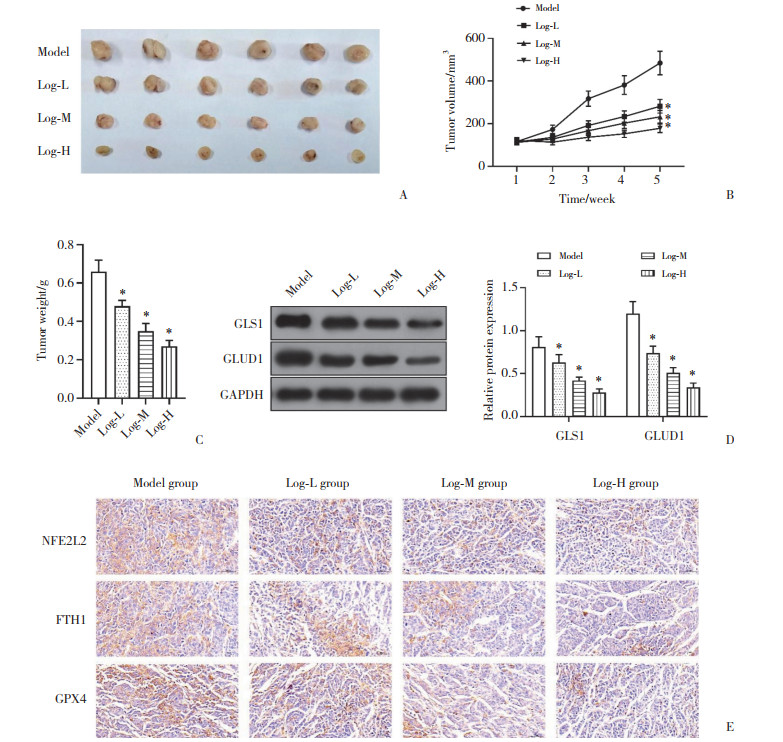
与Model组小鼠相比,Log干预明显抑制了体内成瘤的体积和质量(图 8A~8C)。分离小鼠肿瘤组织并进行Western blotting和免疫组织化学检测,结果显示,与Model组相比,Log-L、Log-M、Log-H组小鼠肿瘤组织中GLS1、GLUD1、NFE2L2、FTH1与GPX4表达均减弱(P < 0.05,图 8D、8E)。
|
| A, tumor images; B, tumor volume; C, tumor weight; D, protein expression levels of GLS1 and GLUD1;E, positive expression of NFE2L2, FTH1, and GPX4(×400). *P < 0.05 vs. Model group. 图 8 Log抑制移植瘤小鼠宫颈癌进展 Fig.8 Loganin inhibits cervical cancer progression in mice with transplanted tumors |
3 讨论
尽管宫颈癌防控取得了一定进展,但其发病率和死亡率仍较高[10]。Log具有一定的抗癌潜力[2]。本研究发现Log能够显著抑制宫颈癌细胞增殖和侵袭,促进其凋亡,并且这一过程可能与抑制NFE2L2- FTH1-GPX4信号通路及影响谷氨酰胺代谢密切相关。
谷氨酰胺代谢在宫颈癌进展中扮演重要角色,影响癌细胞的增殖和代谢[11]。本研究使用不同浓度Log干预宫颈癌细胞,并以DDP作为阳性对照[12],发现Log可能通过抑制宫颈癌细胞增殖、侵袭能力和促进细胞凋亡抑制肿瘤进展。此外,Log能够降低谷氨酰胺和谷氨酸等代谢物的含量,并下调GLS1和GLUD1的表达,发挥抗癌作用。
NFE2L2在宫颈癌进展中发挥关键作用[13],其下游分子FTH1和GPX4与肿瘤细胞中的谷氨酰胺代谢相关[14-15]。本研究结果显示,NFE2L2、FTH1和GPX4在宫颈癌组织和细胞中呈高表达。其中,NFE2L2通过调节下游分子FTH1和GPX4的表达[4],影响宫颈癌细胞的生物学行为。而Log能够抑制NFE2L2的表达,抑制宫颈癌细胞的增殖、侵袭和谷氨酰胺代谢,进而阻碍宫颈癌的进展。
基于体外细胞实验得出的结果,本研究进一步构建异种移植瘤小鼠模型,再次证实了Log对于宫颈癌具有潜在治疗作用,并且其中的作用机制可能与抑制NFE2L2-FTH1-GPX4信号通路和影响谷氨酰胺代谢相关。这一发现可能为宫颈癌的治疗提供新的药物选择和研究方向。但本研究仍存在一定局限性,例如,宫颈癌的治疗通常需要多种药物的联合应用,但Log与其他药物的相互作用和联合应用效果尚未明确。未来可以研究Log与其他抗肿瘤药物的相互作用和联合应用效果,为宫颈癌的治疗提供新的策略。
| [1] |
任敬秦, 周常慧, 刘成清, 等. 基于生物信息学构建宫颈癌预后相关ceRNA网络[J]. 中国医科大学学报, 2024, 53(5): 385-391. DOI:10.12007/j.issn.0258-4646.2024.05.001 |
| [2] |
冯双苗, 张化莲, 袁有华. 马钱苷联合miR-3619-5p靶向迁移侵袭增强因子1对宫颈癌SiHa细胞迁移和凋亡的影响[J]. 中草药, 2022, 53(14): 4409-4416. |
| [3] |
LU WQ, CUI JY, WANG WY, et al. PPIA dictates NRF2 stability to promote lung cancer progression[J]. Nat Commun, 2024, 15(1): 4703. DOI:10.1038/s41467-024-48364-4 |
| [4] |
HUAN RZ, ZHANG JQ, YUE JH, et al. Orexin-a mediates glioblastoma proliferation inhibition by increasing ferroptosis triggered by unstable iron pools and GPX4 depletion[J]. J Cell Mol Med, 2024, 28(9): e18318. DOI:10.1111/jcmm.18318 |
| [5] |
PARK C, LEE H, KWON CY, et al. Loganin inhibits lipopolysaccharide-induced inflammation and oxidative response through the activation of the Nrf2/HO-1 signaling pathway in RAW264.7 macrophages[J]. Biol Pharm Bull, 2021, 44(6): 875-883. DOI:10.1248/bpb.b21-00176 |
| [6] |
YING LQ, CHENG ML, LU Y, et al. Glutamine metabolism scoring predicts prognosis and therapeutic resistance in hepatocellular carcinoma[J]. Pathol Oncol Res, 2021, 27: 1610075. DOI:10.3389/pore.2021.1610075 |
| [7] |
HE SJ, ZHANG S, YAO Y, et al. Turbulence of glutamine metabolism in pan-cancer prognosis and immune microenvironment[J]. Front Oncol, 2022, 12: 1064127. DOI:10.3389/fonc.2022.1064127 |
| [8] |
WU ZX, LI N, GAO Y, et al. Correction: glutamine metabolism-related genes and immunotherapy in nonspecifc orbital infammation were validated using bioinformatics and machine learning[J]. BMC Genom, 2024, 25(1): 224. DOI:10.1186/s12864-024-10105-8 |
| [9] |
罗芳, 高琴, 费志医. 白桦脂醇对宫颈癌小鼠自然杀伤细胞杀伤力及淋巴细胞增殖活性的影响[J]. 中国现代医学杂志, 2022, 32(6): 6-11. DOI:10.3969/j.issn.1005-8982.2022.06.002 |
| [10] |
WU SY, JIAO J, YUE XY, et al. Cervical cancer incidence, mortality, and burden in China: a time-trend analysis and comparison with England and India based on the global burden of disease study 2019[J]. Front Public Health, 2024, 12: 1358433. DOI:10.3389/fpubh.2024.1358433 |
| [11] |
GAO XH, KANG J, LI XK, et al. Deletion of the tyrosine phosphatase Shp2 in cervical cancer cells promotes reprogramming of glutamine metabolism[J]. FASEB J, 2023, 37(4): e22880. DOI:10.1096/fj.202202078RR |
| [12] |
贾莹, 赵伟, 张欣媛, 等. 南蛇藤醇抑制宫颈癌细胞生物学行为的机制研究[J]. 中国临床解剖学杂志, 2020, 38(4): 421-427, 433. DOI:10.13418/j.issn.1001-165x.2020.04.011 |
| [13] |
LEE JW, THUY PX, KOO JH, et al. Nuclear factor(erythroid-derived 2) -like 2 counter-regulates thymosin beta-4 expression and primary Cilium formation for HeLa cervical cancer cell survival[J]. Sci Rep, 2022, 12(1): 20170. DOI:10.1038/s41598-022-24596-6 |
| [14] |
VENKATESWARAN G, MCDONALD PC, CHAFE SC, et al. A carbonic anhydrase IX/SLC1A5 axis regulates glutamine metabolism dependent ferroptosis in hypoxic tumor cells[J]. Mol Cancer Ther, 2023, 22(10): 1228-1242. DOI:10.1158/1535-7163.MCT-23-0041 |
| [15] |
ZHANG Q, ZHOU JX, ZHAI DG, et al. Gut microbiota regulates the ALK5/NOX1 axis by altering glutamine metabolism to inhibit ferroptosis of intrahepatic cholangiocarcinoma cells[J]. Biochim Biophys Acta Mol Basis Dis, 2024, 1870(5): 167152. DOI:10.1016/j.bbadis.2024.167152 |
 2025, Vol. 54
2025, Vol. 54