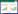文章信息
- 赵智慧, 翟秀丽, 王晶, 马敏, 白香花, 苏楠
- ZHAO Zhihui, ZHAI Xiuli, WANG Jing, MA Min, BAI Xianghua, SU Nan
- Ghrelin介导HO-1/PGC-1α信号通路调节线粒体氧化应激改善大鼠创伤性脑损伤
- Ghrelin-mediated HO-1/PGC-1α signaling pathway regulates mitochondrial oxidative stress to improve traumatic brain injury in rats
- 中国医科大学学报, 2025, 54(4): 351-358
- Journal of China Medical University, 2025, 54(4): 351-358
-
文章历史
- 收稿日期:2024-01-18
- 网络出版时间:2025-04-10 10:51:04
目前,创伤性脑损伤(traumatic brain injury,TBI)是导致创伤患者神经功能障碍和死亡的主要原因[1]。TBI引起神经损伤主要包括原发性损伤和继发性损伤2种类型。原发性损伤一般由爆炸、汽车事故,高处坠落和其他坠落等引起,很少有干预措施可用于原发性损伤[2]。继发性损伤是在原发性损伤的基础上更为复杂和长期的过程,其主要病理机制包括氧化应激、炎症反应和细胞凋亡,最终导致神经元功能障碍和死亡[3]。TBI可引起长期或短期的并发症,造成巨大的经济压力和社会负担。研究[4]表明,氧化应激是TBI后发生继发性损伤的关键因素。因此,探索氧化应激的潜在机制和TBI后的炎症反应,明确神经保护的目标尤为重要。
Ghrelin是一种具有28个氨基酸肽的脑肠激素,在中枢神经系统中发挥多种功能,包括能量稳态、神经保护、学习和记忆、镇痛和抗畏光作用[5-6]。此外,还有研究[7]表明Ghrelin具有抗炎和抗细胞凋亡作用。Ghrelin静脉给药后可通过血脑屏障,并在TBI后通过减少神经元细胞凋亡发挥保护作用;Ghrelin还通过降低丙二醛(malondialdehyde,MDA)水平和增加谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平,表现出抗氧化特性[8]。本研究探讨Ghrelin对大鼠TBI的干预效果及其作用机制,为TBI的治疗提供实验依据。
1 材料与方法 1.1 主要试剂和仪器Ghrelin购自美国Linco Research公司;脑立体定位仪购自深圳市瑞沃德生命科技有限公司;腺病毒(敲减对照)、敲减HMOX1腺病毒购自苏州吉玛基因股份有限公司;HE染色试剂盒购自北京索莱宝科技有限公司;MDA、SOD和GSH-Px酶联免疫吸附试验(enzyme-linked immunoadsordent assay,ELISA)试剂盒,TUNEL细胞凋亡检测试剂盒,RIPA裂解液,BCA蛋白浓度测定试剂盒,SDS-PAGE凝胶快速配制试剂盒和超敏ECL化学发光试剂盒均购自上海碧云天生物技术有限公司;Bcl-2、Bax、β-catenin、caspase-3、caspase-9、Mfn1/2、核呼吸因子1(nuclear respiration factor 1,NRF1)、线粒体转录因子A(mitochondrial transcription factor A,TFAM)和GAPDH抗体购自美国abcam公司;山羊抗兔二抗和荧光二抗购自武汉三鹰生物技术有限公司。
1.2 实验动物来源及分组SPF级雄性SD大鼠50只,体重300~350 g,购自辽宁长生生物技术有限公司,动物许可证号为SCXK(辽)2021-0001。大鼠饲养于内蒙古医科大学实验动物中心,自由饮食饮水,室内温度22~24 ℃,相对湿度50%~60%,光照/光暗10 h/14 h。随机分为假手术(sham)组、TBI组和Ghrelin干预(Ghrelin)组,每组10只。20只Ghrelin干预的TBI大鼠分为Ghrelin+sh-NC组和Ghrelin+sh-HMOX1组,每组10只。
1.3 实验动物处理大鼠造模前禁食8 h,自由饮水。大鼠用1%戊巴比妥钠(0.45 mL/kg)腹腔注射麻醉后保留自主呼吸并采用俯卧位,使用脑立体定位仪固定大鼠,TBI组和Ghrelin组均采用Feeney自由落体撞击法建立TBI模型;sham组大鼠只进行颅骨钻孔,不进行撞击。TBI模型建立主要步骤:大鼠右侧颅顶旁正中切口(长约3 mm),分离皮肤,剥离骨膜,暴露前囟、冠状缝、矢状缝和顶骨。以前囟后1.5 mm处为中心钻孔,蚊式钳扩大骨窗至4 mm,将中心粘有圆柱体(直径3 mm,高4 mm)的硬塑料板(直径1 cm,高5 cm)轻置于顶叶,其中心圆柱体置于骨窗部硬脑膜表面,随后将自由落体装置玻璃管贴紧硬塑料板上方,于垂直上方50 cm高度,将20 g砝码自玻璃管内自由落下撞击塑料板,致伤后棉球轻压止血,然后缝合头皮。Ghrelin组在大鼠造模后30 min经尾静注射Ghrelin(20 μg/kg)。Ghrelin+sh-NC组和Ghrelin+sh-HMOX1组大鼠在Ghrelin(20 μg/kg)干预的同时经尾静脉注射敲减对照(腺病毒2.5×109 pfu)或敲减HMOX1腺病毒(2.5×109 pfu)。本研究已获得医院医学伦理委员会批准[SC-07/01KT2023092]。
1.4 实验方法 1.4.1 HE染色造模后72 h取大鼠脑组织,置于4%多聚甲醛固定,经脱水、浸蜡和包埋后切成石蜡切片(厚5 μm)。按照HE染色试剂盒说明书进行染色,光学显微镜下观察并拍照。
1.4.2 脑水肿测量分别测量各组大鼠新鲜脑组织(湿重)和完全干燥的脑组织(干重),用脑含水量来表示大鼠脑水肿程度。脑含水量(%)=(湿重−干重)/湿重×100。
1.4.3 ELISA取各组大鼠脑组织,剪碎并加入PBS,组织匀浆后离心并收集上清,按照ELISA试剂盒说明书检测组织匀浆中MDA、SOD和GSH-Px水平。
1.4.4 TUNEL实验造模后72 h取大鼠脑组织,常规石蜡包埋后切片(厚4 μm)。使用TUNEL检测试剂盒检测凋亡细胞,操作按照试剂盒说明书进行。首先,石蜡切片在水中脱蜡后与蛋白酶K工作溶液一起孵育进行修复。然后将切片用透化溶液孵育来透化细胞膜,使用TUNEL染色试剂盒的试剂1(TdT)和试剂2(dUTP)的混合物37 ℃孵育切片30 min。最后使用DAPI进行细胞核复染,并用抗荧光淬灭剂固定切片,使用荧光显微镜观察切片并拍照。
1.4.5 Western blotting将大鼠脑组织剪碎后,加入RIPA裂解液提取组织总蛋白,BCA法检测蛋白浓度,SDS-PAGE电泳分离蛋白,将蛋白转移至PVDF膜上,5%脱脂牛奶室温封闭1 h,Bcl-2、Bax、caspase-3、caspase-9、Mfn1/2、NRF1、TFAM、HO-1、PGC-1α和GAPDH一抗4 ℃孵育过夜,PBST洗膜3次,二抗室温孵育1 h,PBST洗膜3次,ECL法发光。采用ImageJ软件分析电泳条带灰度值。以GAPDH为内参,采用目的蛋白与内参蛋白灰度值的比值表示目的蛋白的相对表达量。
1.4.6 免疫荧光检测线粒体活性氧(mitochondrial reactive oxygen species,mtROS)水平取大鼠脑组织石蜡切片,用4%多聚甲醛固定30~60 min,PBS洗涤1次。然后加入含0.1% Trition X-100的PBS,冰浴孵育2 min,PBS洗涤2次。滴加DCFH-DA探针,37 ℃避光孵育20 min,PBS洗涤2次。用抗荧光淬灭封片液封片后在荧光显微镜下观察。
1.5 统计学分析使用GraphPad Prism(9.3.0)软件进行数据分析,计量资料采用x±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析和Tukey检验,P < 0.05为差异有统计学意义。
2 结果 2.1 Ghrelin对TBI大鼠脑组织具有保护作用HE染色结果显示,与sham组相比,TBI组大鼠脑组织部分细胞发生破裂,细胞排列较为紊乱。与TBI组相比,Ghrelin组大鼠脑组织病理变化改善,提示Ghrelin对脑损伤有保护作用。见图 1。
|
| A,sham group;B,TBI group;C,Ghrelin group. 图 1 各组大鼠脑组织HE染色结果×200 Fig.1 Results of the brain tissue of rats in each group by HE staining×200 |
2.2 Ghrelin可改善TBI大鼠脑水肿
sham组、TBI组、Ghrelin组脑含水量分别为(74.01±1.53)%、(85.35±1.50)%、(77.84±1.51)%。与sham组相比,TBI组大鼠出现明显脑水肿(P < 0.05);与TBI组相比,Ghrelin组大鼠脑水肿情况减轻(P < 0.05),提示Ghrelin可改善损伤引起的脑水肿。
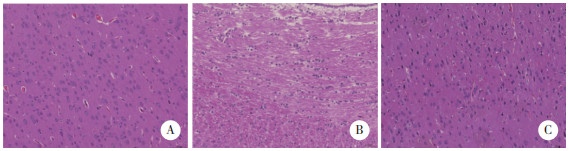
2.3 Ghrelin对TBI大鼠脑组织氧化应激因子水平的影响如图 2所示,与sham组相比,TBI组SOD、GSH-Px水平降低,MDA水平升高(均P < 0.05);与TBI组相比,Ghrelin组SOD、GSH-Px水平升高,MDA水平降低(均P < 0.05),提示Ghrelin具有抗氧化作用。
|
| *P < 0.05 vs. sham group;#P < 0.05 vs. TBI group. 图 2 各组大鼠脑组织氧化应激因子水平比较 Fig.2 Level of oxidative stress factor in the brain tissue of rats in each group |
2.4 Ghrelin对TBI大鼠脑神经元凋亡的影响
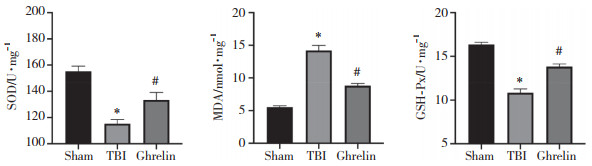
TUNEL染色结果如图 3所示,与sham组相比,TBI组大鼠脑神经元凋亡显著增加;与TBI组相比,Ghrelin组大鼠脑神经元凋亡显著降低。
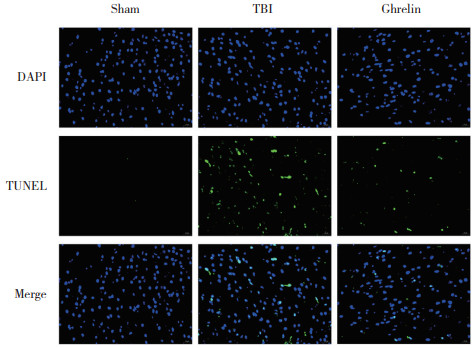
|
| 图 3 各组大鼠脑神经元凋亡情况比较×200 Fig.3 The apoptosis of brain nerve cells of rats in each group×200 |
2.5 Ghrelin对TBI大鼠脑组织细胞凋亡相关蛋白表达的影响
Western blotting检测结果如图 4所示,与sham组相比,TBI组大鼠脑组织Bcl-2蛋白表达水平降低,Bax、caspase-3和caspase-9蛋白表达水平升高(均P < 0.05);与TBI组相比,Ghrelin组大鼠脑组织Bcl-2蛋白表达水平升高,Bax、caspase-3和caspase-9蛋白表达水平降低(均P < 0.05),提示Ghrelin降低脑组织细胞的凋亡。
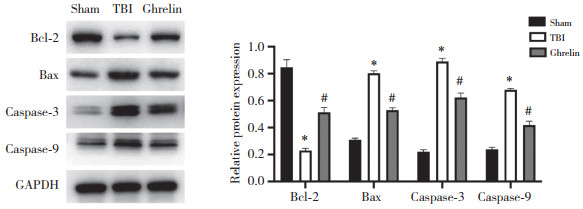
|
| *P < 0.05 vs. sham group;#P < 0.05 vs. TBI group, 图 4 各组大鼠脑组织细胞凋亡相关蛋白的表达水平 Fig.4 Expression levels of apoptosis-related proteins in the brain cells of rats in each group |
2.6 Ghrelin对TBI大鼠脑组织mtROS水平的影响
免疫荧光检测结果如图 5所示,与sham组相比,TBI组大鼠脑组织mtROS水平升高;与TBI组相比,Ghrelin组大鼠脑组织mtROS水平降低,提示Ghrelin具有抗氧化作用。
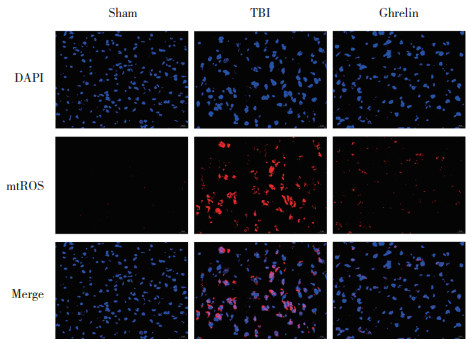
|
| 图 5 各组大鼠脑组织mtROS水平免疫荧光检测结果×200 Fig.5 mtROS levels in brain tissue of rats in each group detected by immunofluorescence×200 |
2.7 Ghrelin对TBI大鼠线粒体功能相关蛋白表达的影响
Western blotting检测结果如图 6所示,与sham组相比,TBI组大鼠脑组织Mfn1/2、NRF1和TFAM蛋白表达水平降低(均P < 0.05);与TBI组相比,Ghrelin组大鼠脑组织Mfn1/2、NRF1和TFAM蛋白表达水平升高(均P < 0.05),提示Ghrelin对线粒体功能具有保护作用。
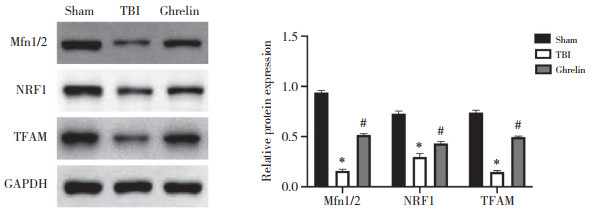
|
| *P < 0.05 vs. sham group;#P < 0.05 vs. TBI group. 图 6 各组大鼠脑组织线粒体功能相关蛋白的表达 Fig.6 Expression of mitochondrial function-related proteins in the brain tissue of rats in each group |
2.8 Ghrelin对TBI大鼠脑组织HO-1/PGC-1α信号通路蛋白表达的影响
Western blotting检测结果如图 7所示,与sham组相比,TBI组大鼠脑组织HO-1、PGC-1α蛋白表达水平升高(均P < 0.05);与TBI组相比,Ghrelin组大鼠脑组织HO-1、PGC-1α蛋白表达水平升高(均P < 0.05)。
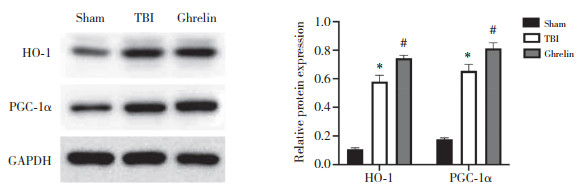
|
| *P < 0.05 vs. sham group;#P < 0.05 vs. TBI group. 图 7 HO-1/PGC-1α信号通路蛋白在各组大鼠脑组织中的表达情况 Fig.7 Expression of HO-1/PGC-1α signaling pathway protein in the brain tissues of rats in each group |
2.9 敲减HMOX1对Ghrelin处理的TBI大鼠脑组织凋亡相关蛋白和氧化应激因子表达的影响
Western blotting检测结果如图 8所示,与Ghrelin+sh-NC组相比,Ghrelin+sh-HMOX1组大鼠脑组织HO-1、PGC-1α和Bcl-2蛋白表达水平降低,Bax、caspase-3和caspase-9蛋白表达水平升高(均P < 0.05)。提示敲减HMOX1逆转了Ghrelin诱导的HO-1/PGC-1α信号通路激活,并逆转其对脑组织细胞凋亡的抑制作用。
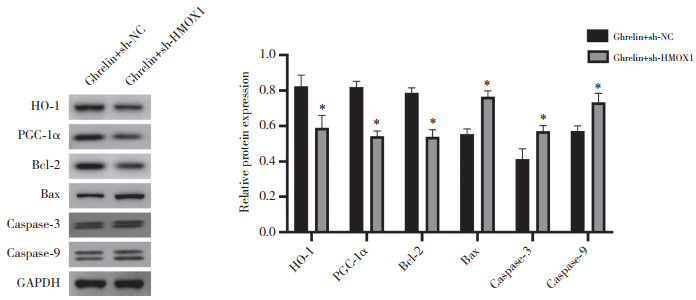
|
| *P < 0.05 vs. Ghrelin+sh-NC group. 图 8 敲减HMOX1对Ghrelin处理的TBI大鼠脑组织凋亡相关蛋白表达的影响 Fig.8 Effect of HMOX1 knockdown on the expression of apoptosis-related proteins in the brain tissue of TBI rats treated by Ghrelin |
ELISA检测结果如图 9所示,与Ghrelin+sh-NC组相比,Ghrelin+sh-HMOX1组大鼠脑组织SOD、GSH-Px水平降低,MDA水平升高(均P < 0.05),提示敲减HMOX1逆转了Ghrelin的抗氧化作用。
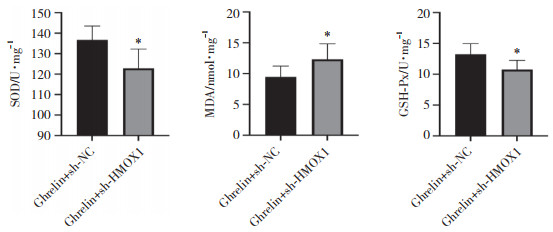
|
| *P < 0.05 vs. Ghrelin+sh-NC group. 图 9 敲减HMOX1对Ghrelin处理的TBI大鼠脑组织氧化应激因子水平的影响 Fig.9 Effect of HMOX1 knockdown on levels of oxidative stress factor in the brain tissue of TBI rats treated by Ghrelin |
3 讨论
TBI通过一系列神经化学和信号变化引起神经功能障碍,发病率和死亡率均较高,是目前较为棘手的问题之一[9]。目前尚无减轻TBI的有效方法,且TBI诱导神经变性的分子机制仍然不清楚。已有研究[8]发现Ghrelin对TBI具有改善作用,Ghrelin可增加TBI大鼠血清GSH、CAT和GSH-Px以及脑组织中GSH和CAT水平,降低血清MDA和IL-1β以及脑组织中MDA、TGF-β1和IL-8水平,抑制脑组织中炎症反应,改善神经元和血管损伤,降低脑组织中GFAP表达[8]。Ghrelin是生长激素促分泌素受体1α(growth hormone secretagogue receptor 1α,GHSR-1α)的独特内源性配体,在大脑中发挥抗凋亡作用[10]。本研究结果显示,Ghrelin可减轻TBI大鼠神经元凋亡。此外,本研究还发现Ghrelin可降低TBI大鼠脑组织中Bax、caspase-3和caspase-9蛋白表达,进一步证明了其对TBI诱导的神经元凋亡的改善作用。
TBI后的继发性脑损伤是涉及氧化应激、钙离子稳态丧失、炎症反应和其他因素的连锁反应[11-12]。氧化应激是TBI病理生理的关键因素之一,可诱导神经功能缺损[13-14]。ROS可诱导脂质过氧化、蛋白质氧化和DNA损伤;在TBI中,升高的ROS发挥着重要作用[4]。MDA水平在TBI后立即升高,且可反映脂质过氧化水平。同时,细胞内抗氧化酶SOD和GSH-Px清除自由基产生的代谢产物,并将脂质过氧化物和过氧化氢转化为无毒化合物。本研究发现Ghrelin干预可降低TBI大鼠脑组织中MDA水平,增加SOD和GSH-Px活性,与以往研究[8]结果一致。此外,本研究还发现Ghrelin干预可降低TBI大鼠脑组织中mtROS水平,并上调Mfn1/2、NRF1和TFAM蛋白表达水平。Mfn1/2参与线粒体融合过程,而NRF1和TFAM在线粒体生物发生中发挥关键作用[15]。这些结果表明Ghrelin对TBI诱导的脑组织中氧化应激的抑制作用可能与改善线粒体功能有关。
越来越多的证据[16-17]表明,激活HO-1/PGC-1α信号通路具有神经保护性抗炎和抗氧化作用。本研究发现Ghrelin可显著增加TBI大鼠脑组织中HO-1和PGC-1α蛋白表达。此外,本研究还发现HO-1的编码基因HMOX1敲减后,Ghrelin干预的TBI大鼠脑组织中Bax、caspase-3、caspase-9表达以及MDA、GSH-Px水平升高,SOD水平降低(均P < 0.05),表明敲减HMOX1逆转了Ghrelin对TBI大鼠脑组织中细胞凋亡的抑制以及抗氧化作用。
综上所述,Ghrelin干预可改善TBI大鼠脑损伤,通过上调HO-1表达改善TBI大鼠脑组织细胞凋亡和氧化应激,其机制可能与诱导HO-1/PGC-1α信号通路激活有关。然而,本研究仅检测了敲减HMOX1对Ghrelin干预的TBI大鼠脑组织凋亡相关蛋白和氧化应激因子表达的影响,Ghrelin是否介导HMOX1影响TBI诱导的脑损伤仍有待进一步验证。
| [1] |
BERGQUIST TF, KEW CL, WISINGER AM. Traumatic brain injury[J]. Neurol Clin, 2024, 42(4): 863-874. DOI:10.1016/j.ncl.2024.05.011 |
| [2] |
EAPEN BC. Assessment, management, and rehabilitation of traumatic brain injury[J]. Phys Med Rehabil Clin N Am, 2024, 35(3): xiii-xxiv. DOI:10.1016/j.pmr.2024.05.002 |
| [3] |
THAPAK P, GOMEZ-PINILLA F. The bioenergetics of traumatic brain injury and its long-term impact for brain plasticity and function[J]. Pharmacol Res, 2024, 208: 107389. DOI:10.1016/j.phrs.2024.107389 |
| [4] |
FESHARAKI-ZADEH A. Oxidative stress in traumatic brain injury[J]. Int J Mol Sci, 2022, 23(21): 13000. DOI:10.3390/ijms232113000 |
| [5] |
GARCIA-RENDUELES MER, VARELA L, HORVATH TL. Ghrelin[J]. Trends Endocrinol Metab, 2024, 35(11): 1021-1022. DOI:10.1016/j.tem.2024.07.002 |
| [6] |
MINGARDI J, MEANTI R, PAOLI C, et al. Ghrelin, neuroinflammation, oxidative stress, and mood disorders: what are the connections?[J]. Curr Neuropharmacol, 2025, 23(2): 172-186. DOI:10.2174/1570159X22999240722095039 |
| [7] |
GROSS JD, ZHOU Y, BARAK LS, et al. Ghrelin receptor signaling in health and disease: a biased view[J]. Trends Endocrinol Metab, 2023, 34(2): 106-118. DOI:10.1016/j.tem.2022.12.001 |
| [8] |
ERGUL ERKEC O, ACIKGOZ E, HUYUT Z, et al. Ghrelin ameliorates neuronal damage, oxidative stress, inflammatory parameters, and GFAP expression in traumatic brain injury[J]. Brain Inj, 2024, 38(7): 514-523. DOI:10.1080/02699052.2024.2324012 |
| [9] |
FESHARAKI-ZADEH A, DATTA D. An overview of preclinical models of traumatic brain injury (TBI): relevance to pathophysiological mechanisms[J]. Front Cell Neurosci, 2024, 18: 1371213. DOI:10.3389/fncel.2024.1371213 |
| [10] |
ZHANG X, ZENG ZH, LIU YN, et al. Emerging relevance of ghrelin in programmed cell death and its application in diseases[J]. Int J Mol Sci, 2023, 24(24): 17254. DOI:10.3390/ijms242417254 |
| [11] |
LIPSKY RH, WITKIN JM, SHAFIQUE H, et al. Traumatic brain injury: molecular biomarkers, genetics, secondary consequences, and medical management[J]. Front Neurosci, 2024, 18: 1446076. DOI:10.3389/fnins.2024.1446076 |
| [12] |
ORR TJ, LESHA E, KRAMER AH, et al. Traumatic brain injury: a comprehensive review of biomechanics and molecular pathophysiology[J]. World Neurosurg, 2024, 185: 74-88. DOI:10.1016/j.wneu.2024.01.084 |
| [13] |
DEAN T, MENDIOLA AS, YAN ZQ, et al. Fibrin promotes oxidative stress and neuronal loss in traumatic brain injury via innate immune activation[J]. J Neuroinflammation, 2024, 21(1): 94. DOI:10.1186/s12974-024-03092-w |
| [14] |
FU J, DU MR, WU BY, et al. CircRNA Itm2b induces oxidative stress via the interaction with Sirt1-Nox4 to aggravate sleep disturbances after traumatic brain injury[J]. Cell Biosci, 2025, 15(1): 21. DOI:10.1186/s13578-025-01353-6 |
| [15] |
LATINO D, VENDITTI M, FALVO S, et al. Steroidogenesis upregulation through mitochondria-associated endoplasmic reticulum membranes and mitochondrial dynamics in rat testes: the role of D-aspartate[J]. Cells, 2024, 13(6): 523. DOI:10.3390/cells13060523 |
| [16] |
SALMAN M, TABASSUM H, PARVEZ S. Tannic acid provides neuroprotective effects against traumatic brain injury through the PGC-1α/Nrf2/HO-1 pathway[J]. Mol Neurobiol, 2020, 57(6): 2870-2885. DOI:10.1007/s12035-020-01924-3 |
| [17] |
KIM M, KIM J, MOON S, et al. Korean red ginseng improves astrocytic mitochondrial function by upregulating HO-1-mediated AMPKα-PGC-1α-ERRα circuit after traumatic brain injury[J]. Int J Mol Sci, 2021, 22(23): 13081. DOI:10.3390/ijms222313081 |
 2025, Vol. 54
2025, Vol. 54