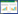文章信息
- 高静, 魏校通, 李星晨, 闫威, 王浩
- GAO Jing, WEI Xiaotong, LI Xingchen, YAN Wei, WANG Hao
- LINC01355通过miR-545-5p/FOXD1信号通路对口腔鳞状细胞癌细胞增殖、凋亡和侵袭的影响
- Effect of LINC01355 on the proliferation, apoptosis, and invasion of oral squamous cell carcinoma cells through miR-545-5p/FOXD1 signaling pathway
- 中国医科大学学报, 2025, 54(3): 238-245
- Journal of China Medical University, 2025, 54(3): 238-245
-
文章历史
- 收稿日期:2024-01-18
- 网络出版时间:2025-3-19 11:51:32
2. 沧州市中心医院 口腔颌面外科,河北 沧州 061000;
3. 沧州市中心医院 皮肤性病科,河北 沧州 061000
2. Department of Oral and Maxillofacial Surgery, Cangzhou Central Hospital, Cangzhou 061000, China;
3. Department of Dermatology and Venereology, Cangzhou Central Hospital, Cangzhou 061000, China
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC) 是常见且死亡率较高的头颈部恶性肿瘤[1-2]。LINC01355是一种长链非编码RNA,在多种癌症中表达失调,发挥致癌作用。敲除LINC01355可增强CD8+T细胞的抗肿瘤活性,并抑制OSCC细胞迁移、侵袭和增殖[3]。miR-545-5p是一种微RNA,其表达下调可逆转由LINC00342沉默引起的胃癌细胞迁移、侵袭和增殖活性的降低[4];过表达miR-545-5p可显著抑制非小细胞肺癌体外增殖及体内肿瘤生长,减轻其迁移、侵袭和上皮-间质转化(epithelial-me- senchymal transition,EMT) [5]。诱导miR-545-5p表达可减弱CD8+T细胞耗竭,进而增强其对OSCC的抗肿瘤作用[6]。叉头盒D1 (forkhead box D1,FOXD1) 属于FOX蛋白家族,已发现其在多种癌症中发挥致癌作用,FOXD1异常高表达与头颈部鳞状细胞癌患者的细胞增殖、细胞迁移和低生存率有关[7];而且高表达FOXD1的头颈部鳞状细胞癌患者的预后比低表达患者差[8],敲除FOXD1-AS1可抑制OSCC细胞的增殖、迁移、侵袭和EMT [9],由此可知LINC01355、miR-545-5p、FOXD1是OSCC治疗的潜在靶点。本研究通过体外培养人OSCC细胞系Cal-27并制备其移植瘤裸鼠模型,探究LINC01355通过miR-545-5p/FOXD1信号通路对OSCC细胞增殖、凋亡和侵袭的影响。
1 材料与方法 1.1 实验动物与细胞SPF级雄性6~7周龄BALB/c-nu裸鼠,体重18~21 g,购自广东药康生物科技有限公司,生产许可证号为SCXK (粤) 2020-0054。人OSCC细胞系Cal-27购自上海钰博生物科技有限公司。
1.2 主要试剂与仪器LINC01355 siRNA、LINC01355 siRNA阴性对照、野生型miR-545-5p (miR-545-5p-wt)、突变型miR-545- 5p (miR-545-5p-mut)、LINC01355过表达质粒、空载质粒、野生型FOXD1 3’-UTR报告质粒(FOXD1-wt)、突变型FOXD1 3’-UTR报告质粒(FOXD1-mut)、miR-545-5p mimics、miR-545-5p阴性对照由广州派真生物技术有限公司构建;总RNA提取试剂(TRIzol)、一步法实时定量PCR试剂盒购自武汉君诺德生物技术有限公司;Annexin V-FITC/PI凋亡试剂盒、增强型细胞活力检测试剂盒(CCK-8)、二步法免疫组织化学试剂盒(兔/小鼠,附DAB显色液)、小鼠源抗人抗Vimentin、E-cadherin一抗购自武汉伊莱瑞特生物科技股份有限公司;双萤光素酶检测试剂盒购自武汉金开瑞生物工程有限公司;兔源抗人抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、C-myc、切割型胱天蛋白酶-3 (cleaved cysteinyl aspartate specific proteases-3,cleaved caspase-3)、GAPDH、BCL-2相关X蛋白(BCL-2-associated X protein,Bax) 与FOXD1一抗、(驴抗兔) 酶标二抗购自美国CST公司。
LightCycler 96 QT-PCR仪购自北京强欣博瑞生物技术有限公司;iBlot 3 Western blotting转印系统、Attune流式细胞仪购自赛默飞世尔科技(中国) 有限公司;ReadMax 1900Plus光吸收全波长酶标仪购自上海闪谱生物科技有限公司。
1.3 实验方法 1.3.1 分组转染Cal-27细胞并构建移植瘤裸鼠模型39.8 ℃水浴中迅速解冻Cal-27细胞,1 000 r/min离心(室温,5 min),RPMI-1640基础培养基清洗,细胞完全培养基重悬混匀后接种在25 cm2培养瓶内,培养至约80%细胞融合,胰酶消化后传代,取第2代Cal-27细胞在24孔板接种培养至对数生长期,随机分为对照组、转染LINC01355 siRNA (si-LINC01355)组、转染LINC01355过表达质粒(pc-LINC01355)组、转染LINC01355 siRNA阴性对照+miR-545-5p阴性对照+空载质粒(si-NC+miR-545-5p-NC+pc-NC)组、转染LINC01355 siRNA+miR-545-5p抑制剂(si-LINC01355+ miR-545-5p inhibitor)组,用脂质体转染试剂按照说明书对实验组细胞进行分组转染。各组细胞均转染24 h,然后收集细胞做后续检测。
参照文献[10]制备Cal-27移植瘤裸鼠模型。转染24 h后各组细胞用胰酶消化,收集细胞以PBS缓冲液清洗、重悬、混匀和计数,制成3×107/mL的单细胞悬液,取200 μL在裸鼠背部右侧靠近腋窝处皮下注射,然后饲养裸鼠7 d并观察注射部位成瘤情况,当皮下出现直径≥5 mm的硬块时,表明Cal-27移植瘤裸鼠模型制备成功。
1.3.2 实时定量PCR检测LINC01355、miR-545-5p及FOXD1表达用TRIzol分别提取转染后的各组细胞总RNA,然后使用一步法实时定量PCR试剂盒进行检测,GAPDH或U6为内参,得到各组细胞LINC01355、GAPDH、miR-545-5p、U6、FOXD1的循环阈值,采用2-ΔΔCt法计算基因的相对表达量。引物序列见表 1。
| Gene | Primer sequence |
| LINC01355 | Forward,5’-GTACAGTGGCATGATCTCAG-3’ |
| Reverse,5’-CTGCTCTAGCCCCTAAAGATAG-3’ | |
| FOXD1 | Forward,5’-GATCTGTGAGTTCATCAGCGGC-3’ |
| Reverse,5’-TGACGAAGCAGTCGTTGAGCGA-3’ | |
| GAPDH | Forward,5’-CGACTATGCAGTGACAGGTTGTG -3’ |
| Reverse,5’-ACGGATTTGGTCGTATTGGGC-3’ | |
| miR-545-5p | Forward,5’-TCAGTAAATGTTTATTAGATGA-3’ |
| Reverse,5’-GTGCAGGGTCCGAGGTATTC-3’ | |
| U6 | Forward,5’-CGCTTCGGCAGCACATATACTA-3’ |
| Reverse,5’-ATGGAACGCTTCACGAATTTGC-3’ |
1.3.3 各组移植瘤体积检测
用标尺测量各组裸鼠移植瘤的最长径(L) 和最短径(W),然后计算体积(V)。V (mm3) =L×W2×0.5。皮下接种28 d后检测各组裸鼠移植瘤体积。
1.3.4 CCK-8法、流式细胞术和Transwell实验分别检测各组细胞增殖、凋亡和侵袭情况 1.3.4.1 CCK-8法取第2代Cal-27细胞在96孔板接种培养至对数生长期,按照1.3.1方法分组转染24 h后用CCK-8试剂处理90 min,按照增强型细胞活力检测试剂盒说明书测量各组细胞吸光度值。增殖活性(%) =实验组细胞吸光度值/对照组细胞吸光度值×100。
1.3.4.2 流式细胞术胰酶消化转染后的各组细胞,然后PBS缓冲液清洗、重悬、计数,制成2×105/mL的单细胞悬液,按照Annexin V-FITC/PI凋亡试剂盒说明书操作,取500 μL加入FITC、PI避光孵育,采用流式细胞仪检测细胞凋亡情况。
1.3.4.3 Transwell实验胰酶消化转染后的各组细胞,然后用不含血清的RPMI-1640基础培养基清洗、重悬、计数,制成2×105/mL的单细胞悬液,取1 mL接种在用基质胶提前包被过的24孔Transwell上室中,当细胞贴壁后向下室加入含10%血清的细胞完全培养基,在恒温培养箱中培养24 h后取出,对下室细胞进行洗涤、固定、结晶紫染色、漂洗处理,显微镜下观察各组侵袭至下室的细胞并计数。
1.3.5 免疫组织化学检测各组细胞EMT相关蛋白表达胰酶消化转染后的各组细胞,PBS缓冲液清洗、重悬、计数,制成2×106/mL的单细胞悬液,取适量滴加到以铬矾明胶提前处理过的载玻片上,然后进行固定、透化、内源性过氧化物酶清除、封闭处理,孵育小鼠源抗人抗Vimentin或E-cadherin一抗,清洗后按二步法免疫组织化学试剂盒说明书孵育二抗、DAB显色,清洗后显微镜下观察各组细胞,并运用ImageJ软件分析各组Vimentin或E-cadherin光密度值。
1.3.6 Western blotting检测细胞增殖、凋亡相关蛋白的表达用RAPI裂解液提取转染后的各组细胞总蛋白,用BCA法测出其浓度后在沸水浴中加热变性,每组取25 μg总蛋白样本进行电泳分离、湿式转印、脱脂牛奶封闭处理,孵育兔源抗人抗PCNA、C-myc、cleaved caspase-3、GAPDH、Bax和FOXD1一抗,清洗后孵育酶标二抗,清洗后进行化学发光显色,采集各组显色后的蛋白条带,运用ImageJ软件计算各组PCNA、C-myc、cleaved caspase-3、Bax和FOXD1相对表达量。
1.3.7 双萤光素酶报告实验验证Cal-27细胞中LINC01355与miR-545-5p、miR-545-5p与FOXD1的靶向关系取第2代Cal-27细胞在24孔板接种培养,待细胞增殖至对数生长期时将miR-545-5p-wt与pc-LINC01355、miR-545-5p-wt与pc-NC、miR-545-5p-mut与pc-LINC01355、miR-545-5p-mut与pc-NC、FOXD1-wt与miR-545-5p mimics、FOXD1-wt与miR-545-5p-NC、FOXD1-mut与miR-545-5p mimics、FOXD1-mut与miR-545-5p-NC分别共转染到Cal-27细胞中,24 h后使用双萤光素酶报告基因检测试剂盒检测各组萤光素酶活性。
1.4 统计学分析利用GraphPad Prism 8.0软件进行统计分析,计量资料采用x±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 各组LINC01355、miR-545-5p及FOXD1 mRNA表达比较结果显示,与对照组比较,si-LINC01355组细胞LINC01355和FOXD1 mRNA表达降低(P < 0.05),miR-545-5p表达升高(P < 0.05);pc-LINC01355组细胞LINC01355和FOXD1 mRNA表达升高(P < 0.05),miR-545-5p表达降低(P < 0.05);si-NC+miR-545-5p-NC+pc-NC组细胞LINC01355、miR-545-5p和FOXD1 mRNA表达无统计学差异(P > 0.05)。与si-LINC01355组相比,si-LINC01355+miR-545-5p inhibitor组细胞LINC01355表达无统计学差异(P > 0.05),miR-545-5p表达降低(P < 0.05),FOXD1 mRNA表达升高(P < 0.05)。见表 2。
| Group | LINC01355 | miR-545-5p | FOXD1 mRNA |
| Control group | 1.01±0.15 | 0.97±0.14 | 1.03±0.19 |
| si-LINC01355 group | 0.30±0.081) | 2.68±0.211) | 0.32±0.091) |
| pc-LINC01355 group | 2.73±0.20 | 0.29±0.081) | 2.61±0.221) |
| si-NC+miR-545-5p-NC+pc-NC group | 1.02±0.12 | 0.96±0.12 | 1.04±0.15 |
| si-LINC01355+miR-545-5p inhibitor group | 0.31±0.09 | 1.03±0.172) | 0.99±0.162) |
| 1) P < 0.05 vs. control group;2) P < 0.05 vs. si-LINC01355 group. | |||
2.2 各组裸鼠移植瘤体积比较
对照组、si-LINC01355组、pc-LINC01355组、si-NC+ miR-545-5p-NC+pc-NC组、si-LINC01355+miR-545-5p inhibitor组裸鼠移植瘤体积分别为(957.85±27.46) mm3、(342.73±23.15) mm3、(1 560.95±34.21) mm3、(970.64±28.61) mm3、(932.94±30.53) mm3。与对照组比较,si-LINC01355组裸鼠移植瘤体积减小(P < 0.05),pc-LINC01355组裸鼠移植瘤体积增大(P < 0.05),si-NC+miR-545-5p-NC+pc-NC组裸鼠移植瘤体积无统计学差异(P > 0.05)。与si-LINC01355组比较,si-LINC01355+miR-545-5p inhibitor组裸鼠移植瘤体积增大(P < 0.05)。
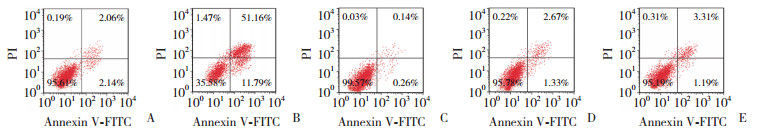
2.3 各组细胞增殖、凋亡和侵袭情况比较结果显示,与对照组比较,si-LINC01355组细胞增殖活性、侵袭数量降低(P < 0.05),凋亡率升高(P < 0.05);pc-LINC01355组细胞增殖活性、侵袭数量升高(P < 0.05),凋亡率降低(P < 0.05);si-NC+miR-545-5p-NC+pc-NC组细胞增殖活性、侵袭数量、凋亡率无统计学差异(P > 0.05)。与si-LINC01355组比较,si-LINC01355+miR-545-5p inhibitor组细胞增殖活性、侵袭数量升高(P < 0.05),凋亡率降低(P < 0.05)。见图 1、2,表 3。
|
| A, control group; B, si-LINC01355 group; C, pc-LINC01355 group; D, si-NC+miR-545-5p-NC+pc-NC group; E, LINC01355+miR-545-5p inhibitor group. 图 1 流式细胞术检测各组Cal-27细胞凋亡情况 Fig.1 Flow cytometry detection of Cal-27 cell apoptosis in each group |
|
| A, control group; B, si-LINC01355 group; C, pc-LINC01355 group; D, si-NC+miR-545-5p-NC+pc-NC group; E, LINC01355+miR-545-5p inhibitor group. 图 2 Transwell实验检测各组Cal-27细胞侵袭情况×200 Fig.2 Invasion of Cal-27 cells in each group using Transwell assay ×200 |
| Group | Proliferation activity (%) | Number of invasion | Apoptosis rate (%) |
| Control | 100.00±0.00 | 290.80±24.30 | 4.01±0.54 |
| si-LINC01355 | 39.98±7.161) | 91.70±18.521) | 61.85±1.671) |
| pc-LINC01355 | 245.63±13.251) | 473.40±28.631) | 0.38±0.121) |
| si-NC+miR-545-5p-NC+pc-NC | 106.14±12.70 | 302.10±23.42 | 3.91±0.48 |
| si-LINC01355+miR-545-5p inhibitor | 94.86±11.902) | 272.30±20.132) | 4.43±0.612) |
| 1) P < 0.05 vs. control group;2) P < 0.05 vs. si-LINC01355 group. | |||
2.4 各组细胞EMT相关蛋白表达比较
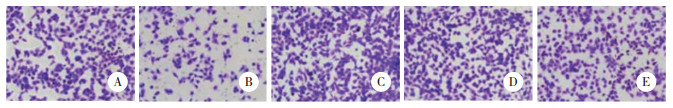
与对照组相比,si-LINC01355组细胞Vimentin蛋白阳性表达减少(P < 0.05),E-cadherin蛋白阳性表达增加(P < 0.05);pc-LINC01355组细胞Vimentin蛋白阳性表达增加(P < 0.05),E-cadherin蛋白阳性表达减少(P < 0.05);si-NC+miR-545-5p-NC+pc-NC组细胞Vimentin、E-cadherin蛋白阳性表达无统计学差异(P > 0.05)。与si-LINC01355组相比,si-LINC01355+ miR-545-5p inhibitor组细胞Vimentin蛋白阳性表达增加(P < 0.05),E-cadherin蛋白阳性表达减少(P < 0.05)。见图 3、表 4。
|
| 图 3 免疫组化染色检测各组Cal-27细胞EMT相关蛋白的表达×200 Fig.3 EMT-related protein expression of Cal-27 cells in each group by immunohistochemical staining ×200 |
| Group | Vimentin | E-cadherin |
| Control | 1.08±0.14 | 0.61±0.11 |
| si-LINC01355 | 0.36±0.101) | 1.13±0.161) |
| pc-LINC01355 | 1.84±0.171) | 0.16±0.051) |
| si-NC+miR-545-5p-NC+pc-NC | 0.37±0.11 | 0.60±0.13 |
| si-LINC01355+miR-545-5p inhibitor | 1.05±0.132) | 0.63±0.102) |
| 1) P < 0.05 vs. control group;2) P < 0.05 vs. si-LINC01355 group. | ||
2.5 各组细胞增殖、凋亡相关蛋白表达比较
结果显示,与对照组比较,si-LINC01355组细胞PCNA、C-myc与FOXD1蛋白表达减少(P < 0.05),cleaved caspase-3与Bax蛋白表达增加(均P < 0.05);pc-LINC01355组细胞PCNA、C-myc与FOXD1蛋白表达增加(均P < 0.05),cleaved caspase-3与Bax蛋白表达减少(P < 0.05);si-NC+miR-545-5p-NC+pc-NC组细胞PCNA、C-myc、cleaved caspase-3、Bax与FOXD1蛋白表达无统计学差异(均P > 0.05)。与si-LINC01355组相比,si-LINC01355+miR-545-5p inhibitor组细胞PCNA、C-myc与FOXD1蛋白表达增加(均P < 0.05),cleaved caspase-3与Bax蛋白表达减少(均P < 0.05)。见图 4、表 5。
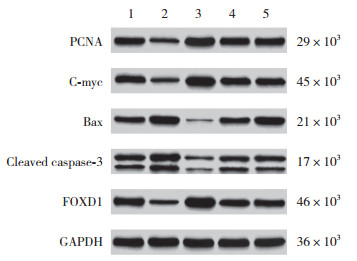
|
| 1, control group; 2, si-LINC01355 group; 3, pc-LINC01355 group; 4, si-NC+miR-545-5p-NC+pc-NC group; 5, si-LINC01355+miR-545-5p inhibitor group. 图 4 Western blotting检测各组细胞增殖、凋亡相关蛋白的表达 Fig.4 The expression of proliferation and apoptosis-related proteins of cells in each group by Western blotting |
| Group | PCNA | C-myc | Cleaved caspase-3 | Bax | FOXD1 |
| Control | 0.65±0.10 | 0.69±0.11 | 0.71±0.12 | 0.58±0.09 | 0.80±0.17 |
| si-LINC01355 | 0.20±0.061) | 0.23±0.071) | 1.20±0.161) | 1.06±0.141) | 0.33±0.101) |
| pc-LINC01355 | 1.12±0.141) | 1.16±0.151) | 0.22±0.071) | 0.10±0.031) | 1.30±0.191) |
| si-NC+miR-545-5p-NC+pc-NC | 0.64±0.12 | 0.70±0.12 | 0.72±0.14 | 0.57±0.10 | 0.81±0.16 |
| si-LINC01355+miR-545-5p inhibitor | 0.63±0.092) | 0.67±0.102) | 0.74±0.152) | 0.60±0.112) | 0.77±0.152) |
| 1) P < 0.05 vs. control group;2) P < 0.05 vs. si-LINC01355 group. | |||||
2.6 Cal-27细胞中LINC01355与miR-545-5p、miR-545-5p与FOXD1的靶向关系验证结果
ENCORI数据库(https://masysu.com/encori/)查询结果显示,LINC01355与miR-545-5p间存在结合位点,miR-545-5p与FOXD1存在结合位点,见图 5。

|
| 图 5 基因结合位点 Fig.5 Gene binding site |
miR-545-5p-wt+pc-NC组、miR-545-5p-wt+pc-LINC01355组、miR-545-5p-mut+pc-NC组、miR-545-5p-mut+pc-LINC01355组的相对萤光素酶活性分别为1.00±0.11、0.26±0.07、0.99±0.10和0.97±0.12。与miR-545-5p-wt+pc-NC组比较,miR-545-5p-wt+pc-LINC01355组相对萤光素酶活性显著降低(P < 0.05);而miR-545-5p-mut+pc-NC组与miR-545-5p-mut+pc-LINC01355组相对萤光素酶活性比较无统计学差异(P > 0.05)。
FOXD1-wt+miR-545-5p-NC组、FOXD1-wt+miR-545-5p mimics组、FOXD1-mut+miR-545-5p-NC组、FOXD1-mut+miR-545-5p mimics组的相对萤光素酶活性分别为1.02±0.14、0.30±0.08、1.03±0.15和1.01± 0.13。与FOXD1-wt+miR-545-5p-NC比较,FOXD1-wt+ miR-545-5p mimics组相对萤光素酶活性显著降低(P < 0.05);而FOXD1-mut+miR-545-5p-NC组与FOXD1-mut+miR-545-5p mimics组相对萤光素酶活性比较无统计学差异(P > 0.05)。
3 讨论OSCC的发病机制复杂,一般认为与吸烟、过量饮酒等有关,手术是OSCC治疗的首选,辅助化疗或放疗可取得较好的治疗效果。然而,大多数晚期患者已发生转移,治疗效果较差。因此,明确OSCC的发病机制,进而寻找更有效的治疗方法尤为重要[11-13]。LINC01355是具有致癌活性的RNA分子,在人类癌症发生和发展中起着重要作用,对肾透明细胞癌具有临床预测价值[14],研究[15]显示LINC01355在胃癌细胞和组织中显著上调,可诱导胃癌细胞增殖,同时抑制细胞凋亡,与患者预后不良相关。本研究结果显示,与对照组比较,si-LINC01355组细胞LINC01355表达下调,细胞增殖活性、侵袭数量,Vimentin蛋白阳性表达,PCNA与C-myc蛋白表达均减少,移植瘤体积缩小;而细胞凋亡率,cleaved caspase-3与Bax蛋白表达,E-cadherin蛋白阳性表达均增加,表明敲低LINC01355可降低OSCC细胞EMT、增殖、侵袭活性并促进凋亡,并且可以抑制移植瘤在裸鼠体内生长,而增强LINC01355表达对OSCC细胞发挥相反的作用,提示LINC01355可能是OSCC的潜在治疗靶点。
miR-545-5p是具有抑癌活性的RNA分子,其表达上调可通过减轻卵巢癌细胞生长和转移而发挥肿瘤抑制作用[16];也可导致骨肉瘤细胞体外增殖、迁移和侵袭、异种移植物体内生长的抑制[17];还可显著降低鼻咽癌细胞增殖、迁移和侵袭,并促进凋亡[18]。研究[6]显示,miR-545-5p表达可显著增强OSCC患者体内分离的肿瘤浸润性CD8+T细胞的抗肿瘤作用。FOXD1在头颈部鳞状细胞癌组织中高表达,敲低FOXD1可促使头颈部鳞状细胞癌细胞衰老与凋亡,并降低其增殖能力[19]。FOXD1表达降低可抑制OSCC细胞自噬,继而发挥抗癌作用[20]。本研究双萤光素酶报告实验结果显示,Cal-27细胞内LINC01355靶向下调miR-545-5p表达,同时miR-545-5p靶向下调FOXD1表达,表明LINC01355可靶向调控miR-545-5p/FOXD1信号通路,从而介导OSCC的发生、发展。将si-LINC01355和miR-545-5p抑制剂联合转染到Cal-27细胞内,可减弱单独转染si-LINC01355对OSCC细胞EMT、增殖、侵袭活性的降低作用,削弱其对OSCC细胞凋亡的促进作用,拮抗其对OSCC移植瘤裸鼠肿瘤生长的抑制作用,最终逆转了对OSCC的抗癌作用,表明敲低LINC01355可减弱OSCC增殖与侵袭,增强其凋亡,可能是通过上调miR-545-5p实现的。
综上所述,LINC01355可通过调节miR-545-5p/ FOXD1信号通路来调控OSCC发生、发展,敲减LINC01355可升高miR-545-5p表达水平而降低FOXD1的表达水平,继而降低OSCC细胞EMT、侵袭、增殖活性,增强其凋亡活性,同时可抑制其异种裸鼠移植瘤生长,最终起到肿瘤抑制作用。本研究为OSCC的临床治疗提供了新的作用靶点,并为明确其发病机制提供了丰富的实验资料。本研究偏重于细胞体外实验,体内研究有限,今后还需进一步研究论证。
| [1] |
DE LA FUENTE C, PRAT-VALERO N, ALBEROLA-FERRANTI M, et al. Occult metastases of oral maxillary squamous cell carcinoma: systematic review and meta-analysis[J]. Head Neck, 2023, 45(3): 733-744. DOI:10.1002/hed.27276 |
| [2] |
MATOS LL, GUIMARÃES YLM, LEITE AK, et al. Management of stageⅢoral cavity squamous cell carcinoma in light of the new staging system: a critical review[J]. Curr Oncol Rep, 2023, 25(2): 107-113. DOI:10.1007/s11912-022-01353-6 |
| [3] |
ZOU C, WU SY, WEI HG, et al. LINC01355 contributes to malignant phenotype of oral squamous cell carcinoma and cytotoxic T cell infiltration via activating Notch signaling pathway[J]. J Immunol Res, 2021, 2021: 1830790. DOI:10.1155/2021/1830790 |
| [4] |
LIU R, YANG XW. LncRNA LINC00342 promotes gastric cancer progression by targeting the miR-545-5p/CNPY2 axis[J]. BMC Cancer, 2021, 21(1): 1163. DOI:10.1186/s12885-021-08829-x |
| [5] |
LIU C, LI QG, ZHOU Y, et al. LncRNA NR2F2-AS1 induces epithelial-mesenchymal transition of non-small cell lung cancer by modulating BVR/ATF-2 pathway via regulating miR-545-5p/c-Met axis[J]. Am J Cancer Res, 2021, 11(10): 4844-4865. |
| [6] |
AI YL, WU SY, GAO H, et al. Repression of CRNDE enhances the anti-tumour activity of CD8 + T cells against oral squamous cell carcinoma through regulating miR-545-5p and TIM-3[J]. J Cell Mol Med, 2021, 25(23): 10857-10868. DOI:10.1111/jcmm.16909 |
| [7] |
PAZHANI J, VEERARAGHAVAN VP, JAYARAMAN S. Transcription factors: a potential therapeutic target in head and neck squamous cell carcinoma[J]. Epigenomics, 2023, 15(2): 57-60. DOI:10.2217/epi-2023-0046 |
| [8] |
JIANG WM, LI YD, LI RY, et al. The prognostic significance of FOXD1 expression in head and neck squamous cell carcinoma[J]. J Pers Med, 2023, 13(3): 530. DOI:10.3390/jpm13030530 |
| [9] |
MA YX, HAN JC, LUO X. FOXD1-AS1 upregulates FOXD1 to promote oral squamous cell carcinoma progression[J]. Oral Dis, 2023, 29(2): 604-614. DOI:10.1111/odi.14002 |
| [10] |
YAO ZX, TU JH, LIU YL, et al. Long non-coding RNA LINC00342 promotes the proliferation, invasion, and migration of primary hepatocellular carcinoma cells by regulating the expression of miRNA-19a-3p, miRNA-545-5p, and miRNA-203a-3p[J]. Biochem Genet, 2024, 62(2): 675-697. DOI:10.1007/s10528-023-10420-x |
| [11] |
BADWELAN M, MUADDI H, AHMED A, et al. Oral squamous cell carcinoma and concomitant primary tumors, what do we know? A review of the literature[J]. Curr Oncol, 2023, 30(4): 3721-3734. DOI:10.3390/curroncol30040283 |
| [12] |
CAREY RM, ANAGNOS VJ, PRASAD A, et al. Nodal metastasis in surgically treated oral cavity squamous cell carcinoma[J]. ORL J Otorhinolaryngol Relat Spec, 2023, 85(6): 348-359. DOI:10.1159/000534491 |
| [13] |
KAMAL MV, RAO M, DAMERLA RR, et al. A mechanistic review of methotrexate and celecoxib as a potential metronomic chemotherapy for oral squamous cell carcinoma[J]. Cancer Invest, 2023, 41(2): 144-154. DOI:10.1080/07357907.2022.2139840 |
| [14] |
WANG G, LIU PH, LI JF, et al. Novel prognosis and therapeutic response model of immune-related lncRNA pairs in clear cell renal cell carcinoma[J]. Vaccines, 2022, 10(7): 1161. DOI:10.3390/vaccines10071161 |
| [15] |
PIAO HY, LIU Y, KANG Y, et al. Hypoxia associated lncRNA HYPAL promotes proliferation of gastric cancer as ceRNA by spon-ging miR-431-5p to upregulate CDK14[J]. Gastric Cancer, 2022, 25(1): 44-63. DOI:10.1007/s10120-021-01213-5 |
| [16] |
SUN PP, BAO AM, HUA XD, et al. RP5-1148A21.3 (lncRP5) exerts oncogenic function in human ovarian carcinoma[J]. Acta Biochim Biophys Sin, 2022, 54(2): 209-219. DOI:10.3724/abbs.2022002 |
| [17] |
ZHOU HZ, CHEN B, LI XJ, et al. MicroRNA-545-5p regulates apoptosis, migration and invasion of osteosarcoma by targeting dimethyladenosine transferase 1[J]. Oncol Lett, 2021, 22(5): 763. DOI:10.3892/ol.2021.13024 |
| [18] |
GE SC, JIANG CY, LI M, et al. Long non-coding RNA CRNDE exacerbates NPC advancement mediated by the miR-545-5p/CCND2 axis[J]. Cancer Cell Int, 2021, 21(1): 650. DOI:10.1186/s12935-021-02348-2 |
| [19] |
WU T, YANG ZY, CHEN WC, et al. MiR-30e-5p-mediated FOXD1 promotes cell proliferation by blocking cellular senescence and apoptosis through p21/CDK2/Rb signaling in head and neck carcinoma[J]. Cell Death Discov, 2023, 9(1): 295. DOI:10.1038/s41420-023-01571-2 |
| [20] |
ALAA EL-DIN Y, SABRY D, H AHMED S, et al. FOXD1-mTOR signaling pathway on oral squamous cell carcinoma and its inhibition by rosemary extract (invitro-study)[J]. Asian Pac J Cancer Prev, 2022, 23(9): 3071-3081. DOI:10.31557/APJCP.2022.23.9.3071 |
 2025, Vol. 54
2025, Vol. 54