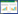文章信息
- 左娜, 陶凯, 唐琪, 于猛
- ZUO Na, TAO Kai, TANG Qi, YU Meng
- 脂肪干细胞源性外泌体对成纤维细胞及烧伤创面愈合的影响
- Effect of adipose-derived stem cell exosome on fibroblasts and wound healing
- 中国医科大学学报, 2025, 54(3): 233-237
- Journal of China Medical University, 2025, 54(3): 233-237
-
文章历史
- 收稿日期:2024-10-12
- 网络出版时间:2025-3-19 11:11:35
全球每年有超过1 100万人烧伤,因其致残或致死者众多[1]。临床上常见的深Ⅱ度及以上烧伤的修复主要依靠成纤维细胞,早期成纤维细胞快速增殖可促进创面愈合,晚期过度增殖却可导致病理性瘢痕形成。脂肪干细胞(adipose-derived stem cell,ADSC) 是脂肪组织内具有自我更新能力及多分化功能的间充质细胞,在人体内含量丰富、获取方便,近年来在再生医学领域获得广泛关注,被誉为最有潜力的干细胞[2]。ADSC主要通过旁分泌机制发挥作用,而外泌体是旁分泌的主要介质[3]。研究[4-5]表明,外泌体参与创面愈合的各个阶段,具有抗炎、促进细胞增殖、迁移、血管生成、抑制瘢痕增生等功能,从而发挥促进创面愈合的作用。本研究探讨了脂肪干细胞源性外泌体(adipose-derived stem cell exosome,ADSC-Exo) 对成纤维细胞增殖及迁移功能的影响,并利用烧伤大鼠模型初步观察了其对创面愈合的影响,为后续ADSC-Exo治疗烧伤创面的机制研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验动物及细胞SD大鼠40只,雄性,8周龄,体重220~240 g,购自辽宁长生生物技术股份有限公司。人皮肤成纤维细胞(human skin fibroblast,HSF) 购自河南省工业微生物菌种工程技术研究中心。ADSC-Exo购自沈阳细胞中心。
1.1.2 主要试剂及耗材戊巴比妥购自美国Sigma- Aldrich公司,胎牛血清购自天津灏洋华科生物科技有限公司,原代成纤维细胞培养基购自河南省工业微生物菌种工程技术研究中心,CCK-8试剂盒购自北京兰杰柯科技有限公司,CD31抗体购自江苏亲科生物研究中心有限公司。本研究获得我院实验动物伦理委员会批准。
1.2 方法 1.2.1 HSF培养HSF复苏后培养于37 ℃、5%CO2培养箱,待细胞80%融合时,根据细胞量进行1∶2~ 1∶3比例传代。
1.2.2 CCK-8实验将HSF接种于96孔板(2×103/孔),加入培养基(100 μL/孔) 培养。待细胞贴壁后,弃去原培养基,分为3组。25 μg/mL Exo组每孔加入含25 μg/mL ADSC-Exo的培养基100 μL,50 μg/mL Exo组每孔加入含50 μg/mL ADSC-Exo的培养基100 μL,对照组仅加入100 μL培养基。孵育0、24、48、72 h后分别向各组细胞加入CCK-8溶液(10 μL /孔),置于37 ℃、5%CO2培养箱中培养2 h,用酶标仪检测450 nm处的吸光值。
1.2.3 划痕实验将HSF接种于6孔板(5×105/孔),并分为实验组和对照组。待细胞融合达到80%以上时,弃去培养基,以200 μL移液器枪头在6孔板正中垂直划线。用无菌PBS溶液冲洗脱落细胞,实验组加入含ADSC-Exo (50 μg/mL,0.5 mL) 的无血清培养基,对照组加入等量无血清培养基。在划痕即刻(0 h)、24 h及48 h时光学显微镜下观察并拍照。通过ImageJ软件计算迁移率。迁移率(%) = (0 h划痕宽度-24 h或48 h划痕宽度) /0 h划痕宽度×100。
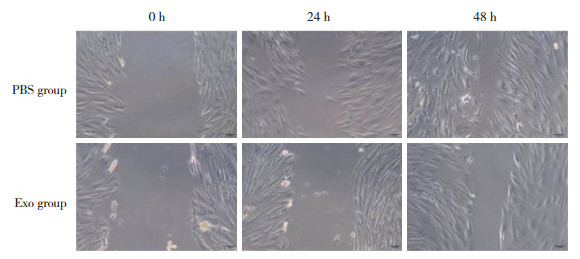
1.2.4 动物实验将大鼠分为Exo组和PBS组,实验前禁食水8 h,以1%戊巴比妥(50 mg/kg) 腹腔注射麻醉。剃除大鼠背部毛发,涂抹硫化钠彻底去除背部毛发。次日以戊巴比妥麻醉大鼠,应用砝码烫伤法造模[6]。将50 g砝码放入水浴锅中加热至沸腾,用镊子取出砝码并置于大鼠背部脱毛区15 s,不加压,造成直径约2 cm深Ⅱ度烧伤创面。于创面周边0点、3点、6点、9点4个方位,Exo组注射含100 μg ADSC-Exo的PBS 2 mL,PBS组注射等量PBS。于烧伤后7、14、21 d拍照记录创面情况。
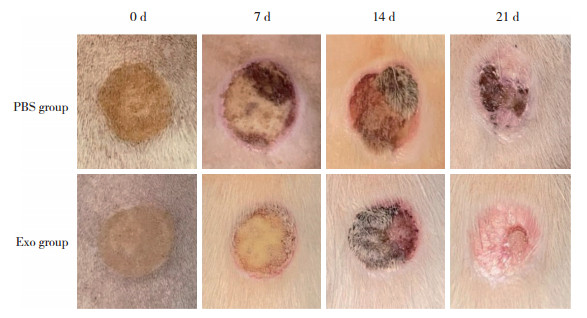
1.2.5 HE染色于烧伤后7 d取2组大鼠创面组织进行病理学检查。用4%多聚甲醛固定样本,经过脱水、包埋后制成5 μm厚切片,进行HE染色,光学显微镜下观察。
1.2.6 免疫组织化学染色取石蜡切片脱蜡、脱水、抗原修复,室温冷却后阻断内源性过氧化物酶,血清封闭30 min。加入CD31一抗,4 ℃过夜,PBS洗涤后,加入二抗孵育50 min,DAB染色。光学显微镜下随机选取5个视野计算CD31阳性血管数。
1.3 统计学分析采用ImageJ和GraphPad Prism 10.0软件完成数据分析,计量资料以x±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 ADSC-Exo促进HSF增殖CCK-8实验结果(表 1) 显示,与PBS组相比,Exo组HSF增殖能力明显增加,且50 μg/mL Exo组HSF增殖能力高于25 μg/mL Exo组,差异有统计学意义(P < 0.05)。说明ADSC-Exo能促进HSF增殖,且具有浓度依赖性。将50 μg/mL的ADSC-Exo用于后续实验。
| Group | 0 h | 24 h | 48 h | 72 h |
| PBS | 0.70±0.02 | 0.95±0.60 | 1.24±0.14 | 1.54±0.60 |
| 25 μg/mL Exo | 0.71±0.23 | 1.14± 0.581) | 1.43± 0.061) | 1.78± 0.622) |
| 50 μg/mL Exo | 0.73±0.60 | 1.31± 0.783), 4) | 1.72± 0.653), 5) | 1.93± 0.603), 4) |
| 1) P < 0.01,2) P < 0.001,3) P < 0.000 1 vs. PBS group;4) P < 0.05,5) P < 0.000 1 vs. 25 μg/mL Exo group. | ||||
2.2 ADSC-Exo促进HSF迁移
划痕实验结果(图 1) 显示,实验组24 h及48 h时细胞迁移率(24 h,43.82%±3.97%;48 h,73.48%± 2.22%) 明显高于对照组(24 h,24.26%±1.28%;48 h,57.18%±1.52%),差异均有统计学意义(P < 0.000 1)。
|
| 图 1 ADSC-Exo促进成纤维细胞迁移×40 Fig.1 ADSC-Exo promotes fibroblast migration ×40 |
2.3 ADSC-Exo对烧伤创面愈合的影响
观察不同时间点大鼠烧伤创面愈合情况,结果显示,Exo组创面愈合速度较快,而PBS组创面愈合较慢,烧伤后14、21 d时比较差异有统计学意义(P < 0.01)。见图 2、表 2。
|
| 图 2 ADSC-Exo促进烧伤创面愈合 Fig.2 ADSC-Exo promotes burn wound healing |
| Group | 7 d after burn | 14 d after burn | 21 d after burn |
| PBS | 16.25±3.54 | 45.29±4.34 | 69.80±3.50 |
| Exo | 20.64±3.06 | 70.92±2.02 | 91.28±3.49 |
| P | 0.180 | 0.001 | 0.002 |
2.4 病理结果分析
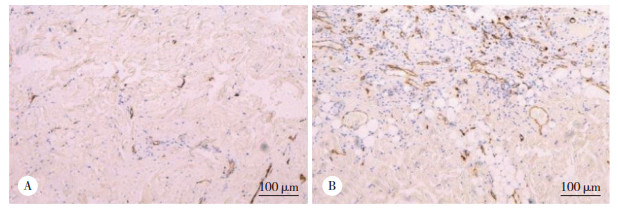
HE染色结果显示,Exo组炎症细胞浸润明显少于PBS组,说明ADSC-Exo能够减轻烧伤创面炎症细胞浸润。见图 3。
|
| A, PBS group; B, Exo group. Scale bar =100 μm. 图 3 2组大鼠背部深Ⅱ度烧伤后7 d创面组织HE染色结果 Fig.3 Results of HE staining on the wound tissue 7 d after deep Ⅱ degree burn on the back of rats in 2 groups |
免疫组织化学染色结果显示,大鼠背部深Ⅱ度烧伤后14 d时,Exo组创面组织中CD31阳性血管数量(62.00±14.00) 较PBS组(22.00±5.29) 明显增多,差异有统计学意义(P < 0.01),表明ADSC-Exo能促进烧伤创面血管生成。见图 4。
|
| 图 4 2组大鼠背部深Ⅱ度烧伤后14 d时CD31免疫组织化学染色结果 Fig.4 Results of CD31 immunohistochemical staining 14 d after deep Ⅱ degree burn on the back of rats in 2 groups |
3 讨论
大面积烧伤往往存在感染、脓毒血症,严重时可致死。目前,烧伤的主要治疗方法为手术清创、异种异体生物敷料临时覆盖、自体皮移植、生长因子促进创面愈合等,存在治疗过程长、换药痛苦、供皮区副损伤、治疗费用昂贵等弊端,因此,探讨如何减轻炎症、加速创面愈合、减少愈后瘢痕至关重要。
外泌体可由多种细胞分泌,存在于多种体液中,含有多种核酸及蛋白质,能够透过细胞膜在细胞间传递信息。外泌体既具备母细胞的功能,又不诱发免疫排斥反应,在创面修复方面拥有广阔的应用前景[7]。研究[8-9]证明,ADSC-Exo具有调控成纤维细胞及促进创面愈合的功能。本研究通过应用不同浓度ADSC-Exo干预HSF后发现,ADSC-Exo可明显促进细胞增殖,并且随着浓度增加,增殖速度呈上升趋势,说明ADSC-Exo具有促进成纤维细胞增殖的作用,且具有浓度依赖性。本研究还通过划痕实验发现实验组细胞迁移率明显高于对照组,提示ADSC-Exo具有促进细胞迁移的作用。
在调控创面愈合方面,沈括等[10]通过构建小鼠全层皮肤损伤模型,应用ADSC-Exo作用于创面,发现其能减少促炎性细胞因子分泌,促进血管新生,从而促进创面愈合。FRANCK等 [11]通过观察烧伤后瘢痕大小、胶原沉积、炎症细胞浸润、淋巴管等量化指标评估脂肪干细胞对烧伤创面愈合的影响,发现脂肪干细胞组瘢痕面积减小,Ⅲ型胶原沉积增加,淋巴管数量减少。本研究通过对大鼠烧伤创面周围皮下注射ADSC-Exo溶液或PBS溶液,结果发现,Exo组创面愈合时间较PBS组显著缩短,提示局部注射ADSC-Exo可提高创面愈合速度。
根据损伤程度及血流变化,烧伤后创面可分为凝固坏死区、淤滞区和充血区3个区域,伤后48~72 h内淤滞区可因炎症刺激、缺血缺氧等转化为坏死区,早期予以相应处置则可能改善预后[12]。烧伤后早期即出现炎症反应,严重时可出现全身炎症反应综合征,危及生命。因此,减轻炎症反应可对烧伤创面愈合及患者整体预后起积极作用。本研究中,HE染色结果显示,Exo组创面组织中炎症细胞浸润明显少于对照组,提示ADSC-Exo能够减轻炎症反应。
创面愈合是一个高代谢过程,新生血管生成的增加至关重要。充足的血液供应为创面提供了营养、氧气和细胞迁移的途径[13]。HOANG等 [14]发现,ADSC-Exo可分泌介导创面愈合的血管内皮生长因子A和血小板衍生生长因子BB等关键细胞因子,在血管再生中发挥重要作用。CD31是内皮细胞上最丰富的受体糖蛋白,在血管生成中起重要作用。CHEN等 [15]发现,ADSC-Exo注射于小鼠全层缺损创面周围后,免疫组织化学染色结果显示CD31表达增加。本研究中,Exo组烧伤大鼠创面组织中CD31表达增加,说明Exo组血管生成增加,提示ADSC-Exo可能通过促进血管新生加快创面愈合速度。
综上所述,ADSC-Exo可促进成纤维细胞增殖、迁移,同时可减轻创面炎症、促进新生血管生成,从而促进烧伤创面愈合。但ADSC-Exo成分复杂,含有多种微RNA、核酸、蛋白质等,具体的调控机制有待在后续研究中深入探讨。
| [1] |
JESCHKE MG, VAN BAAR ME, CHOUDHRY MA, et al. Burn injury[J]. Nat Rev Dis Primers, 2020, 6(1): 11. DOI:10.1038/s41572-020-0145-5 |
| [2] |
SHUKLA L, YUAN YN, SHAYAN R, et al. Fat therapeutics: the clinical capacity of adipose-derived stem cells and exosomes for human disease and tissue regeneration[J]. Front Pharmacol, 2020, 11: 158. DOI:10.3389/fphar.2020.00158 |
| [3] |
HEO JS, KIM S, YANG CE, et al. Human adipose mesenchymal stem cell-derived exosomes: a key player in wound healing[J]. Tissue Eng Regen Med, 2021, 18(4): 537-548. DOI:10.1007/s13770-020-00316-x |
| [4] |
HAN YD, REN J, BAI Y, et al. Exosomes from hypoxia-treated human adipose-derived mesenchymal stem cells enhance angiogenesis through VEGF/VEGF-R[J]. Int J Biochem Cell Biol, 2019, 109: 59-68. DOI:10.1016/j.biocel.2019.01.017 |
| [5] |
YANG YL, ZHANG JN, WU SW, et al. Exosome/antimicrobial peptide laden hydrogel wound dressings promote scarless wound healing through miR-21-5p-mediated multiple functions[J]. Biomaterials, 2024, 308: 122558. DOI:10.1016/j.biomaterials.2024.122558 |
| [6] |
丁毅, 吾拉尔·阿德力, 李敏, 等. 一种简便的大鼠Ⅱ度烫伤模型制备方法[J]. 临床与病理杂志, 2021, 41(3): 517-522. DOI:10.3978/j.issn.2095-6959.2021.03.004 |
| [7] |
符雪, 李俊亮, 徐洋, 等. 干细胞来源外泌体在烧伤创面修复中的研究进展[J]. 中华损伤与修复杂志(电子版), 2020, 15(6): 502-505. DOI:10.3877/cma.j.issn.1673-9450.2020.06.015 |
| [8] |
QIU H, LIU S, WU KL, et al. Prospective application of exosomes derived from adipose-derived stem cells in skin wound healing: a review[J]. J Cosmet Dermatol, 2020, 19(3): 574-581. DOI:10.1111/jocd.13215 |
| [9] |
JOORABLOO A, LIU TQ. Engineering exosome-based biomimetic nanovehicles for wound healing[J]. J Control Release, 2023, 356: 463-480. DOI:10.1016/j.jconrel.2023.03.013 |
| [10] |
沈括, 王许杰, 刘开拓, 等. 人脂肪间充质干细胞外泌体对小鼠RAW264.7细胞的炎症反应和小鼠全层皮肤缺损创面愈合的影响[J]. 中华烧伤与创面修复杂志, 2022, 38(3): 215-226. DOI:10.3760/cma.j.cn501120-20201116-00477 |
| [11] |
FRANCK CL, SENEGAGLIA AC, LEITE LMB, et al. Influence of adipose tissue-derived stem cells on the burn wound healing process[J]. Stem Cells Int, 2019, 2019: 2340725. DOI:10.1155/2019/2340725 |
| [12] |
BARRERA JA, TROTSYUK AA, MAAN ZN, et al. Adipose-derived stromal cells seeded in pullulan-collagen hydrogels improve healing in murine burns[J]. Tissue Eng Part A, 2021, 27(11/12): 844-856. DOI:10.1089/ten.TEA.2020.0320 |
| [13] |
马元, 庄雪莹, 陈旭. 间充质干细胞外泌体调控血管生成机制的研究进展[J]. 中国医科大学学报, 2021, 50(10): 944-947. DOI:10.12007/j.issn.0258-4646.2021.10.016 |
| [14] |
HOANG DH, NGUYEN TD, NGUYEN HP, et al. Differential wound healing capacity of mesenchymal stem cell-derived exosomes ori- ginated from bone marrow, adipose tissue and umbilical cord under serum- and xeno-free condition[J]. Front Mol Biosci, 2020, 7: 119. DOI:10.3389/fmolb.2020.00119 |
| [15] |
CHEN MD G, MD YW, ZOU MD L, et al. Effect of microRNA-146a modified adipose-derived stem cell exosomes on rat back wound healing[J]. Int J Low Extrem Wounds, 2023, 22(4): 704-712. DOI:10.1177/15347346211038092 |
 2025, Vol. 54
2025, Vol. 54