文章信息
- 朱洋洋, 刘梦, 杨道迪, 胡依依, 方敬献
- ZHU Yangyang, LIU Meng, YANG Daodi, HU Yiyi, FANG Jingxian
- Notch1蛋白调控的小胶质细胞极化对小鼠癫痫发作的保护作用
- Protective effect of Notch1-regulated microglial polarization against epileptic seizure in mice
- 中国医科大学学报, 2025, 54(3): 228-232
- Journal of China Medical University, 2025, 54(3): 228-232
-
文章历史
- 收稿日期:2024-03-19
- 网络出版时间:2025-3-19 14:23:15
2. 郑州大学医学院基础医学院病理生理学教研室,郑州 450001
2. Department of Pathophysiology, School of Basic Medicine, School of Medicine of Zhengzhou University, Zhengzhou 450001, China
颞叶癫痫是一种神经系统疾病,全球患病率约为1%[1]。然而,癫痫的发作机制不明,约30%的颞叶癫痫患者存在抗癫痫药物抵抗[2]。因此,癫痫的发作机制以及更多的治疗靶点有待进一步研究。小胶质细胞是中枢神经系统中动态调控的免疫细胞,在癫痫治疗中受到越来越多的关注。研究[3]显示,颞叶癫痫模型构建后3 d内,前额皮层中M1型和M2型小胶质细胞标志物表达不断增加,之后M1型和M2型小胶质细胞比例不断变化,M1型小胶质细胞逐渐增加,而M2型小胶质细胞逐渐减少。然而,M1型和M2型小胶质细胞极化相关的分子机制尚未完全阐明。
Notch1及其配体Jagged1在小胶质细胞中高度表达,与下游基因一同调控小胶质细胞激活、极化和炎症诱导[4]。在大脑钝性挫伤模型中,Notch1蛋白表达和小胶质细胞活化程度协同升高[5]。此外,研究[5-6]发现,Notch1能够通过调控M1型和M2型小胶质细胞极化,减轻缺血性卒中神经功能损伤。然而,Notch1调控的小胶质细胞激活和表型极化对癫痫的影响尚不清楚。本研究通过多种癫痫点燃模型,探究Notch1蛋白高表达对戊四唑(pentylenetetrazole,PTZ)点燃癫痫发作进程的影响,为Notch1靶点药物的开发提供依据。
1 材料与方法 1.1 材料PTZ,购自美国Sigma-Altrich公司;兔抗鼠离子钙结合适配器分子1 (ionized calcium-binding adapter molecule 1,Iba1) 蛋白抗体、大鼠抗小鼠CD16蛋白抗体、大鼠抗小鼠精氨酸酶1 (arginase-1,Arg1) 蛋白抗体,购自英国abcam公司;生物胞素Alexa Fluor 488标记羊抗兔二抗和菁类荧光染料Cy3标记羊抗大鼠二抗,购自上海碧云天生物技术股份有限公司;肿瘤坏死因子α (tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL) -6和IL-10酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA) 试剂盒,购自美国BioLegend公司。
1.2 实验动物和分组采用48只、雌雄各半的C57BL/6小鼠构建Notch1正常表达(Notch1normal) 和Notch1高表达(Notch1over) 小鼠,各24只,由百奥赛图(北京) 医药科技股份有限公司提供,生产许可证号:SCXK (京) 2020-0007。小鼠饲养于SPF级实验动物房中。维持饲养环境安静,保证充足的饲料和水,控制室内温度(24±2) ℃,湿度(40±10) %,维持12 h昼夜循环。本研究通过南阳市第一人民医院伦理委员会审核批准,审批号:[2022]伦审19号。
取24只Notch1normal小鼠,分为Notch1normal+生理盐水组(Notch1normal+Sal组) 和Notch1normal+PTZ组,雌雄各半,每组12只。取24只Notch1over小鼠,分为Notch1over+生理盐水组(Notch1over+Sal组) 和Notch1over+PTZ组,雌雄各半,每组12只。
Notch1normal+PTZ组和Notch1over+PTZ组小鼠,每日腹腔注射0.5 mL PTZ溶液(30 mg/kg),连续28 d,构建癫痫慢性点燃模型[7]。给药后30 min内,观察小鼠癫痫发作行为,根据Racine评分标准评估癫痫发作等级,当连续3 d达到Ⅳ级时,认为模型建立成功,记录此时时间。Notch1normal+Sal组和Notch1over+Sal组小鼠,每日腹腔注射0.5 mL生理盐水,连续28 d。
1.3 Racine评分[7]标准0级,无抽搐发作;Ⅰ级,面部和嘴抽动;Ⅱ级,频繁点头运动;Ⅲ级,单侧前肢阵挛;Ⅳ级,双侧前肢抽搐,时常身体立起;Ⅴ级,全面性强直阵挛发作,即身体背曲强直和跌倒。
1.4 免疫荧光染色检测小胶质细胞活化和极化将小鼠处死后心脏灌流,取出完整脑组织,放入4%多聚甲醛中固定24 h。取出脑组织,梯度乙醇脱水,冷冻液包埋,切成约10 μm厚冠状切片,表面滴加山羊血清封闭。切片清洗后,分别滴加兔抗鼠Iba1抗体稀释液和大鼠抗小鼠CD16或Arg1抗体(1∶100) 稀释液,4 ℃冰箱中孵育过夜。清洗切片表面,滴加二抗稀释液,室温避光孵育1 h。清洗切片表面,滴加DAPI染料孵育5 min进行细胞核染色,荧光显微镜下观察荧光发光并拍照。
1.5 炎性细胞因子检测小鼠处死后取颞叶组织匀浆,制成待测样品,采用双缩脲酸蛋白浓度测定试剂盒检测蛋白浓度。取提前包被完成的TNF-α、IL-6、IL-10 ELISA检测板,稀释试剂盒中标准品。将检测样品和标准品加入ELISA检测板各个样品孔中,37 ℃孵育2 h。弃去板中样品,洗板后加入对应一抗稀释液,37 ℃孵育1 h。弃去一抗稀释液,洗板后加入HRP标记二抗稀释液,37 ℃孵育1 h。弃去二抗稀释液,洗板后加入显色液,15 min后加入终止液,450 nm处检测各个样品光密度值。通过标准曲线计算出各个样品中TNF-α、IL-6、IL-10含量。
1.6 统计学分析采用SPSS 23.0软件进行统计分析。计量资料用x±s表示,多组间比较采用单因素方差分析,两两比较采用LSD检验。P < 0.05为差异有统计学意义。
2 结果 2.1 在癫痫慢性点燃模型中评估Notch1蛋白高表达对小鼠癫痫发作的影响Notch1normal+PTZ组和Notch1over+PTZ组连续3次到达Racine Ⅳ级症状的平均时间分别为(16.10± 2.00) d和(23.15±2.58) d,与Notch1normal+PTZ组相比,Notch1over+PTZ组小鼠连续3次到达Racine Ⅳ级症状的平均时间明显延长(P < 0.05)。
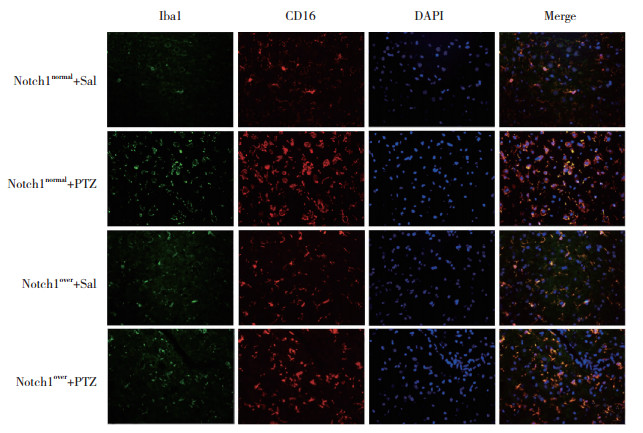
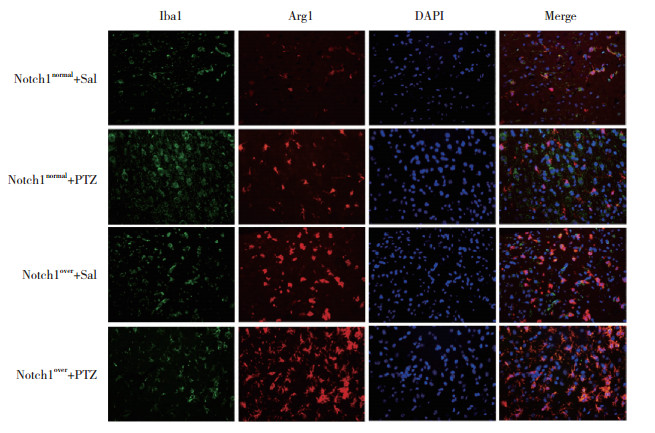
2.2 Notch1蛋白高表达对小胶质细胞极化的影响与Notch1normal+Sal组相比,Notch1normal+PTZ组小鼠颞叶组织中Iba1、CD16和Arg1蛋白相对荧光强度均明显增加(P < 0.05);与Notch1normal+PTZ组相比,Notch1over+PTZ组小鼠颞叶组织中Iba1和CD16蛋白相对荧光强度明显降低(P < 0.05),Arg1蛋白相对荧光强度明显增加(P < 0.05)。见图 1、图 2、表 1。
|
| 图 1 小鼠颞叶组织中Iba1和CD16蛋白免疫荧光染色×20 Fig.1 Immunofluorescence staining of Iba1 and CD16 proteins in the temporal lobes of mice ×20 |
|
| 图 2 小鼠颞叶组织中Iba1和Arg1蛋白免疫荧光染色×20 Fig.2 Immunofluorescence staining of Iba1 and Arg1 proteins in the temporal lobes of mice ×20 |
| Group | Iba1 | CD16 | Arg1 |
| Notch1normal+Sal | 1.00±0.26 | 1.00±0.24 | 1.00±0.26 |
| Notch1normal+PTZ | 4.33±1.041) | 4.55±0.801) | 1.37±0.291) |
| Notch1over+Sal | 1.23±0.18 | 1.17±0.22 | 1.98±0.371) |
| Notch1over+PTZ | 1.20±0.242) | 1.33±0.182) | 2.48±0.372) |
| F | 49.09 | 44.21 | 12.23 |
| P | < 0.001 | < 0.001 | < 0.001 |
| 1) P < 0.05 vs. Notch1normal+Sal group;2) P < 0.05 vs. Notch1normal+PTZ group. | |||
2.3 Notch1蛋白高表达对炎症反应的影响
与Notch1normal+Sal组相比,Notch1normal+PTZ组小鼠颞叶组织中TNF-α、IL-6、IL-10含量明显增加(P < 0.05);与Notch1normal+PTZ组相比,Notch1over+PTZ组小鼠颞叶组织中TNF-α、IL-6含量明显减少(P < 0.05),IL-10含量进一步增加(P < 0.05)。见表 2。
| Group | TNF-α | IL-6 | IL-10 |
| Notch1normal+Sal | 83.71±14.08 | 136.53±30.51 | 129.72±17.12 |
| Notch1normal+PTZ | 293.58±60.921) | 770.25±99.381) | 203.91±32.201) |
| Notch1over+Sal | 76.10±12.66 | 117.77±31.57 | 337.68±39.561) |
| Notch1over+PTZ | 126.44±34.062) | 163.14±32.852) | 467.99±54.312) |
| F | 47.31 | 186.12 | 106.80 |
| P | < 0.001 | < 0.001 | < 0.001 |
| 1) P < 0.05 vs. Notch1normal+Sal group;2) P < 0.05 vs. Notch1normal+PTZ group. | |||
3 讨论
慢性点燃模型能够较好地模拟癫痫的进展和长期反复性发作,已用于多种癫痫的病理、生理研究以及抗癫痫药物筛选[7-8]。本研究首先比较了Notch1over和Notch1normal小鼠在癫痫点燃中的差异,结果显示,Notch1normal小鼠在癫痫慢性点燃模型中连续3次到达Racine Ⅳ级症状的时间增加。提示Notch1高表达能够明显减轻小鼠癫痫症状,延缓癫痫的发生时间,降低癫痫易感性。
中枢神经系统中,PTZ侵入会诱导小胶质细胞活化和极化,诱发炎症反应,促进癫痫病理进展。然而,不同点燃模型、发作时间和检测时间点间,小胶质细胞极化存在差异[9]。急性癫痫模型中,小胶质细胞首先会出现不同程度的活化,M1型(CD16/CD86) 和M2型(CD206/Arg1) 小胶质细胞极化标志物的mRNA表达明显增加[9]。然而,在慢性点燃模型中,在前期M1型和M2型小胶质细胞极化标志物表达水平均明显升高,随着癫痫的发展,M2型小胶质细胞极化标志物表达水平在癫痫不断发作中逐渐降低[10]。本研究结果显示,与Notch1normal+Sal组相比,Notch1normal+PTZ组小鼠脑组织中炎性细胞因子TNF-α和IL-6含量、小胶质细胞活化标志物Iba1和M1型极化标志物CD16表达增加,提示慢性点燃模型会诱发小胶质细胞向促炎性表型极化。与此同时,IL-10含量和M2型极化标志物Arg1表达增加,提示M2型小胶质细胞极化增加,但其趋势远不及M1型小胶质细胞极化。
Notch1蛋白早期被发现具有调控神经干细胞再生功能,激活或抑制Notch1蛋白将不同程度影响神经干细胞命运[11]。随着研究的进展,Notch1蛋白被发现与炎症反应相关,但关于其机制的研究结果仍存在一些矛盾。有研究[12]认为,Notch1蛋白促进热休克因子激活,进而抑制NLRP3功能和肝细胞凋亡,从而缓解缺血再灌注诱导的肝损伤。但有研究[13]认为,Notch1会介导炎症,加速内皮细胞衰老,最终导致内皮细胞功能障碍。此外,脂多糖激活的小胶质细胞通过提高Notch1蛋白表达水平,调控促炎性细胞因子的释放[14]。以上研究结果提示,Notch1蛋白对炎症反应的调控作用机制仍有待进一步研究,且Nocth1蛋白表达在炎症反应的不同时期可能存在差异。本研究结果显示,Notch1蛋白表达能够明显调控小胶质细胞极化。小胶质细胞极化调节是一类新的神经保护途径。研究[15]发现,腹腔注射IL-4/γ干扰素可调节小胶质细胞表型的比例,抑制极化的M1型小胶质细胞中IL-1β的合成,明显改善小鼠慢性癫痫活动。本研究结果显示,Notch1蛋白高表达与M1型小胶质细胞极化减少、M2型小胶质细胞极化增加相关。与Notch1normal+Sal组比较,Notch1over+Sal组小鼠CD16蛋白表达虽然未见明显变化,但Arg1蛋白表达明显增加,且抗炎细胞因子IL-10含量增加,提示Notch1over小鼠对中枢炎症反应具有一定的抵抗性。此外,与Notch1normal+PTZ组相比,Notch1over+PTZ组小鼠颞叶组织中炎性细胞因子TNF-α、IL-6含量明显减少,小胶质细胞活化和M1型极化标志物Iba1、CD16蛋白表达明显降低,但M2型极化标志物Arg1蛋白表达明显增加。这在一定程度上解释了Notch1蛋白表达调控小胶质细胞表型转化的机制。
本研究存在一定的局限性。首先,本研究仅对Notch1蛋白高表达小鼠进行了研究,而未探讨Notch1蛋白敲低或抑制小鼠对癫痫的易感性,未能全面说明Notch1蛋白对炎症反应和小胶质细胞活化的影响。其次,本研究未对Notch1蛋白下游信号通路的变化进行进一步研究,其对小胶质细胞调控的影响有待进一步探索。
综上所述,本研究结果提示,小鼠脑组织中Notch1蛋白高表达能够明显提高M2型小胶质细胞极化,增加小鼠对癫痫发作的抵抗性。
| [1] |
DING D, ZHOU D, SANDER JW, et al. Epilepsy in China: major progress in the past two decades[J]. Lancet Neurol, 2021, 20(4): 316-326. DOI:10.1016/S1474-4422(21)00023-5 |
| [2] |
LIU TT, FENG L, LIU HF, et al. Altered axon initial segment in hippocampal newborn neurons, associated with recurrence of temporal lobe epilepsy in rats[J]. Mol Med Rep, 2017, 16(3): 3169-3178. DOI:10.3892/mmr.2017.7017 |
| [3] |
BENSON MJ, MANZANERO S, BORGES K. Complex alterations in microglial M1/M2 markers during the development of epilepsy in two mouse models[J]. Epilepsia, 2015, 56(6): 895-905. DOI:10.1111/epi.12960 |
| [4] |
连小月, 张志诚, 李晨嫣. Notch信号通路调控巨噬细胞极化加重自身免疫性甲状腺炎[J]. 中国医科大学学报, 2021, 50(10): 899-903. DOI:10.12007/j.issn.0258-4646.2021.10.007 |
| [5] |
CHEN R, ZHU H, WANG Z, et al. Targeting microglia/macrophages Notch1 protects neurons from pyroptosis in ischemic stroke[J]. Brain Sci, 2023, 13(12): 1657. DOI:10.3390/brainsci13121657 |
| [6] |
LI QQ, DING DH, WANG XY, et al. Lipoxin A4 regulates microglial M1/M2 polarization after cerebral ischemia-reperfusion injury via the Notch signaling pathway[J]. Exp Neurol, 2021, 339: 113645. DOI:10.1016/j.expneurol.2021.113645 |
| [7] |
VAN ERUM J, VAN DAM D, DE DEYN PP. PTZ-induced seizures in mice require a revised Racine scale[J]. Epilepsy Behav, 2019, 95: 51-55. DOI:10.1016/j.yebeh.2019.02.029 |
| [8] |
LU Y, LIN M, OU S, et al. Astragalus polysaccharides ameliorate epileptogenesis, cognitive impairment, and neuroinflammation in a pentylenetetrazole-induced kindling mouse model[J]. Front Pharmacol, 2024, 15: 1336122. DOI:10.3389/fphar.2024.1336122 |
| [9] |
ZHENG Q, ZHU T, HU H, et al. TRPM2 ion channel is involved in the aggravation of cognitive impairment and down regulation of epilepsy threshold in pentylenetetrazole-induced kindling mice[J]. Brain Res Bull, 2020, 155: 48-60. DOI:10.1016/j.brainresbull.2019.11.018 |
| [10] |
XIE L, LI T, SONG X, et al. Dynamic alteration of dendrites and dendritic spines in the hippocampus and microglia in mouse brain tissues after kainate-induced status epilepticus[J]. Int J Neurosci, 2021, 131(11): 1045-1057. DOI:10.1080/00207454.2020.1770246 |
| [11] |
YI L, ZHOU X, LI T, et al. Notch1 signaling pathway promotes invasion, self-renewal and growth of glioma initiating cells via modulating chemokine system CXCL12/CXCR4[J]. J Exp Clin Cancer Res, 2019, 38(1): 339. DOI:10.1186/s13046-019-1319-4 |
| [12] |
JIN Y, LI C, XU D, et al. Jagged1-mediated myeloid Notch1 signaling activates HSF1/Snail and controls NLRP3 inflammasome activation in liver inflammatory injury[J]. Cell Mol Immunol, 2020, 17(12): 1245-1256. DOI:10.1038/s41423-019-0318-x |
| [13] |
PARK JH, CHOI JY, LEE HK, et al. Notch1-mediated inflammation is associated with endothelial dysfunction in human brain microvascular endothelial cells upon particulate matter exposure[J]. Arch Toxicol, 2021, 95(2): 529-540. DOI:10.1007/s00204-020-02942-9 |
| [14] |
GE Y, HUANG M, MA YF. The effects of microRNA-34a regulating Notch-1/NF-κB signaling pathway on lipopolysaccharide-induced human umbilical vein endothelial cells[J]. World J Emerg Med, 2017, 8(4): 292-296. DOI:10.5847/wjem.j.1920-8642.2017.04.008 |
| [15] |
LI T, ZHAI X, JIANG J, et al. Intraperitoneal injection of IL-4/IFN-γ modulates the proportions of microglial phenotypes and improves epilepsy outcomes in a pilocarpine model of acquired epilepsy[J]. Brain Res, 2017, 1657: 120-129. DOI:10.1016/j.brainres.2016.12.006 |
 2025, Vol. 54
2025, Vol. 54