文章信息
- 冯思源, 龙雷, 邢拓, 于立普, 宋其韬, 张瑞国
- FENG Siyuan, LONG Lei, XING Tuo, YU Lipu, SONG Qitao, ZHANG Ruiguo
- 全身骨显像联合血清N-Osrteoc和VEGFR2检测对老年肺癌患者骨转移的临床诊断价值
- Clinical diagnostic value of whole-body bone imaging combined with serum N-Osrteoc and VEGFR2 detection for bone metastasis in elderly patients with lung cancer
- 中国医科大学学报, 2025, 54(3): 214-218
- Journal of China Medical University, 2025, 54(3): 214-218
-
文章历史
- 收稿日期:2024-08-08
- 网络出版时间:2025-3-19 10:56:26
2. 天津医科大学总医院核医学科,天津 300052
2. Nuclear Medicine Department, Tianjin Medical University General Hospital, Tianjin 300052, China
肺癌是老年人群常见的恶性肿瘤,易发生远处转移,以骨转移最为常见,严重降低患者的生活质量[1]。因此,寻找早期肺癌骨转移的诊断方法,对降低肺癌死亡率有重要意义。全身骨显像在诊断和评估各类恶性肿瘤骨转移中有重要价值,是骨转移的确诊依据[2]。N端骨钙素(N-terminal osteocalcin,N-Osrteoc) 是一种骨转换标志物,在许多癌症骨转移的发生发展中发挥重要作用 [3]。血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)2是血管内皮生长因子(vascular endothelial growth factor,VEGF) 的受体,参与血管生成等各种病理生理过程。既往研究[4]显示,VEGF在非小细胞肺癌患者癌组织中过表达,靶向治疗对肺癌骨转移中VEGF的表达具有较强的抑制作用。本研究旨在探讨全身骨显像联合血清指标N-Osrteoc、VEGFR2检测对老年肺癌患者骨转移的早期诊断价值。
1 材料与方法 1.1 一般资料收集2021年12月至2023年12月天津医院首次确诊的100例老年肺癌(均为非小细胞肺癌) 患者的一般资料。其中,男61例,女39例,年龄60~87岁,平均年龄(75.42±10.18) 岁,骨转移患者42例(肺癌骨转移组),无骨转移患者58例(肺癌无骨转移组),骨转移部位中胸骨20例、肋骨10例、肩胛骨7例、脊椎骨5例。纳入标准:(1) 符合肺癌和骨转移诊断标准[5-6];(2) 单病灶转移;(3) 年龄>60岁。排除标准:(1) 有全身骨显像等影像检查禁忌证或对显影剂过敏;(2) 原发性骨代谢异常或严重骨质疏松症;(3) 有支气管、肺部手术史;(4) 无沟通表达能力;(5) 合并其他部位恶性肿瘤;(6) 有重要脏器病变或免疫、血液系统疾病。本研究获得天津医院医学伦理委员会批准。
1.2 方法 1.2.1 血清N-Osrteoc、VEGFR2水平检测收集所有肺癌患者空腹状态时的血液样本5 mL,3 000 r/min离心15 min,收集上层血清样本,采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA) 检测患者血清中N-Osrteoc、VEGFR2的水平,试剂盒分别购自上海白益生物科技有限公司和上海联迈生物工程有限公司。
1.2.2 全身骨显像检查采用美国GE公司提供的SPECT诊断仪(E.cam单探头,仪器配备低能通用型平行孔准直器) 对所有肺癌患者进行全身骨显像检查,所有检查由同一位影像科医师采用同一台机器完成。显影剂为放射性同位素示踪剂99mTc-亚甲基二磷酸盐(methylene diphosphonate,MDP) (740~1 110 MBq),静脉注射20 mCi显影剂,嘱患者饮水排尿,并于2~3 h后进行全身骨显像检查。协助患者取仰卧位,仪器参数设置为采集速度20 cm/min,图像矩阵150×510,能峰140 KeV,能窗20%,检查完成后由2位医师共同阅片并判定骨转移结果。骨显像阳性为排除炎症、外伤、骨退行性疾病、代谢性疾病后,图像显示局部放射性浓聚或缺损定位异常。
1.3 统计学分析采用SPSS 25.0软件处理数据,服从正态分布的计量资料以x±s表示,采用独立样本t检验;计数资料以率(%) 表示,采用χ2检验;血清N-Osrteoc、VEGFR2、全身骨显像对肺癌骨转移的诊断价值采用受试者操作特征(receiver operator characteristic,ROC) 曲线分析,计算曲线下面积(area under the cure,AUC);不同检查方法诊断肺癌骨转移与病理诊断结果的一致性采用Kappa检验分析。P < 0.05为差异有统计学意义。
2 结果 2.1 2组血清N-Osrteoc、VEGFR2水平比较肺癌骨转移组血清N-Osrteoc[(23.13±5.91) μg/mL]、VEGFR2水平[(1.55±0.37) μg/L]显著高于肺癌无骨转移组[(14.02±4.76) μg/mL和(1.04±0.25) μg/L],差异有统计学意义(t = 8.529、8.226,P均 < 0.001)。
2.2 血清N-Osrteoc、VEGFR2水平诊断肺癌骨转移结果ROC曲线分析诊断结果显示,血清N-Osrteoc、VEGFR2水平诊断肺癌骨转移的AUC分别为0.847 (95%CI:0.774~0.921)、0.846 (95%CI:0.767~0.924),灵敏度均为83.33%,特异度分别为75.86%、67.24%,临界值分别为17.48 μg/mL、1.37 μg/L。见图 1。

|
| 图 1 血清N-Osrteoc、VEGFR2水平诊断肺癌骨转移的ROC曲线 Fig.1 ROC curve of serum N-Osrteoc and VEGFR2 levels for diagnozing lung cancer bone metastasis |
2.3 全身骨显像、血清N-Osrteoc、VEGFR2单独及联合检测诊断肺癌骨转移结果
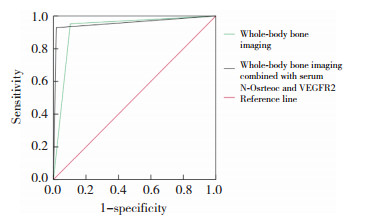
与病理结果比较,全身骨显像、血清N-Osrteoc、血清VEGFR2单独及联合检测肺癌骨转移结果假阳性例数分别为8例、14例、19例、1例,假阴性例数分别为2例、7例、7例、3例,一致性Kappa值分别为0.799、0.579、0.487、0.917(P < 0.05),见表 1。全身骨显像单独及联合血清N-Osrteoc、VEGFR2检测诊断肺癌骨转移的AUC分别为0.907、0.956,见表 2、图 2。
| Diagnostic method | Pathological results | Total | Kappa | P | |
| Lung cancer boneg metastasis(n = 42) | Non-lung cancer bone metastasis(n = 58) | ||||
| Whole-body bone imaging | 0.799 | < 0.001 | |||
| Lung cancer bone metastasis | 40(95.24) | 8(13.79) | 48 | ||
| Non-lung cancer bone metastasis | 2(4.76) | 50(86.21) | 52 | ||
| N-Osrteoc | 0.579 | < 0.001 | |||
| Lung cancer bone metastasis | 35(83.33) | 14(24.14) | 49 | ||
| Non-lung cancer bone metastasis | 7(16.67) | 44(75.86) | 51 | ||
| VEGFR2 | 0.487 | < 0.001 | |||
| Lung cancer bone metastasis | 35(83.33) | 19(32.76) | 54 | ||
| Non-lung cancer bone metastasis | 7(16.67) | 39(67.24) | 46 | ||
| Whole-body bone imaging combined with serum N-Osrteoc and VEGFR2 | 0.917 | < 0.001 | |||
| Lung cancer bone metastasis | 39(92.86) | 1(1.72) | 40 | ||
| Non-lung cancer bone metastasis | 3(7.14) | 57(98.28) | 60 | ||
| Index | AUC | 95%CI | Sensitivity (%) | Specificity (%) | P |
| Whole-body bone imaging | 0.907 | 0.843-0.972 | 95.24 | 86.21 | < 0.001 |
| Whole-body bone imaging combined with serum N-Osrteoc and VEGFR2 | 0.956 | 0.906-0.998 | 92.86 | 98.28 | < 0.001 |
|
| 图 2 全身骨显像单独及联合血清N-Osrteoc、VEGFR2检测诊断肺癌骨转移的ROC曲线 Fig.2 ROC curves of whole-body bone imaging alone and in combination with serum N-Osrteoc and VEGFR2 for the diagnosis of lung cancer bone metastasis |
全身骨显像联合血清N-Osrteoc、VEGFR2检测诊断肺癌骨转移的特异度显著高于全身骨显像单独诊断,差异有统计学意义(P < 0.05)。见表 3。
| Diagnostic method | Accuracy | Sensitivity | Specificity | Negative predictive value | Positive predictive value |
| Whole-body bone imaging | 90.00 (90/100) | 95.24 (40/42) | 86.21 (50/58) | 96.15 (50/52) | 83.33 (40/48) |
| Whole-body bone imaging combined with serum N-Osrteoc and VEGFR2 | 96.00 (96/100) | 92.86 (39/42) | 98.28 (57/58) | 95.00 (57/60) | 97.50 (39/40) |
| χ2 | 2.765 | 0.213 | 4.336 | 0.027 | 3.351 |
| P | 0.096 | 0.645 | 0.037 | 0.870 | 0.067 |
3 讨论
肺癌骨转移患者生活质量较差,通常会伴随剧烈疼痛、病理性骨折和脊髓受压等骨骼相关事件 [7-8]。既往研究[9]显示,约62.6%的非小细胞肺癌患者发生至少1种骨骼相关事件,其中16.8%发生多种骨骼相关事件,预防骨转移和早期治疗是减少骨骼相关事件的最佳方法。
SPECT进行的全身骨显像能够使用标记的磷酸盐对局部骨转换进行可视化,清晰地显示出骨显著反应性过度代谢,且对肿瘤引起的骨质溶解相对敏感[10]。张玉娜等[11]研究结果显示,发生骨转移的肺癌患者中放射性核素骨显像阳性率较高,且其诊断骨转移的灵敏度为80.00%,特异度为66.67%,与本研究结果基本相似。由此可见,全身骨显像诊断肺癌骨转移的灵敏度较高,特异度不足,可能是由于部分患者全身骨显像图中存在伪影,临床医师在诊断时出现误诊;亦可能是由于样本相对不足,统计分析结果出现了偏倚。
骨钙素检测值可用于评估潜在骨骼疾病、骨形成和骨吸收的异常程度,同时可监测骨骼相关疾病的疗效[12]。近期研究[3]结果显示,N-Osrteoc在前列腺癌的骨转移中发挥关键作用,其诊断骨转移的AUC、灵敏度、特异度分别为0.741、79.2%、80.0%。本研究结果显示,肺癌骨转移患者血清中N-Osrteoc水平显著高于肺癌无骨转移患者。基于目前对肺癌溶骨性骨转移的理解,推测肺癌细胞能够刺激破骨细胞生成,破坏骨形成和骨吸收的平衡机制,而破骨细胞大量生成与骨转移相关的因子N-Osrteoc,进而支持肺癌细胞在骨中定植和生长,形成恶性循环。进一步ROC分析结果表明,N-Osrteoc在诊断肺癌骨转移的灵敏度虽较高(83.33%),但其特异度需进一步提升。
血管生成受积极因素和消极因素的平衡调节,VEGF是一种同源二聚体蛋白,被鉴定为内皮细胞的特异性有丝分裂原,在各种肿瘤和炎症性疾病中过度表达,其中VEGF/VEGFR2轴在肿瘤血管生成和生长中发挥重要作用[13]。ZHENG等[14]研究发现,VEGFR2可通过促进血管生成和免疫逃逸在骨肉瘤中发挥促转移功能。本研究中,发生骨转移的肺癌患者血清中VEGFR2高表达,提示VEGFR2可能参与了肺癌患者疾病的发生发展及骨转移,VEGFR2与VEGF结合后可生成并释放多种细胞因子,不仅能改变血管通透性,还可促进新生血管生成,诱发肿瘤细胞侵袭和转移,进而发生骨转移。ROC曲线分析结果显示,血清VEGFR2对于肺癌骨转移具有一定的诊断价值(AUC>0.8),但其单独诊断的特异度相对较低,易造成误诊,可考虑同临床中其他指标联合应用。本研究发现将血清N-Osrteoc、VEGFR2联合全身骨显像应用于肺癌骨转移的诊断时,其AUC、特异度均得到提高,且一致性Kappa值达0.917。因此,联合诊断可从影像学和生物学两方面综合评估疾病状况,对肺癌骨转移风险的评估价值更高。
综上所述,血清N-Osrteoc、VEGFR2联合全身骨显像诊断肺癌患者骨转移有较高的临床价值,临床上可建议肺癌患者使用上述指标联合评估骨转移情况,一次性获取全身多病灶结果,显著提高肺癌骨转移的阳性率和检出率,降低漏诊率和误诊率。本研究是回顾性研究,样本来源受限、样本量相对较小,今后将开展多中心、大样本研究进行验证。
| [1] |
LI MP, LIU WC, SUN BL, et al. Prediction of bone metastasis in nonsmall cell lung cancer based on machine learning[J]. Front Oncol, 2022, 12: 1054300. DOI:10.3389/fonc.2022.1054300 |
| [2] |
IKEDA T, KITAJIMA K, TSUCHITANI T, et al. Effectiveness of quantitative bone SPECT/CT for bone metastasis diagnosis[J]. Hell J Nucl Med, 2022, 25(3): 253-259. DOI:10.1967/s002449912513 |
| [3] |
张春霞, 管华, 郭连洪, 等. 血清N-Osrteoc、OPN、前列腺特异性抗原联合检测在前列腺癌骨转移诊断中的价值[J]. 国际检验医学杂志, 2022, 43(7): 810-813. DOI:10.3969/j.issn.1673-4130.2022.07.009 |
| [4] |
HU Y, REN H, YANG L, et al. Effect of molecular targeted therapy combined with radiotherapy on the expression and prognostic value of COX-2 and VEGF in bone metastasis of lung cancer[J]. J BUON, 2020, 25(2): 811-820. |
| [5] |
中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)[J]. 中华肿瘤杂志, 2021, 43(6): 591-621. DOI:10.3760/cma.j.cn112152-20210207-00118 |
| [6] |
北京医学奖励基金会肺癌青年专家委员会, 中国胸外科肺癌联盟. 肺癌骨转移诊疗专家共识(2019版)[J]. 中国肺癌杂志, 2019, 22(4): 187-207. DOI:10.3779/j.issn.1009-3419.2019.04.01 |
| [7] |
DEL CONTE A, DE CARLO E, BERTOLI E, et al. Bone metastasis and immune checkpoint inhibitors in non-small cell lung cancer(NSCLC): microenvironment and possible clinical implications[J]. Int J Mol Sci, 2022, 23(12): 6832. DOI:10.3390/ijms23126832 |
| [8] |
MA SJ, LI XL, MAI YP, et al. Immunotherapeutic treatment of lung cancer and bone metastasis with a mPLA/mRNA tumor vaccine[J]. Acta Biomater, 2023, 169: 489-499. DOI:10.1016/j.actbio.2023.07.059 |
| [9] |
GUO X, MA WJ, WU HX, et al. Synchronous bone metastasis in lung cancer: retrospective study of a single center of 15, 716 patients from Tianjin, China[J]. BMC Cancer, 2021, 21(1): 613. DOI:10.1186/s12885-021-08379-2 |
| [10] |
YANG XR, PI C, YU RY, et al. Correlation of exosomal microRNA clusters with bone metastasis in non-small cell lung cancer[J]. Clin Exp Metastasis, 2021, 38(1): 109-117. DOI:10.1007/s10585-020-10062-y |
| [11] |
张玉娜, 翟士军, 罗阳子. ECT联合肿瘤标志物检测诊断老年肺癌骨转移的临床分析[J]. 贵州医药, 2023, 47(4): 622-623. DOI:10.3969/j.issn.1000-744X.2023.04.069 |
| [12] |
KARSENTY G. Osteocalcin: a multifaceted bone-derived hormone[J]. Annu Rev Nutr, 2023, 43: 55-71. DOI:10.1146/annurev-nutr-061121-091348 |
| [13] |
KAIRA K, IMAI H, MOURI A, et al. Clinicopathological impact of VEGFR2 and VEGF-C in patients with EGFR-major mutant NSCLC receiving osimertinib[J]. Thorac Cancer, 2023, 14(29): 2950-2961. DOI:10.1111/1759-7714.15082 |
| [14] |
ZHENG BX, ZHOU CL, QU GJ, et al. VEGFR2 promotes metastasis and PD-L2 expression of human osteosarcoma cells by activating the STAT3 and RhoA-ROCK-LIMK2 pathways[J]. Front Oncol, 2020, 10: 543562. DOI:10.3389/fonc.2020.543562 |
 2025, Vol. 54
2025, Vol. 54