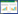文章信息
- 辛欢, 邹璟, 乐薇
- XIN Huan, ZOU Jing, LE Wei
- 电针通过cGAS-STING通路影响小胶质细胞介导的带状疱疹后神经痛
- Electroacupuncture affects microglia-mediated postherpetic neuralgia via the cGAS-STING pathway
- 中国医科大学学报, 2025, 54(3): 208-213, 218
- Journal of China Medical University, 2025, 54(3): 208-213, 218
-
文章历史
- 收稿日期:2024-08-22
- 网络出版时间:2025-3-19 10:59:27
带状疱疹后神经痛(postherpetic neuralgia,PHN)是带状疱疹的常见并发症,其主要症状包括神经持续性疼痛、神经功能障碍等[1]。PHN的常规治疗效果不佳,电针(electroacupuncture,EA)治疗PHN以价格低廉、安全性高以及患者接受度高等优势,受到广泛关注[2]。
环鸟苷酸-腺苷酸合酶(cyclic GMP-AMP synthase,cGAS)-干扰素基因刺激因子(stimulator of interferon gene,STING)具有多种生物学活性,其中包括介导细胞自噬、参与DNA损伤修复和调节细胞衰老与死亡等[3]。研究[4]显示,cGAS-STING通路对细胞的先天免疫反应和DNA病毒感染的内在抵抗力至关重要,并在1型单纯疱疹病毒感染中发挥促进作用[5]。有研究[6]表明cGAS-STING通路是神经病理性疼痛的重要靶点,但是该通路在PHN中的作用机制尚未完全明确。本研究旨在探讨EA对PHN的改善作用及其机制。
1 材料与方法 1.1 试剂与仪器清洁级Sprague-Dawley大鼠购自湖北省实验动物研究中心,树脂素(resiniferatoxin,RTX)购自美国LKT实验室;RU.521、C-176、二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国MedChemExpress LLC;P物质(substance P,SP)、神经激肽1(neurokinin-1,NK-1)、大鼠肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、一氧化氮合酶(inducible nitric oxide synthase,iNOS)、白细胞介素-10(interleukin-10,IL-10)ELISA试剂盒购自上海酶联生物科技有限公司;精氨酸酶1(arginase 1,Arg1)ELISA试剂盒购自武汉伊莱瑞特生物科技股份公司;TUNEL试剂盒购自北京百奥莱博科技有限公司;聚乙烯二醇膜(polyvinylidene fluoride,PVDF)以及DAPI Fluoromount-G购自上海碧云天生物技术有限公司;Iba1(1∶30),cGAS(1∶1 000),STING(1∶1 000),IFN-β(1∶1 000),p-IRF3(1∶ 1 000),IRF3(1∶1 000)、山羊抗兔IgG H & L二抗(1∶1 000)购自英国abcam公司;增强型化学发光溶液购自翌圣生物科技(上海)股份有限公司;韩氏穴位神经刺激仪购自北京华卫产业开发公司;Von Frey电子测痛仪购自美国IITC生命科学仪器公司。
1.2 实验动物50只清洁级Sprague-Dawley雄性大鼠,体重200~ 250 g,6~8周龄。先适应性喂养1周,置于室温20~24 ℃、湿度53%~57%的笼子中,并于每天8:00开启光照,20:00关闭光照,提供充足的食物和水。本研究获得我院伦理委员会批准(编号:2100010305)。
1.3 PHN建模和EA治疗RTX溶解在10% Tween-80、10%乙醇和80%生理盐水中,以250 μg/kg的剂量通过腹腔注射至大鼠体内,建立PHN模型[7]。阳陵泉和环跳2个穴位对改善大鼠炎症性疼痛和神经病理性疼痛有效[7-8],因此选取阳陵泉和环跳作为本研究的EA治疗穴位。将大鼠置于自制塑料舱内,用韩氏穴位神经刺激仪治疗,进针6~7 mm,以2 Hz、1 mA电流刺激30 min。治疗在RTX注射后的第8天开始,隔日1次,持续治疗35 d[8]。
采用随机数字表法将大鼠分为Vehicle组(腹腔注射与RTX组等量的10% Tween-80、10%乙醇和80% 生理盐水)、RTX组(腹腔注射250 μg/kg RTX,接受和EA组同样治疗但不通电)、RTX+EA组(RTX注射后第8天起,隔日进行1次EA治疗)、RTX+RU.521组和RTX+ C-176组[与RTX组的治疗步骤相同,但在RTX诱导前麻醉大鼠,L4~5椎骨间植入导管,向导管内注射10 μL c-GAS抑制剂RU.521(50 μg)或STING抑制剂C-176(35 μg),RU.521和C-176均经DMSO溶解和稀释[6]]。造模结束后对各组大鼠进行行为学检测。每项检测每只大鼠重复测量5次并取平均值,2次测量间隔5 min。检测由经过规范化培训的2组实验人员同时进行。
1.4 旷场实验评估焦虑行为将大鼠置于100 cm×100 cm×50 cm的黑色敞箱中。大鼠在中心区自由活动10 min,记录其进入中心区次数和停留时间。大鼠进入中心区次数多、时间长代表自信和放松,反之则代表焦虑[9]。
1.5 斜板实验评估大鼠运动功能将各组大鼠放置在一个具有纵向轴线的平板上,保证平板与大鼠的身体轴线垂直。缓慢抬起平板,每次倾斜度增加5°,同时观察大鼠能否在平板上停留5 s以上,记录大鼠能够保持平衡的最大角度[10]。
1.6 悬尾实验评估抑郁行为用胶带悬挂各组大鼠尾部,先适应1 min,之后的5 min内记录大鼠静止(除呼吸和胡须运动之外没有其他活动)时间。静止时间延长提示大鼠处于抑郁状态[9]。
1.7 机械退缩阈值检测将大鼠单独置于悬挂网上适应30 min,随后用Von Frey电子测痛仪垂直刺激其右后爪,观察缩足反应。阳性反应出现时,测痛仪显示的数值为机械缩足反射阈值[10]。
1.8 ELISA测定TNF-α、iNOS、IL-10、Arg1以及疼痛递质相关因子SP和NK-1的水平腹腔注射戊巴比妥钠处死大鼠后,取大鼠L4~6脊髓背角组织标本并称重,加入PBS充分匀浆,以3 000 r/min离心后收集上清,按照试剂盒说明书对TNF- α、iNOS、IL-10、Arg1、SP和NK-1的水平进行测定。
1.9 TUNEL实验检测脊髓背角组织细胞凋亡取大鼠L4~6脊髓背角组织,经脱蜡、固定、PBS冲洗后,用蛋白酶K处理切片。按照试剂盒中说明书加入TdT反应液,DAB显色,苏木素复染,脱水封片。镜下观察,凋亡细胞呈棕褐色,计算凋亡率,凋亡率=凋亡细胞数/细胞总数×100%。
1.10 Western blotting测定蛋白表达量取大鼠L4~6脊髓背角组织,裂解离心后收集上清。测定蛋白浓度,SDS-PAGE凝胶电泳。分离蛋白,脱脂奶粉封闭2 h,与一抗cGAS、STING、IFN- β、p-IRF3、IRF3结合,4 ℃孵育过夜。TBST洗涤3次后,加入二抗IgG,室温孵育1 h。洗涤后使用化学发光溶液对蛋白进行可视化,采用ImageJ软件分析蛋白的灰度值,以GAPDH为内参。
1.11 免疫荧光测定取大鼠L4~6脊髓背角组织,固定、脱水、脱钙后制作切片(厚5 μm)。切片经PBS和0.3% Triton X-100洗涤后,用含1%牛血清白蛋白和0.3% Triton X-100的PBS阻断2 h。分别加入一抗Iba1、cGAS、STING,4 ℃孵育过夜。加入山羊抗兔IgG H&L二抗,室温避光孵育2 h。切片固定,DAPI着色、封片后,荧光显微镜观察、拍照。
1.12 统计学分析采用SPSS 26.0和GraphPad Prism 9.5软件进行统计分析,符合正态分布的数据以x±s表示。多组间差异比较采用单因素方差分析,多组间的两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2 结果 2.1 EA改善RTX诱导的大鼠PHN行为与Vehicle组相比,RTX组焦虑行为增加、运动功能降低、抑郁加重、机械退缩阈值降低(P < 0.05)。而与RTX组相比,EA治疗或阻断cGAS-STING通路则减少了大鼠焦虑行为,增大了在斜板上保持平衡的角度,改善了抑郁并降低了机械退缩阈值(P < 0.05)。见图 1。
|
| A,number of entries into the center area;B,time spent in the center area;C,beam-walking test;D,tail suspension test;E,mechanical withdrawal thresholdtest. *P < 0.05 vs. Vehicle group;#P < 0.05 vs. RTX group. 图 1 EA治疗改善大鼠PHN行为 Fig.1 EA treatment improves PHN behavior in rats |
2.2 EA治疗改善PHN大鼠脊髓背角组织疼痛递质相关因子水平
与Vehicle组相比,RTX组SP和NK-1水平增高;与RTX组相比,EA处理或阻断cGAS/STING通路能够降低SP和NK-1水平(均P < 0.05)。见表 1。
| Group | SP(ng/mL) | NK-1(μmol/L) |
| Vehicle | 1.28±0.19 | 125.31±14.58 |
| RTX | 6.54±0.581) | 899.74±69.451) |
| RTX+EA | 2.77±0.352) | 384.23±41.552) |
| RTX+ RU.521 | 3.82±0.432) | 522.76±65.172) |
| RTX+C-176 | 4.41±0.562) | 574.28±81.352) |
| 1)P < 0.05 vs. Vehicle group;2)P < 0.05 vs. RTX group. | ||
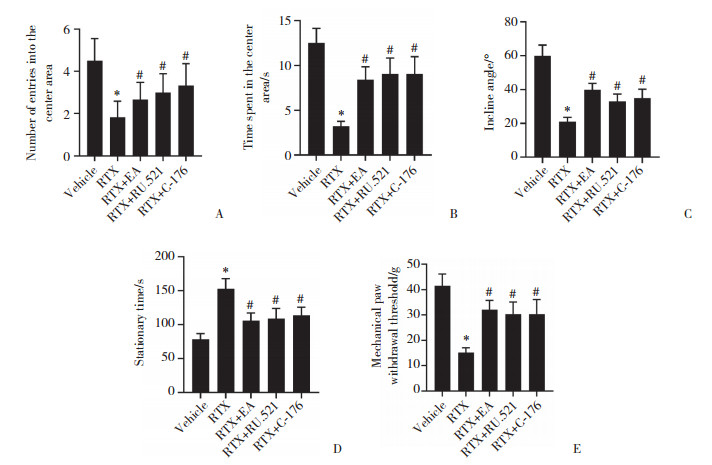
2.3 EA治疗减少PHN大鼠脊髓背角组织细胞凋亡
与Vehicle组(5.21%±0.49%)相比,RTX组细胞凋亡率(39.88%±4.21%)增加;与RTX组相比,EA干预(14.35%±1.66%)或阻断cGAS/STING通路(20.14%± 2.35%,22.71%±2.56%)能够抑制细胞凋亡(均P < 0.05)。见图 2。
|
| A, Vehicle group; B, RTX group; C, RTX+EA group; D, RTX+RU.521 group; E, RTX+C-176 group. 图 2 各组大鼠脊髓背角组织细胞凋亡检测结果×400 Fig.2 Apoptosis detection results of spinal dorsal horn tissue cells in each group of rats ×400 |
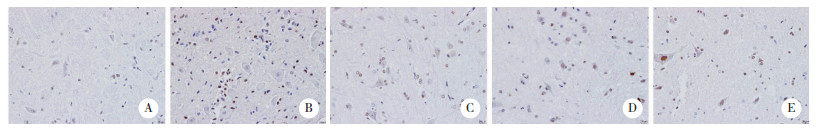
2.4 EA治疗影响PHN大鼠脊髓背角组织小胶质细胞极化
与Vehicile组相比,RTX组Iba1表达增强,TNF- α、iNOS水平升高;IL-10、Arg1水平降低(P < 0.05)。EA治疗或阻断cGAS/STING通路能降低RTX诱导后的Iba1表达、降低TNF-α、iNOS水平,提高IL-10、Arg1水平(P < 0.05)。见图 3。
|
| A, immunofluorescence detection of Iba1(×400);B, ELISA method was used to detect the levels of TNF-α, iNOS, IL-10, and Arg1. *P < 0.05 vs. Vehicle group; #P < 0.05 vs. RTX group. 图 3 EA调控小胶质细胞极化 Fig.3 EA regulates polarization of microglia cells |
2.5 EA抑制RTX诱导的脊髓组织中cGAS-STING通路的活化
cGAS、STING、IFN- β、p-IRF3在正常大鼠脊髓背角组织中呈低表达,RTX诱导后以上蛋白表达增强,而EA治疗、cGAS抑制剂RU.521与STING抑制剂C-176能抑制RTX对cGAS-STING通路相关因子的诱导(P < 0.05),见图 4。
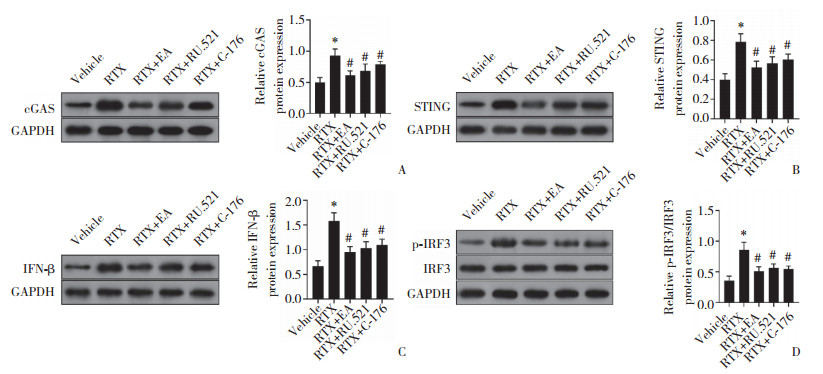
|
| A, cGAS; B, STING; C, IFN-β; D, p-IRF3 and IRF3. *P < 0.05 vs. Vehicle group; #P < 0.05 vs. RTX group. 图 4 EA治疗抑制cGAS-STING通路活化 Fig.4 EA treatment inhibits activation of the cGAS-STING pathway |
2.6 EA影响RTX对小胶质细胞中cGAS-STING通路的活化
免疫荧光染色结果显示,cGAS和STING与Iba1阳性小胶质细胞共定位。EA能够抑制小胶质细胞中cGAS-STING通路的活化,进而抑制PHN大鼠神经炎症,减少神经细胞凋亡。见图 5。
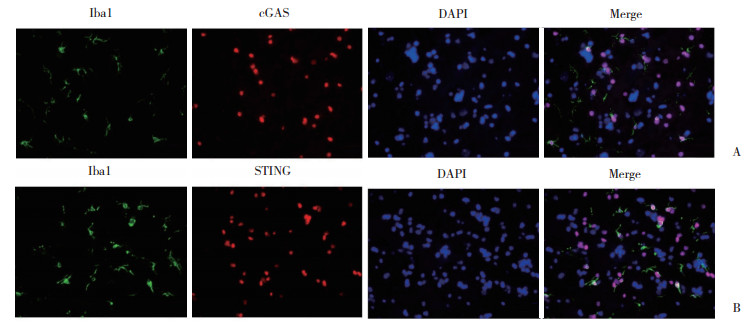
|
| A, cGAS; B, STING. 图 5 EA治疗抑制cGAS-STING通路活化,且反应主要在小胶质细胞中进行×800 Fig.5 EA treatment inhibits activation of the cGAS-STING pathway, and the response mainly occurs in microglia cells ×800 |
3 讨论
研究[11]显示,EA治疗通过激活μ-阿片受体减少了DCC和Netrin-1的表达,改变了脊髓背角环境,从而抑制RTX诱导的神经纤维异常扩展,缓解神经病理性疼痛。在PHN中,EA治疗能够通过增加miR- 223-3p的表达、抑制神经细胞自噬进而改善PHN[1]。本研究证实了EA通过影响PHN大鼠小胶质细胞中的cGAS-STING通路活化从而改善PHN大鼠的症状。
RTX与TRPV1通道结合,引起通道开放,损伤神经纤维[7, 12]。低频EA可通过小胶质细胞IL-10/β -内啡肽途径缓解神经病理性疼痛[13]。本研究发现,EA治疗可能通过调节小胶质细胞激活、抑制疼痛递质相关因子、炎性细胞因子和细胞凋亡改善RTX诱导的PHN损伤。研究 [14]发现cGAS-STING通路在慢性疼痛中有双向调节作用,在不同细胞中,该通路可能通过调节伤害性神经元的敏感性和炎症反应发挥作用。研究[6]神经病理性疼痛大鼠模型表明,cGASSTING活化主要出现在神经元和小胶质细胞,抑制该通路可以抑制LPS诱导的小胶质细胞M1极化。
在帕金森病大鼠模型中,EA治疗可以抑制cGAS-STING通路,改善脑组织的炎症和氧化应激,从而改善大鼠的神经行为学功能[15]。从机制上来讲,cGAS能够合成cGAMP进而激活STING,促进IFN- β的表达以及IRF3的磷酸化、入核,加速炎性细胞因子的释放和神经损伤[8]。
本研究发现RTX能够增强大鼠小胶质细胞中cGAS和STING的表达,而EA治疗不仅能够调节PHN炎症反应,还可以抑制RTX诱导的cGAS-STING通路活化。此外,注射cGAS抑制剂RU.521和STING抑制剂C-176能够明显抑制小胶质细胞的活化,显著改善RTX诱导的大鼠PHN、平衡能力,缓解焦虑和抑郁情绪,证实了小胶质细胞中的cGAS-STING通路在RTX诱导的PHN中的重要作用。
综上所述,本研究认为EA治疗能够显著改善大鼠PHN症状,其机制可能与抑制小胶质细胞中cGAS-STING通路的活化有关。然而,本研究也存在一定的局限性,EA的穴位和参数设置需要优化,信号通路和细胞因子的作用机制有待进一步明确。
| [1] |
ZOU J, DONG XY, WANG K, et al. Electroacupuncture inhibits autophagy of neuron cells in postherpetic neuralgia by increasing the expression of miR-223-3p[J]. Biomed Res Int, 2021, 2021: 6637693. DOI:10.1155/2021/6637693 |
| [2] |
SUN RH, LI SM, REN LL, et al. Efficacy of electroacupuncture for the treatment of postherpetic neuralgia: study protocol for a multicenter randomized controlled trial[J]. J Pain Res, 2022, 15: 959-968. DOI:10.2147/JPR.S357435 |
| [3] |
CHEN C, XU PL. Cellular functions of cGAS-STING signaling[J]. Trends Cell Biol, 2023, 33(8): 630-648. DOI:10.1016/j.tcb.2022.11.001 |
| [4] |
YOU HJ, LIN YY, LIN F, et al. β-Catenin is required for the cGAS/ STING signaling pathway but antagonized by the herpes simplex virus 1 US3 protein[J]. J Virol, 2020, 94(5): e01847-19. DOI:10.1128/JVI.01847-19 |
| [5] |
KALAMVOKI M, ROIZMAN B. HSV-1 degrades, stabilizes, requires, or is stung by STING depending on ICP0, the US3 protein kinase, and cell derivation[J]. Proc Natl Acad Sci U S A, 2014, 111(5): E611-E617. DOI:10.1073/pnas.1323414111 |
| [6] |
WU WY, ZHANG XW, WANG S, et al. Pharmacological inhibition of the cGAS-STING signaling pathway suppresses microglial M1-polarization in the spinal cord and attenuates neuropathic pain[J]. Neuropharmacology, 2022, 217: 109206. DOI:10.1016/j.neuropharm |
| [7] |
WU CH, LV ZT, ZHAO Y, et al. Electroacupuncture improves thermal and mechanical sensitivities in a rat model of postherpetic neuralgia[J]. Mol Pain, 2013, 9: 18. DOI:10.1186/1744-8069-9-18 |
| [8] |
CHEN L, ZHANG J, LI F, et al. Endogenous anandamide and cannabinoid receptor-2 contribute to electroacupuncture analgesia in rats[J]. J Pain, 2009, 10(7): 732-739. DOI:10.1016/j.jpain.2008.12.012 |
| [9] |
赵孟, 王玉婷, 戢汉斌. 金银花木樨草苷对大鼠抑郁及中枢海马神经递质调控的影响[J]. 中成药, 2020, 42(10): 2751-2755. DOI:10.3969/j.issn.1001-1528.2020.10.041 |
| [10] |
左薇, 穆敬平, 许明军. 夹脊穴电针对实验性脊髓损伤后中枢性疼痛模型大鼠自发痛行为学和痛超敏现象的影响[J]. 中国医药导报, 2021, 18(27): 17-20. |
| [11] |
LI HP, SU W, SHU Y, et al. Electroacupuncture decreases Netrin-1-induced myelinated afferent fiber sprouting and neuropathic pain through μ-opioid receptors[J]. J Pain Res, 2019, 12: 1259-1268. DOI:10.2147/JPR.S191900 |
| [12] |
武彩花, 毛红蓉, 李洪萍, 等. 电针对带状疱疹后遗神经痛大鼠脊髓背角血管内皮生长因子表达的影响[J]. 针刺研究, 2018, 43(4): 203-208. DOI:10.13702/j.1000-0607.170926 |
| [13] |
ALI U, APRYANI E, WU HY, et al. Low frequency electroacupuncture alleviates neuropathic pain by activation of spinal microglial IL-10/β-endorphin pathway[J]. Biomed Pharmacother, 2020, 125: 109898. DOI:10.1016/j.biopha.2020.109898 |
| [14] |
HU YJ, CHEN YY, LIU TT, et al. The bidirectional roles of the cGAS-STING pathway in pain processing: cellular and molecular mechanisms[J]. Biomed Pharmacother, 2023, 163: 114869. DOI:10.1016/j.biopha.2023.114869 |
| [15] |
刘艳阳, 刘佩军, 翟宏宇, 等. 电针干预经cGAS/STING通路对帕金森综合征大鼠神经功能的影响[J]. 中国老年学杂志, 2023, 43(8): 1909-1913. DOI:10.3969/j.issn.1005-9202.2023.08.031 |
 2025, Vol. 54
2025, Vol. 54