文章信息
- 姜海松, 宋艺兰
- JIANG Haisong, SONG Yilan
- 基于生物信息学探讨MEF2C在铁死亡相关哮喘中的分子机制
- Molecular mechanism of MEF2C in ferroptosis-related asthma based on bioinformatics
- 中国医科大学学报, 2025, 54(3): 199-203
- Journal of China Medical University, 2025, 54(3): 199-203
-
文章历史
- 收稿日期:2024-06-17
- 网络出版时间:2025-03-19 11:01:33
哮喘是一种复杂的异质性气道疾病,表现为肺部炎症、气道高反应、黏液分泌过多和气道重塑[1]。目前,全球有超过3亿哮喘患者[2]。随着患病率的不断上升,2025年哮喘患者的数量可能达到4亿[3]。因此,进一步筛选更有效的哮喘治疗方案有重要意义。
探究哮喘的分子机制可能是发现新药靶点和丰富哮喘治疗的有效方法[4]。DIXON等[5] 提出铁死亡是一种由脂质过氧化引起的铁依赖性程序性细胞死亡,与其他形式的程序性细胞死亡不同,铁死亡时没有细胞肿胀、质膜破裂、染色质凝聚和核碎裂,主要表现为线粒体密度增加、外膜破裂、线粒体嵴减少甚至消失。目前,关于铁死亡在哮喘中的作用鲜有报道。尽管铁死亡抑制剂对哮喘的作用已在动物实验中得到证实,但尚未进行临床转化。本研究应用生物信息学方法,系统地筛选出铁死亡相关的哮喘基因靶点,并通过实验手段进行验证。
1 材料与方法 1.1 数据采集及处理通过GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)获取哮喘相关数据集,通过R软件(4.3.1)对哮喘相关数据集GSE43696(支气管上皮细胞的基因芯片数据集)进行差异分析,考虑到GSE43696数据集中的哮喘组包括中度哮喘(n = 50)和重度哮喘(n = 38)患者,本研究分别在中度哮喘和重度哮喘的样本中验证了结果。同时,在铁死亡数据库(FerrDB)中分别下载驱动基因、标记基因和抑制基因以获取铁死亡相关基因。最后使用Venn图取交集,获得铁死亡相关哮喘 的靶点。
1.2 LASSO回归与SVM-RFE算法LASSO回归和SVM-RFE算法分别采用R软件“glmnet”包和R软件“e11071”包进行,均采用10倍交叉验证。
1.3 数据集验证分别在GSE143303数据集和GSE147878数据集中验证结果,验证集均为支气管内活检的基因芯片数据集。并通过R软件“pROC”包绘制受试者操作特征(receiver operator characteristic,ROC)曲线,曲线下面积(area under the curve,AUC)>0.75的变量具有良好的诊断性能[6]。
1.4 MEF2C的分子生物学验证 1.4.1 哮喘小鼠模型的建立BALB/c雌性小鼠16只(无特异性病原体,8周龄,体重20~22 g),购自延边大学实验动物中心。小鼠均在相对湿度为50%~60%、室温为(22±2)℃、暗光循环12 h的条件下饲养,可自由进食常规饲料(3~7 g/d)并饮用严格高压灭菌水。所有动物实验过程按照《实验动物管理条例》执行。本研究获得延边大学医学院伦理委员会批准,批准文号:SYXK(JI)2020-0009。将小鼠随机分为对照组(n = 8)和哮喘模型组(n = 8),哮喘模型组小鼠于实验开始时通过鼻内滴注50 μg屋尘螨(house dust mite,HDM),并在第7~11天鼻内滴注50 μg的HDM。对照组小鼠在相同时间点接受等量PBS。在第14天处死所有小鼠后,取出肺组织用于后续实验。实验所用HDM购自美国Greer公司。
1.4.2 实时PCR提取小鼠肺组织总RNA,并将其逆转录成cDNA,随后以此cDNA为模板进行实时PCR。总RNA提取试剂盒、cDNA第一链合成预混试剂、一步法反转录荧光定量试剂盒均购自天根生化科技(北京)有限公司。
1.4.3 Western blotting提取小鼠肺组织蛋白,用SDS-PAGE分离总蛋白20 μg。然后用一抗、二抗孵育,随后显影。GAPDH和山羊抗兔抗体购自美国CST公司;MEF2C和GPX4抗体购自美国MERCK公司;蛋白水平由Quantity One软件计算。
1.4.4 免疫组织化学染色肺组织切片经脱蜡、梯度乙醇脱水、柠檬酸溶液抗原修复后,与MEF2C抗体进行孵育,再与山羊抗兔二抗进行结合,最后,使用光学显微镜(日本Nikon公司)对切片进行图像采集。
1.4.5 免疫荧光染色人支气管上皮细胞株BEAS-2B购自中国科学院上海生命科学研究院细胞资源中心,在含10%胎牛血清、100 g/mL链霉素和100 U/mL青霉素培养基中培养。然后用200 mg/mL内毒素处理的HDM孵育24 h。将细胞固定、渗透并用MEF2C抗体进行孵育。冲洗后,细胞与山羊抗兔抗体在37 ℃下孵育1 h。
1.5 靶向MEF2C微RNA(microRNA,miRNA)预测分析基于HDM诱导哮喘小鼠模型的miRNA微阵列数据(GSE207659),通过差异分析筛选上调的miRNA。然后在miRWalk中预测人鼠共存且能靶向MEF2C的miRNA。最后通过数据集GSE197090验证结果,并使用TargetScan(https://www.targetscan.org/)预测其与靶基因潜在的结合位点。此验证集由本课题组在雌性BALB/c小鼠中建立卵清蛋白诱导的哮喘模型中分析测得。
1.6 统计学分析采用SPSS 19.0软件进行统计分析。数据以x± s表示,每个实验重复3次。2组间差异比较采用t检验。P<0.05为差异有统计学意义。
2 结果 2.1 铁死亡相关哮喘差异基因的筛选差异分析(|log2FC|>0.5,P<0.05)结果显示,中度哮喘患者与健康对照者相比,上调和下调基因分别有126个和183个;重度哮喘患者与健康对照者相比,上调和下调基因分别有338个和415个。其中,上调基因的共同部分有90个,下调基因的共同部分有122个。同时,在FerrDB数据库中共获取484个铁死亡相关基因,两者取交集得到5个铁死亡相关哮喘差异表达基因,分别是HCAR1、NOS2、MEF2C、IL6和NOX1。
2.2 LASSO回归与SVM-RFE算法筛选结果LASSO回归结果显示,IL6的表达差异与哮喘模型不明显相关,其余4个基因均通过了LASSO回归的筛选。而在SVM-RFE的算法筛选中,仅有MEF2C与NOX1通过筛选。MEF2C和NOX1的AvgRank值分别是1和2.3,提示MEF2C对哮喘模型的影响较高。见图 1。
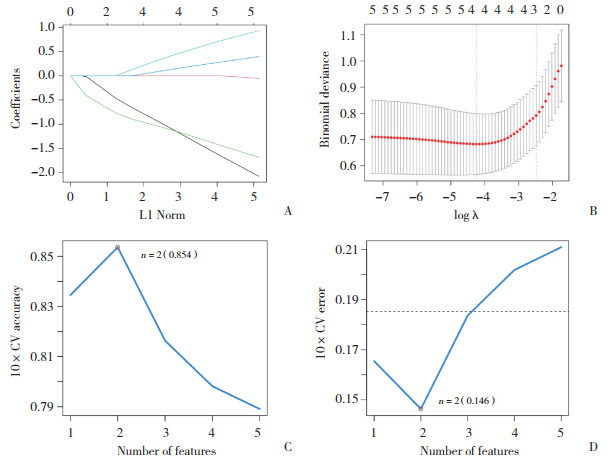
|
| A, trajectory diagram; B, parametric diagram; C, 10×CV accuracy; D, 10×CV error. 图 1 LASSO回归与SVM-RFE算法筛选结果 Fig.1 Screening results of LASSO regression and SVM-RFE algorithm |
2.3 MEF2C的验证
MEF2C的表达在GSE43696数据集中可随着哮喘的严重程度递减,GSE147878数据集也证实了这一点。同时发现MEF2C在各类哮喘数据中均具有较高的灵敏度和特异度(AUC均>0.75)。在数据集GSE143303中发现MEF2C的表达下调主要体现在寡细胞型哮喘患者及嗜酸性粒细胞型哮喘患者中,尤其在寡细胞型哮喘中ROC曲线的AUC达到0.846,而在中性粒细胞型哮喘中未见统计学差异(P>0.05),见图 2。

|
| A, box plot of MEF2C based on GSE43696; B, box plot of MEF2C based on GSE147878; C, ROC curve of MEF2C based on GSE43696 and GSE147878; D, box plot of MEF2C based on GSE143303; E, ROC curve of MEF2C based on GSE143303. *P < 0.05, **P < 0.01, ***P < 0.001. 图 2 MEF2C的数据集验证 Fig.2 Dataset validation for MEF2C |
2.4 MEF2C的分子生物学实验验证
实时PCR结果显示,HDM诱导的哮喘模型中MEF2C的表达明显降低(P<0.01)。同时,Western blotting结果显示MEF2C和GPX4在哮喘模型中的表达均明显下降(P<0.01)。且MEF2C的表达产物主要集中在气道上皮,亚细胞定位在细胞核中。见图 3。

|
| A, flowchart of asthma model preparation; B, real-time PCR; C, Western blotting; D, bar chart for Western blotting; E, immunohistochemistry; F, immunofluorescence. **P < 0.01. 图 3 MEF2C的分子生物学实验 Fig.3 Molecular biology verification of MEF2C |
2.5 靶向MEF2C的miRNA预测
差异分析(|log2FC|>0.5,P<0.05)结果显示,GSE207659数据集中共有82个表达上调的miRNA,有13个具有潜在靶向MEF2C的能力,其中miR-204- 3p及miR-2861在微阵列数据集GSE197090中得到验证。此外,在HDM诱导的哮喘模型基础上敲除白细胞介素-17A(interlukin-17A,IL-17A)基因能下调miR-204-3p、miR-2861的表达(图 4A)。TargetScan预测结果显示,miR-2861与MEF2C之间有潜在作用位点,且miR-2861的核苷酸序列在人鼠中高度同源(图 4B)。而miR-204-3p未能成功预测出与MEF2C的结合位点。

|
| A, bar chart based on GSE207659; B, prediction of action sites between miR-2861 and MEF2C based on TargetScan. *P < 0.05, ***P < 0.001. 图 4 靶向MEF2C的miRNA预测 Fig.4 Prediction of miRNAs targeting MEF2C |
3 讨论
MEF2C作为一种转录因子,参与人体多种免疫反应。MEF2C可促进M1巨噬细胞极化和Th1反应,为炎症性疾病治疗干预的潜在靶点[7]。对铁死亡有负调控作用。miRNA是由20~23个核苷酸组成的单链非编码RNA,可直接参与转录后调控。其中,miR- 2861在成骨细胞分化中发挥重要的生理作用[8-9]。
哮喘是异质性、复杂的基因-环境相互作用的结果,气道炎症和气道重塑为其主要特征[10]。研究[11] 显示铁死亡在哮喘的发展中发挥重要作用。IL-17A参与哮喘发病的多个方面,包括上皮细胞的结构改变和平滑肌收缩[12]。IL-17A可以扰乱人体支气管上皮细胞的铁稳态并诱导铁死亡,但具体的机制尚不明确[13]。应用IL-17A抑制剂可能成为对抗过敏性哮喘的新策略。
本研究基于GSE43696数据集,筛选出212个哮喘差异表达基因,并在FerrDB数据库中下载铁死亡相关基因,两者取交集得到5个铁死亡相关哮喘差异表达基因:HCAR1、NOS2、MEF2C、IL6和NOX1。之后通过LASSO回归和SVM-RFE算法的双重筛选,最终确定MEF2C为铁死亡相关哮喘的核心基因。进一步的分子生物学实验表明,在HDM诱导的哮喘小鼠模型中,MEF2C在转录和蛋白水平均显著下调,其表达主要富集于气道上皮细胞核内,提示其可能通过转录调控参与哮喘的病理过程。结合miRNA微阵列数据(GSE207659、GSE197090)和靶向预测工具(miRWalk、TargetScan),发现miR-2861在哮喘小鼠中显著上调,并可能通过与MEF2C结合抑制其表达。然而,敲除IL-17A后miR-2861的表达水平显著下调,提示IL-17A/miR-2861/MEF2C轴可能是铁死亡相关哮喘的重要调控通路。
综上所述,本研究揭示了MEF2C在铁死亡相关哮喘中的核心地位,并阐明了其潜在的上下游调控网络。然而,本研究存在一定局限性,未能通过敲低或过表达MEF2C验证其对哮喘炎症的影响。
| [1] |
AGACHE I, PALMER E, SANVER D, et al. Molecular allergology approach to allergic asthma[J]. Mol Aspects Med, 2022, 85: 101027. DOI:10.1016/j.mam.2021.101027 |
| [2] |
ARTEAGA-BADILLO DA, PORTILLO-REYES J, VARGAS-MENDOZA N, et al. Asthma: new integrative treatment strategies for the next decades[J]. Medicina, 2020, 56(9): 438. DOI:10.3390/medicina56090438 |
| [3] |
NUNES C, PEREIRA AM, MORAIS-ALMEIDA M. Asthma costs and social impact[J]. Asthma Res Pract, 2017, 3: 1. DOI:10.1186/s40733-016-0029-3 |
| [4] |
LIU L, ZHOU L, WANG LL, et al. Programmed cell death in asthma: apoptosis, autophagy, pyroptosis, ferroptosis, and necroptosis[J]. J Inflamm Res, 2023, 16: 2727-2754. DOI:10.2147/JIR.S417801 |
| [5] |
DIXON SJ, LEMBERG KM, LAMPRECHT MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [6] |
黄永迎, 程志浩, 刘扬, 等. 如何理解受试者工作特征曲线及曲线下面积[J]. 中国生育健康杂志, 2023, 34(6): 586-591. DOI:10.3969/j.issn.1671-878X.2023.06.020 |
| [7] |
ZHAO XB, DI QQ, LIU H, et al. MEF2C promotes M1 macrophage polarization and Th1 responses[J]. Cell Mol Immunol, 2022, 19(4): 540-553. DOI:10.1038/s41423-022-00841-w |
| [8] |
BARTEL DP. Metazoan microRNAs[J]. Cell, 2018, 173(1): 20-51. DOI:10.1016/j.cell.2018.03.006 |
| [9] |
LI H, XIE H, LIU W, et al. A novel microRNA targeting HDAC5 regulates osteoblast differentiation in mice and contributes to primary osteoporosis in humans[J]. J Clin Invest, 2009, 119(12): 3666-3677. DOI:10.1172/JCI39832 |
| [10] |
PAPADOPOULOS NG, MILIGKOS M, XEPAPADAKI P. A current perspective of allergic asthma: from mechanisms to management[J]. Handb Exp Pharmacol, 2022, 268: 69-93. DOI:10.1007/164_2021_483 |
| [11] |
LV XD, DONG M, TANG WF, et al. Ferroptosis, novel therapeutics in asthma[J]. Biomedecine Pharmacother, 2022, 153: 113516. DOI:10.1016/j.biopha.2022.113516 |
| [12] |
CHESNé J, BRAZA F, MAHAY G, et al. IL-17 in severe asthma. Where do we stand[J]. Am J Respir Crit Care Med, 2014, 190(10): 1094-1101. DOI:10.1164/rccm.201405-0859PP |
| [13] |
SONG JJ, ZHANG H, TONG Y, et al. Molecular mechanism of interleukin-17A regulating airway epithelial cell ferroptosis based on allergic asthma airway inflammation[J]. Redox Biol, 2023, 68: 102970. DOI:10.1016/j.redox.2023.102970 |
 2025, Vol. 54
2025, Vol. 54