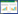文章信息
- 李祉剑, 王文思, 马鸿滢, 贾钧凯, 张天彪, 赵滢
- LI Zhijian, WANG Wensi, MA Hongying, JIA Junkai, ZHANG Tianbiao, ZHAO Ying
- 甲磺酸伊马替尼和苹果酸舒尼替尼联合应用对胃肠道间质瘤细胞迁移和侵袭能力的影响
- Effects of combined imatinib mesylate and sunitinib malate therapy on migration and invasion of gastrointestinal stromal tumor cells
- 中国医科大学学报, 2025, 54(3): 193-198
- Journal of China Medical University, 2025, 54(3): 193-198
-
文章历史
- 收稿日期:2024-10-10
- 网络出版时间:2025-03-19 14:23:04
2. 辽宁省疾病预防控制中心免疫规划所,沈阳 110005;
3. 中国医科大学生命科学学院生物化学与分子生物学教研室,沈阳 110122
2. Department of Gastrointestinal Nutritional Surgery, Shengjing Hospital of China Medical University, Shenyang 110004, China;
3. Department of National Immunization Program, Liaoning Provincial Centre for Disease Control and Prevention, Shenyang 110005, China; 3. Department of Biochemistry and Molecular Biology, School of Life Sciences, China Medical University, Shenyang 110122, China
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是一类起源于胃肠道间叶组织的肿瘤,虽然全球年发病率仅约为7/1 000 000~19/1 000 000[1-2],但因临床特征不显著、术后复发率高、化疗效果不佳等,导致其临床治疗非常困难[3-5]。受体酪氨酸激酶抑制剂甲磺酸伊马替尼作为首个GIST靶向药物广泛应用于一线治疗,但40%~50%的患者在服用甲磺酸伊马替尼半年之后出现耐药[6]。苹果酸舒尼替尼作为甲磺酸伊马替尼耐药GIST的二线疗法可在3年以上的时间里使患者达到完全缓解(complete remission,CR)[7],然而其有限的临床反应、药物毒性和活化环突变体的耐药性[6] 致使临床上需要寻找更加高效的治疗方法,因此,联合应用多靶点抑制剂成为近年来GIST治疗策略的新方向。
研究[8-10] 证实,对于甲磺酸伊马替尼耐药的GIST,应用其他受体酪氨酸激酶抑制剂和PI3K/AKT通路抑制剂这类GIST非一线药物治疗有效,且比尼美替尼[11-12]、BGJ938[13]、MK-4440[14] 等非一线药物与一线药物甲磺酸伊马替尼联合应用可获得更显著的疗效。因此,将同为受体酪氨酸激酶抑制剂的非一线药物苹果酸舒尼替尼与甲磺酸伊马替尼联合应用,以达到多靶点抑制作用理论上可行。本研究拟观察甲磺酸伊马替尼和苹果酸舒尼替尼联合应用对GIST细胞迁移和侵袭能力的影响,并探讨其联合应用价值。
1 材料与方法 1.1 材料GIST来自中国医科大学附属盛京医院GIST患者手术切除标本;甲磺酸伊马替尼购自瑞士Novartis Pharma Schweiz AG公司;苹果酸舒尼替尼购自美国Pfizer公司;Dimension Icon型原子力显微镜(atomic force microscope,AFM)、氮化硅探针MLCT购自德国BRUKER公司。BD基质胶购自美国Corning公司。本研究获得中国医科大学附属盛京医院医学伦理委员会批准(伦理编号2023PS422)。
1.2 方法 1.2.1 细胞分组原代培养GIST细胞后,将其分为空白对照组(未加药物处理)、甲磺酸伊马替尼(31.25 μmol/L)单独用药组、苹果酸舒尼替尼(15.63 μmol/L)单独用药组、联合用药组(31.25 μmol/L甲磺酸伊马替尼+15.63 μmol/L苹果酸舒尼替尼)。
1.2.2 实时定量PCR在96孔板中加入PCR反应体系20 μL,包含2×Go Taq®qPCR Master Mix 10 μL,10 μmol/L正向和反向引物各0.4 μL,cDNA 4 μL,RNase-free水5.2 μL。引物序列如下:Gab1,正向5’ -ATTCAC CACCACGACAACATTC-3’,反向5’ -ATGAGCAGGA GGAGGAACTTG-3’;Grb2,正向5’ -GCTTCATTCCC AAGAACTACATAG-3’,反向5’ -GCTCTCACTCTCTC GGATAAG-3’;PI3K,正向5’ -GGTGACTGTGTGGGA CTTATTGAG-3’,反向5’ -CTGATGTAGTGTGTGGCT GTTGAA-3’;AKT,正向5’ -GACCATGAACGAGTTT GAGTA-3’,反向5’ -CACGATGACTTCCTTCTTGAG- 3’;GSK-3β,正向5’ -GCTACCATCCTTATTCCTCCT CAT-3’,反向5’ -TGTCCACGGTCTCCAGTATTAG-3’;GAPDH,正向5’ -GCACCGTCAAGGCTGAGAAC-3’,反向5’ -TGGTGAAGACGCCAGTGGA-3’。反应条件:95 ℃ 2 min,95 ℃ 15 s,60 ℃ 1 min,40次循环,72 ℃ 10 min。GAPDH为内参照。用2-ΔΔCt法计算基因的相对表达量。
1.2.3 探针功能化及表皮生长因子(epithelial growth factor,EGF)与表皮生长因子受体(epithelial growth factor receptor,EGFR)间分子作用力测量应用AFM观察GIST细胞。用氯仿浸泡清洗AFM探针,在干燥氩气环境下与APTES和NN-diisopropylethylamine反应以吸附氨基。用NHS-PEG-MAL修饰探针,与SATP修饰的EGF结合,清洗后保存于4 ℃ PBS溶液中。通过AFM操控界面将针尖移动至各组细胞表面局部区域,并将AFM成像模式转换为力测量模式,在细胞表面局部区域获取EGF与EGFR间分子作用力曲线。
1.2.4 免疫荧光染色在24孔板中加入细胞悬液(1×105/mL),培养48 h后固定细胞。TritonX-100通透,封闭,一抗孵育,二抗孵育,DAPI显色,封片,免疫荧光检测。
1.2.5 划痕实验接种GIST细胞于6孔板并培养48 h,用200 μL无菌移液器枪头轻轻划痕,弃培养液,PBS洗3次。加入含不同浓度药物及2%胎牛血清的RPMI-1640培养液,培养24 h、48 h、72 h,倒置显微镜下对划痕拍照。
1.2.6 Transwell实验向24孔板中带有BD基质胶的Transwell小室上层加入以100 μL无血清培养基稀释的细胞悬液(1.5×104/孔),下层加入600 μL含10% 胎牛血清的完全培养基。培养48 h后,弃上室培养液,固定,清洗,结晶紫染色,光学显微镜下观察并拍照。用ImageJ软件计算每个视野中穿过膜的细胞数。
1.2.7 流式细胞检测将各组处理后的GIST细胞消化离心,重悬于1×Binding Buffer,调整密度为2×105/mL~5×105/mL,取195 μL细胞悬液,加入5 μL AnnexinV-FITC,避光混匀,室温孵育。用1×Binding Buffer洗涤细胞,离心后弃上清,将细胞重悬于190 μL 1×Binding Buffer,加入10 μL碘化丙啶,用流式细胞仪检测。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析。计量资料用x± s表示,多组间比较采用单因素方差分析,2组间比较采用t检验。计数资料用率(%)表示,采用χ2检验或Fisher确切概率法比较,P<0.05为差异有统计学意义。
2 结果 2.1 原代培养GIST细胞鉴定CD117蛋白是GIST细胞的重要分子标志物和鉴定依据。免疫荧光染色结果显示,原代培养GIST细胞中CD117均为阳性,表明原代培养GIST细胞成功。
2.2 GIST单细胞纳米级成像应用AFM对原代培养GIST细胞进行纳米级成像,结果如图 1所示,偏差图可见有利于GIST细胞转移的伪足平铺于GIST细胞周边。

|
| A, deviation map; B, height map; C, 3D map. 图 1 GIST细胞的纳米级成像×108 Fig.1 Nanoscale imaging of GIST cells ×108 |
2.3 实时定量PCR结果
通过实时定量PCR检测各组GIST细胞中PI3K/AKT信号通路相关基因Gab1、Grb2、PI3K、AKT、GSK- 3β mRNA表达水平的变化情况。结果如图 2所示,甲磺酸伊马替尼、苹果酸舒尼替尼单独及联合用药均可抑制Gab1、Grb2、PI3K、AKT、GSK-3βmRNA的表达,差异有统计学意义(P<0.05)。
|
| *P < 0.05 vs. control group; #P < 0.05 vs. imatinib group and sunitinib group. 图 2 各组GIST细胞中PI3K/AKT信号通路相关基因mRNA的相对表达量 Fig.2 Relative mRNA expression levels of PI3K/AKT pathway associated genes in GIST cells of each group |
2.4 探针功能化结果
探针功能化检测结果显示,功能化探针呈现明亮的荧光,且针尖附近区域荧光亮度明显强于其他区域,证明EGF蛋白成功连接至探针的针尖部位。
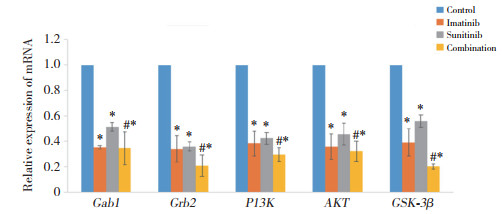
2.5 EGF与EGFR间分子作用力利用修饰有EGF分子的探针测量药物作用24 h后EGF分子与GIST细胞表面EGFR之间的作用力。结果如图 3所示,空白对照组探针从细胞表面回退过程所对应的力曲线有明显的突变峰,说明针尖逼近过程中细胞表面受体分子EGFR与针尖表面配体分子EGF发生了结合,而单独及联合用药组曲线突变峰显著减小,提示药物阻断了EGF与EGFR的结合。二维灰度图反映了EGFR在GIST细胞表面的分布情况,可见细胞表面EGFR分布密度随用药时间推移下降。与空白对照组[(341.90±33.87)pN]比较,甲磺酸伊马替尼单独用药组[(202.44±19.02)pN]、苹果酸舒尼替尼单独用药组[(226.85±16.38)pN]及联合用药组[(98.35±18.53)pN] GIST细胞EGF与EGFR间分子作用力降低,其中联合用药组降低最显著,差异均有统计学意义(P<0.01)。
|
| A, control group; B, imatinib group; C, sunitinib group; D, combination group. 图 3 各组GIST细胞EGF与EGFR分子结合曲线及二维灰度图 Fig.3 EGF and EGFR molecular binding curves and two-dimensional grey-scale plots of GIST cells |
2.6 甲磺酸伊马替尼和苹果酸舒尼替尼对GIST细胞迁移的影响
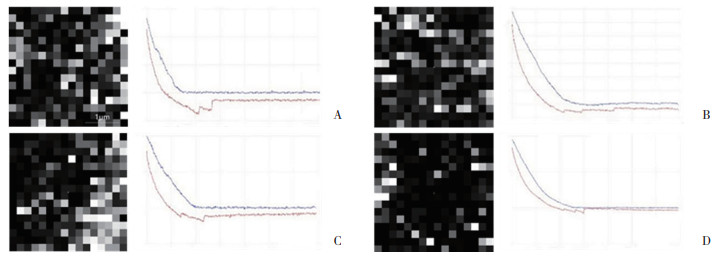
划痕实验结果如图 4所示,处理24 h、48 h、72 h时,联合用药组细胞迁移率均低于空白对照组(P<0.01);48 h、72 h时,联合用药组细胞迁移率低于单独用药组(P<0.05)。
|
| **P < 0.01 vs. control group; #P < 0.05 vs. imatinib group and sunitinib group. 图 4 GIST细胞划痕实验结果×10 Fig.4 Results of the scratch assay of GIST cells ×10 |
2.7 甲磺酸伊马替尼和苹果酸舒尼替尼对GIST细胞迁移的影响
Transwell实验结果如 图 5所示,药物作用48 h后,甲磺酸伊马替尼和苹果酸舒尼替尼联合用药组较单独用药组对GIST细胞侵袭的抑制作用更显著(P<0.05)。
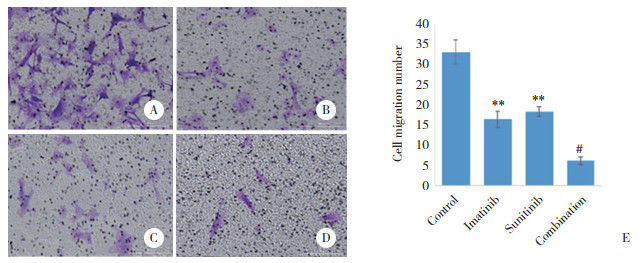
|
| A, control group(×10); B, imatinib group(×10); C, sunitinib group(×10); D, combination group(×10); E, histograms of the results of Transwell assay. **P < 0.01 vs. control group; #P < 0.01 vs. imatinib group and sunitinib group. 图 5 Transwell实验结果 Fig.5 Results of Transwell assay |
2.8 甲磺酸伊马替尼和苹果酸舒尼替尼诱导GIST细胞凋亡情况检测
流式细胞检测结果显示,药物作用24 h后,甲磺酸伊马替尼单独用药组(3.44%±0.55%)、苹果酸舒尼替尼单独用药组(2.92%±0.82%)及联合用药组(5.55%±0.73%)细胞凋亡率显著高于空白对照组(1.07%±0.40%),差异有统计学意义(P<0.05)。表明甲磺酸伊马替尼及苹果酸舒尼替尼均可抑制GIST细胞生长,诱导其凋亡,联合用药效果更显著。
3 讨论GIST临床特征不显著,术后复发率高,化疗效果不佳,预后差。本研究采用AFM对原代培养的GIST细胞进行纳米级成像,结果显示,GIST细胞周边富含平铺的细胞伪足,这样的形态特征有利于其转移和侵袭,在一定程度上解释了GIST难以被根治的原因。
现阶段用于治疗GIST的药物中,一线药物甲磺酸伊马替尼疗效较好,但容易出现耐药。苹果酸舒尼替尼等二线药物虽然对甲磺酸伊马替尼耐药的患者疗效较好,但其毒性反应较严重,且无法根绝耐药性。受临床上某些一二线药物联合用药化疗方案的启发,推测甲磺酸伊马替尼和苹果酸舒尼替尼联合应用可能加强对GIST的疗效。
GIST细胞可通过PI3K/AKT/GSK-3β途径激活下游信号通路[15],刺激自身增殖,因此,抑制PI3K/AKT信号通路被认为是治疗GIST的一种有前途的靶向治疗策略[16]。EGFR是PI3K/AKT信号通路上游最重要的受体蛋白之一,共同靶向EGF和PI3K/AKT通路,可使药物发挥协同作用,从而提高疗效[17]。甲磺酸伊马替尼是c-KIT靶向药物,c-KIT抑制细胞凋亡的必要途径是PI3K/AKT途径,该途径在蛋白质合成、增殖和存活等细胞过程中至关重要[18],因此推测甲磺酸伊马替尼能够抑制AKT活化,影响细胞迁移、侵袭和存活过程。苹果酸舒尼替尼的主要作用位点包括KIT和VEGFR等,而VEGFR与EGFR均属于受体酪氨酸激酶的亚家族,其机制有很多相似之处,酪氨酸激酶抑制剂治疗GIST的机制在一定程度上也是相似的,因此猜测苹果酸舒尼替尼和甲磺酸伊马替尼可抑制EGFR蛋白和PI3K/AKT相关蛋白的表达。为了验证联合用药效果,本研究采用实时定量PCR检测了单独及联合用药后PI3K/AKT通路相关基因表达的变化,并利用AFM力曲线测定药物对细胞表面EGFR数量和结合力的影响,结果表明,联合用药较单独用药可更显著抑制PI3K/AKT信号通路相关基因的表达,也可更显著降低GIST表面EGFR的密度。
为了验证联合用药对GIST细胞迁移、侵袭和增殖的抑制作用,本研究通过划痕实验、Transwell实验和流式细胞术,观察了单独及联合用药后GIST细胞迁移、侵袭和增殖状况的变化,结果表明,与单独用药相比,联合用药对GIST细胞的迁移、侵袭和增殖的抑制作用更显著。
本研究的不足之处如下:仅从细胞层面证实了甲磺酸伊马替尼和苹果酸舒尼替尼联合用药方案的可行性,并未在临床上验证其实际疗效。因此,未来将进一步扩大样本量,并在条件和伦理允许的前提下进行临床试验,以探寻联合用药方案的临床应用价值。
综上所述,本研究结果显示,甲磺酸伊马替尼和苹果酸舒尼替尼联合用药对GIST细胞迁移和侵袭的抑制作用较单独用药更显著,有望为GIST的临床治疗方案提供新的参考。
| [1] |
SHARMA AK, KIM TS, BAUER S, et al. Gastrointestinal stromal tumor: new insights for a multimodal approach[J]. Surg Oncol Clin N Am, 2022, 31(3): 431-446. DOI:10.1016/j.soc.2022.03.007 |
| [2] |
HUANG WK, WU CE, WANG SY, et al. Systemic therapy for gastrointestinal stromal tumor: current standards and emerging challenges[J]. Curr Treat Options Oncol, 2022, 23(9): 1303-1319. DOI:10.1007/s11864-022-00996-8 |
| [3] |
BRINCH CM, AGGERHOLM-PEDERSEN N, HOGDALL E, et al. Medical oncological treatment for patients with gastrointestinal stromal tumor(GIST) - a systematic review[J]. Crit Rev Oncol Hematol, 2022, 172: 103650. DOI:10.1016/j.critrevonc.2022.103650 |
| [4] |
LI JH, GUO SN, SUN ZQ, et al. Noncoding RNAs in drug resistance of gastrointestinal stromal tumor[J]. Front Cell Dev Biol, 2022, 10: 808591. DOI:10.3389/fcell.2022.808591 |
| [5] |
SERRANO C, GEORGE S. Gastrointestinal stromal tumor: challenges and opportunities for a new decade[J]. Clin Cancer Res, 2020, 26(19): 5078-5085. DOI:10.1158/1078-0432.ccr-20-1706 |
| [6] |
LU TT, CHEN C, WANG AL, et al. Repurposing cabozantinib to GISTs: overcoming multiple imatinib-resistant cKIT mutations including gatekeeper and activation loop mutants in GISTs preclinical models[J]. Cancer Lett, 2019, 447: 105-114. DOI:10.1016/j.canlet.2019.01.024 |
| [7] |
NIE YL, SUN WJ, XIAO ZH, et al. Complete response to sunitinib for more than three years in a patient with a jejunum gastrointestinal stromal tumor: a case report[J]. Medicine, 2019, 98(3): e14060. DOI:10.1097/MD.0000000000014060 |
| [8] |
VON MEHREN M, GEORGE S, HEINRICH MC, et al. Linsitinib (OSI-906) for the treatment of adult and pediatric wild-type gastrointestinal stromal tumors, a SARC phaseⅡ study[J]. Clin Cancer Res, 2020, 26(8): 1837-1845. DOI:10.1158/1078-0432.CCR-19-1069 |
| [9] |
FRANCK C, ROSANIA R, FRANKE S, et al. The BRAF status may predict response to sorafenib in gastrointestinal stromal tumors resistant to imatinib, sunitinib, and regorafenib: case series and review of the literature[J]. Digestion, 2019, 99(2): 179-184. DOI:10.1159/000490886 |
| [10] |
HE WZ, XU LL, DING JY, et al. Co-targeting of ACK1 and KIT triggers additive anti-proliferative and-migration effects in imatinib-resistant gastrointestinal stromal tumors[J]. Biochim Biophys Acta Mol Basis Dis, 2023, 1869(5): 166690. DOI:10.1016/j.bbadis.2023.166690 |
| [11] |
CHI P, QIN LX, CAMACHO N, et al. PhaseⅠ b trial of the combination of imatinib and binimetinib in patients with advanced gastrointestinal stromal tumors[J]. Clin Cancer Res, 2022, 28(8): 1507-1517. DOI:10.1158/1078-0432.CCR-21-3909 |
| [12] |
Combination imatinib and binimetinib is efficacious in treatment-Naïve advanced GIST[J]. Cancer Discov, 2022, 12(3): 597. DOI: 10.1158/2159-8290.CD-RW2022-015.
|
| [13] |
BOICHUK S, GALEMBIKOVA A, MIKHEEVA E, et al. Inhibition of FGF2-mediated signaling in GIST-promising approach for overcoming resistance to imatinib[J]. Cancers, 2020, 12(6): 1674. DOI:10.3390/cancers12061674 |
| [14] |
KOZINOVA M, JOSHI S, YE S, et al. Combined inhibition of AKT and KIT restores expression of programmed cell death 4(PDCD4) in gastrointestinal stromal tumor[J]. Cancers, 2021, 13(15): 3699. DOI:10.3390/cancers13153699 |
| [15] |
FUJIYA K, OHSHIMA K, KITAGAWA Y, et al. Aberrant expression of Wnt/β-catenin signaling pathway genes in aggressive malignant gastric gastrointestinal stromal tumors[J]. Eur J Surg Oncol, 2020, 46(6): 1080-1087. DOI:10.1016/j.ejso.2020.02.036 |
| [16] |
DUAN Y, HAYBAECK J, YANG ZH. Therapeutic potential of PI3K/ AKT/mTOR pathway in gastrointestinal stromal tumors: rationale and progress[J]. Cancers, 2020, 12(10): 2972. DOI:10.3390/cancers12102972 |
| [17] |
ZARYOUH H, DE PAUW I, BAYSAL H, et al. Recent insights in the PI3K/Akt pathway as a promising therapeutic target in combination with EGFR-targeting agents to treat head and neck squamous cell carcinoma[J]. Med Res Rev, 2022, 42(1): 112-155. DOI:10.1002/med.21806 |
| [18] |
D'AMATO G, STEINERT DM, MCAULIFFE JC, et al. Update on the biology and therapy of gastrointestinal stromal tumors[J]. Cancer Control, 2005, 12(1): 44-56. DOI:10.1177/107327480501200106 |
 2025, Vol. 54
2025, Vol. 54