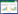文章信息
- 魏秀珍, 陈龙, 张百红
- WEI Xiuzhen, CHEN Long, ZHANG Baihong
- 卡瑞利珠单抗引发食管气管瘘及其免疫再治疗1例报道
- Camrelizumab induced tracheoesophageal fistula and immunotherapy retreatment: a case report
- 中国医科大学学报, 2025, 54(2): 174-177
- Journal of China Medical University, 2025, 54(2): 174-177
-
文章历史
- 收稿日期:2024-03-29
- 网络出版时间:2025-01-15 17:43:16
2. 联勤保障部队第九四〇医院肿瘤科, 兰州 730050;
3. 甘肃中医药大学第一临床医学院专硕2班, 兰州 730030
食管气管瘘是食管和气管之间的病理性通道,与恶性肿瘤、感染、创伤等因素有关,可分为良性食管气管瘘和恶性食管气管瘘[1]。因瘘口所致的反复肺部感染、大出血和营养不良等并发症及恶性肿瘤本身病变,导致恶性食管气管瘘预后不良。恶性食管气管瘘治疗方案主要有外科手术、气管或食管支架置入、最佳支持治疗[2],但上述方法并不能控制肿瘤,治疗效果差,生存期短。
本文报道了1例就诊于联勤保障部队第九四〇医院的晚期食管鳞状细胞癌病例,在免疫检查点抑制剂(immune checkpoint inhibitor,ICI) 卡瑞利珠单抗联合化疗的过程中,发生食管气管瘘,在对症治疗的基础上,使用卡瑞利珠单抗再治疗,最终瘘口愈合,并获得持久的免疫应答,随访瘘口无复发。
1 临床资料患者,男,55岁,身高173 cm,体重55 kg,体表面积1.61 m2。患者因进食哽噎于2022年6月就诊于兰州大学第一医院,行电子胃镜检查,内镜下活检病理结果为食管中高分化鳞状细胞癌,PD-L1表达未知。于2022年9月5日、9月27日、10月24日共进行3周期TP方案(紫杉醇+顺铂) 化疗,治疗后进食哽噎症状缓解。2023年3月因肠梗阻就诊于联勤保障部队第九四〇医院普外科,给予对症治疗后肠梗阻解除,以食管癌为诊断转入联勤保障部队第九四〇医院肿瘤科。胸部计算机断层扫描(computed tomography,CT) 显示,食管胸上中段食管癌,侵犯食管壁全层及气管,突入气管腔并管腔狭窄(图 1A);双肺散在结节,考虑转移瘤(图 1B、1C)。于2023年3月31日、4月25日给予2周期卡瑞利珠单抗联合吉西他滨+奈达铂方案抗肿瘤治疗。具体用药如下:卡瑞利珠单抗200 mg静脉滴注第1天,吉西他滨1 000 mg/m2静脉滴注第1、第8天,奈达铂80 mg/m2静脉滴注第1天,每3周1次。
|
| A,治疗前食管癌侵犯气管并气管狭窄(箭头所示为食管癌病变处);B,C,治疗前肺结节影(箭头所示为肺结节);D,治疗中食管癌侵犯气管,食管气管瘘(箭头所示为瘘口处);E,F,治疗中肺结节影(箭头所示为肺结节);G,治疗后食管癌侵犯气管病灶明显消退,瘘口闭合(箭头所示为原瘘口处);H,I,治疗后肺结节影(箭头所示为肺结节). 图 1 治疗前、中、后胸部CT图像 |
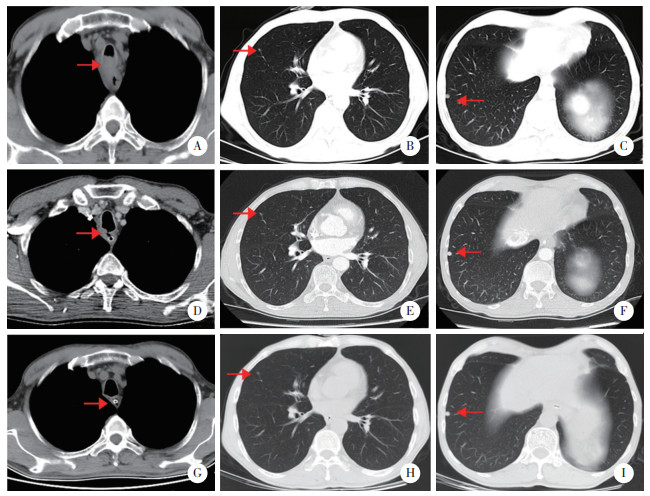
患者于2023年5月4日出现咳嗽、气短,痰中带血,无饮水呛咳,无心慌、胸闷、胸痛,无寒战、发热,复查胸部CT考虑食管癌侵犯支气管并管腔狭窄,食管气管瘘(图 1D),双肺多发结节(图 1E、1F);进一步完善上消化道造影,食管上段可见长约15 mm狭窄段,管壁僵硬,造影剂通过受阻,相应处黏膜破坏、中断,并见不规则龛影及充盈缺损,疑似食管癌(上段) 并食管气管瘘(图 2A、2B)。实验室检查未见明显异常。患者及家属拒绝行气管支架置入,经肿瘤多学科会诊,建议在胃空肠营养管置入、营养支持的基础上,继续原方案抗肿瘤治疗。于2023年6月13日、7月11日、8月16日继续行3周期卡瑞利珠单抗联合吉西他滨+奈达铂方案治疗,治疗期间患者无血细胞减少、纳差、免疫相关不良反应发生。2023年9月20日复查胸部CT示食管气管瘘闭合(图 1G);双肺多发结节,考虑纤维硬化灶,部分不除外转移瘤(图 1H、1I)。
|
| A,B,治疗中造影提示食管气管瘘形成;C,D,治疗后复查造影提示食管气管瘘瘘口闭合(红色箭头所指为病变处). 图 2 治疗中及治疗后上消化道造影图像 |
复查上消化道造影,结果与2023年5月5日上消化道造影结果比较,食管癌(上段) 并食管气管瘘瘘口闭合(图 2C、2D)。
2023年9月20日至2024年1月29日继续完成5周期卡瑞利珠单抗联合吉西他滨+奈达铂治疗,疗效评估为部分缓解,随访至2024年2月肿瘤未进展。
本研究获得武威市凉州医院医学伦理委员会批准(审批号:lyll2024007)。
2 讨论美国癌症统计数据[3]显示,2023年估计食管癌新发病例约21 560例,死亡病例约16 120例。食管气管瘘是食管癌的少见并发症,其发生率约为4.3%~13.1%[4-5],严重威胁患者的生命健康,诊断后的中位生存时间不足3个月[6]。食管癌引起的食管气管瘘与肿瘤侵袭或治疗相关,肿瘤相关危险因素主要包括肿瘤晚期、肿瘤位于食管上中段、肿瘤累及气管、肿瘤较大等;治疗相关危险因素主要有食管支架置入、既往有食管放疗史等[7],另外,亦有抗肿瘤药物致食管气管瘘的报道,如抗血管生成药贝伐珠单抗致食管气管瘘[8],YOU等[9]报道了1例晚期食管鳞状细胞癌患者在一线使用替雷利珠单抗联合白蛋白紫杉醇+奈达铂治疗过程中出现食管气管瘘,考虑与免疫治疗相关。本例患者同样在卡瑞利珠单抗联合吉西他滨+奈达铂抗肿瘤治疗中出现食管气管瘘,考虑食管气管瘘的形成与卡瑞利珠单抗治疗有关。
食管癌引起的食管气管瘘的治疗方案以姑息为主,包括食管支架置入、气管或支气管支架置入、食管气管双支架置入、胃或空肠造瘘及支持治疗等[10]。本例患者为食管鳞状细胞癌晚期,气管狭窄,食管气管瘘形成,无外科手术指征,气管支架置入可快速缓解症状,但患者及家属拒绝支架置入、胃空肠造瘘等有创治疗,经肿瘤多学科会诊,考虑食管气管瘘形成与肿瘤快速消退有关,建议先置入胃空肠营养管、肠内营养支持,改善患者一般状态,再继续原方案抗肿瘤治疗。
卡瑞利珠单抗是我国自主研发的一种人源化PD-1单克隆抗体,可改善既往接受过化疗的晚期或转移性食管癌患者的生存率。研究[11-12]发现,针对晚期或转移性食管癌患者,与单纯化疗组比较,卡瑞利珠单抗联合化疗(紫杉醇+顺铂) 组的中位总生存期(overall survival,OS) 和无进展生存期(progression-free survival,PFS)、客观缓解率(objective response rate,ORR) 均显著优于化疗组。考虑到ICI在晚期食管癌治疗中的良好临床获益,将卡瑞利珠单抗联合吉西他滨+奈达铂作为本例患者的二线治疗方案。
免疫治疗致食管气管瘘的机制尚不明确,推测可能与肿瘤细胞坏死、肿瘤快速消退和组织愈合不良有关[6],有文献[9]报道使用ICI后发生食管气管瘘。临床工作中,对具有食管气管瘘高危因素的患者应提高警惕,避免食管损伤的有创操作和胸部高剂量放疗等诱发因素,治疗过程中严密监测,预防食管气管瘘的发生。
目前,关于免疫再挑战或再治疗的研究较少。HU等[13]的综述显示,免疫再挑战及正在进行的临床试验主要应用于非小细胞肺癌和恶性黑色素瘤。国外1项试验[14]纳入了38例因免疫相关不良事件停药后再接受免疫治疗的晚期非小细胞肺癌患者,结果显示,18例(48%) 患者无后续免疫相关不良事件,10例(26%) 初始免疫相关不良反应复发,10例(26%) 有新的免疫相关不良事件发生,大多数不良反应是轻度、可控的;疗效方面,再治疗后PFS和OS均有改善。国内也有相似的研究[15],结果显示晚期肺癌免疫再挑战组的OS优于免疫未挑战组(HR = 0.176,95%CI:0.065~0.047,P = 0.001)。以上研究均表明免疫再挑战安全且有效。此外,初始免疫治疗的疗效可作为免疫再治疗的良好指标。本例患者行2周期ICI联合化疗后肿瘤消退明显,疗效评估PR,因此,选择原本的ICI再治疗,继续给予卡瑞利珠单抗联合吉西他滨+奈达铂治疗。经4周期治疗后食管气管瘘瘘口闭合,原发肿瘤消退明显,并在后续维持治疗中获得持久免疫应答,发生食管气管瘘后生存时间超过10个月,瘘口无复发迹象。
食管气管瘘是肿瘤进展或治疗所致的并发症,预后差。对于无法或不愿意行外科手术及食管气管支架置入治疗的患者,免疫治疗是一种可选的治疗策略,需在严密观察下进行,以期改善患者的预后。
| [1] |
NI P, YE S, XIONG ST, et al. Nanocomposite hydrogel based on chitosan/laponite for sealing and repairing tracheoesophageal fistula[J]. Int J Biol Macromol, 2023, 250: 126177. DOI:10.1016/j.ijbiomac.2023.126177 |
| [2] |
LI YX, ZHANG MM, LIU PN, et al. Tracheoesophageal fistula treated with magnetic compression technique in canines[J]. Sci Rep, 2023, 13(1): 4830. DOI:10.1038/s41598-023-31903-2 |
| [3] |
SIEGEL RL, MILLER KD, WAGLE NS, et al. Cancer statistics, 2023[J]. CA A Cancer J Clinicians, 2023, 73(1): 17-48. DOI:10.3322/caac.21763 |
| [4] |
GRASS JK, KÜSTERS N, VON DÖHREN FL, et al. Management of esophageal cancer-associated respiratory-digestive tract fistulas[J]. Cancers, 2022, 14(5): 1220. DOI:10.3390/cancers14051220 |
| [5] |
GOH KJ, LEE P, FOO AZX, et al. Characteristics and outcomes of airway involvement in esophageal cancer[J]. Ann Thorac Surg, 2021, 112(3): 912-920. DOI:10.1016/j.athoracsur.2020.10.015 |
| [6] |
KIM HS, KHEMASUWAN D, DIAZ-MENDOZA J, et al. Management of tracheo-oesophageal fistula in adults[J]. Eur Respir Rev, 2020, 29(158): 200094. DOI:10.1183/16000617.0094-2020 |
| [7] |
陈伟庄, 吴宏成. 获得性气道瘘的治疗进展[J]. 现代实用医学, 2022, 34(1): 6-8, 43. DOI:10.3969/j.issn.1671-0800.2022.01.003 |
| [8] |
SPIGEL DR, HAINSWORTH JD, YARDLEY DA, et al. Tracheo- esophageal fistula formation in patients with lung cancer treated with chemoradiation and bevacizumab[J]. J Clin Oncol, 2010, 28(1): 43-48. DOI:10.1200/JCO.2009.24.7353 |
| [9] |
YOU MY, LI W, TAN GL, et al. Successful management of a giant cervical thoracic tracheoesophageal fistula using endoscopic repair and two-stage reconstruction[J]. Asian J Surg, 2024, 47(4): 2078-2079. DOI:10.1016/j.asjsur.2024.01.010 |
| [10] |
吴彤, 周云芝, 徐淑凤, 等. 气管食管瘘临床诊疗研究进展[J]. 解放军医学杂志, 2023, 48(12): 1473-1477. DOI:10.11855/j.issn.0577-7402.0426.2023.0731 |
| [11] |
LUO HY, LU J, BAI YX, et al. Effect of camrelizumab vs placebo added to chemotherapy on survival and progression-free survival in patients with advanced or metastatic esophageal squamous cell carcinoma: the ESCORT-1st randomized clinical trial[J]. JAMA, 2021, 326(10): 916-925. DOI:10.1001/jama.2021.12836 |
| [12] |
QIN SK, CHAN SL, GU SZ, et al. Camrelizumab plus rivoceranib versus sorafenib as first-line therapy for unresectable hepatocellular carcinoma (CARES-310): a randomised, open-label, international phase 3 study[J]. Lancet, 2023, 402(10408): 1133-1146. DOI:10.1016/S0140-6736(23)00961-3 |
| [13] |
HU H, WANG K, JIA R, et al. Current status in rechallenge of immunotherapy[J]. Int J Biol Sci, 2023, 19(8): 2428-2442. DOI:10.7150/ijbs.82776 |
| [14] |
SANTINI FC, RIZVI H, PLODKOWSKI AJ, et al. Safety and efficacy of re-treating with immunotherapy after immune-related adverse events in patients with NSCLC[J]. Cancer Immunol Res, 2018, 6(9): 1093-1099. DOI:10.1158/2326-6066.CIR-17-0755 |
| [15] |
YANG J, ZENG R, ZHOU JP, et al. Efficacy, prognosis and safety analysis of anti-PD-1/PD-L1 inhibitor rechallenge in advanced lung cancer patients: a cohort study[J]. Transl Lung Cancer Res, 2022, 11(6): 1038-1050. DOI:10.21037/tlcr-22-360 |
 2025, Vol. 54
2025, Vol. 54