文章信息
- 殷宗宝, 余燕梅, 刘凡
- YIN Zongbao, YU Yanmei, LIU Fan
- N型乙酰胆碱受体对急性呼吸窘迫综合征小鼠炎症反应的影响
- Effect of N-type acetylcholine receptor on inflammation in mouse model of acute respiratory distress syndrome
- 中国医科大学学报, 2025, 54(2): 133-138
- Journal of China Medical University, 2025, 54(2): 133-138
-
文章历史
- 收稿日期:2023-12-14
- 网络出版时间:2025-01-15 17:15:13
N型乙酰胆碱受体(nicotinic acetylcholine receptor,nAChR)是胆碱能抗炎通路(cholinergic anti-inflammatory pathway,CAP)的作用受体,存在于多种免疫细胞的表面,也存在于肺上皮细胞及肺泡固有巨噬细胞中[1-2],可与迷走神经分泌的乙酰胆碱(acetylcholine,ACh)结合,发挥抑制炎症的作用。T淋巴细胞作为免疫系统的重要调节细胞之一,不仅能抑制过度免疫反应引起的炎症反应,还能调节免疫应答的作用范围、反应程度和持续时间[3-4]。急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是因肺实质发生急性弥漫性损伤而导致的以急性呼吸窘迫和顽固性低氧血症为特征的临床综合征,T淋巴细胞的感染免疫调节在ARDS炎症反应CAP中的机制目前尚不明确。核因子κB(nuclear transcription factor-κB,NF-κB)是炎症反应中重要的核转录因子,磷酸化核因子κB(phosphorylated nuclear factor-κB,p-NF-κB)P65是NF-κB的主要标志[5-6]。白细胞介素-18(interleukin-18,IL-18)可诱导γ干扰素生成,促进T细胞活化,趋化多形核白细胞到达急性炎症部位[7]。关于IL-18和p-NF-κBP65在ARDS炎症反应中的作用报道较多,但激活nAChR后是否通过抑制p-NF-κBP65和IL-18的释放减轻ARDS目前尚未见报道。PD-1主要表达于活化的T淋巴细胞、自然杀伤细胞、B淋巴细胞,ARDS患者外周血T淋巴细胞PD-1过度表达与T淋巴细胞增殖能力降低、二重院内感染及病死率增加相关[8]。本研究拟探讨ACh与nAChR结合调节T淋巴细胞并影响PD-1的表达,从而减轻ARDS炎症反应的机制。
1 材料与方法 1.1 材料 1.1.1 主要试剂及仪器脂多糖内毒素(日本化药株式会社,进口许可证号X20000349);酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(美国RAPID Biotech公司),nAChR激动剂PNU 282987(北京索莱宝科技有限公司)。兔抗鼠p-NF-κBP65、PD-1及β-actin抗体、山羊抗兔IgG(美国Immuno Way Biotechnology公司)。流式细胞检测仪(LSRFO rtessalM型,美国BD公司),荧光显微镜(日本Olympus公司)。
1.1.2 实验动物及分组健康清洁级6周龄雄性BALB/c小鼠60只,体重(20±2)g,由湖北省实验动物研究中心提供[合格证号SCXK(鄂)2020-0018]。按照完全数字随机法分为正常组(N组)、生理盐水对照组(NS组)、生理盐水+切断颈部两侧迷走神经组(NS+D组)、ARDS+切断颈部两侧迷走神经组(A+D组)、ARDS组(A组)、ARDS+切断迷走神经给予nAChR受体激动剂组(A+J组),每组10只。
1.2 方法 1.2.1 ARDS小鼠模型建立A组参照王华兵等[9]的方法,以2%戊巴比妥钠经腹腔内注射麻醉小鼠后,将灌胃器插入其气道并缓慢注入含脂多糖内毒素的生理盐水(2 g/L,2 mg/kg),注入后立即旋转动物,使药液在肺内分布均匀。NS组:以与A组等量的生理盐水代替脂多糖内毒素气管内注入。NS+D组:以与A组等量的生理盐水代替脂多糖内毒素气管内注入后,切断小鼠颈部两侧迷走神经。A+D组:同A组造模后切断小鼠颈部两侧迷走神经。A+J组:同A组造模后切断小鼠颈部两侧迷走神经,腹腔注射PNU282987(2 mg/kg,1次/d,共3 d)。N组正常喂养无特殊处理。
1.2.2 标本采集各组小鼠造模成功后第4天,分别用2%戊巴比妥钠腹腔内注射麻醉,仰卧位开腹,取腹主动脉近心端全血2 mL,室温静置2 h后,3 000 r/min离心15 min,取上层血清冻存于-70 ℃备用。取小鼠右肺下叶,用4%多聚甲醛固定。取小鼠右肺中叶和左肺,于-80 ℃冻存。
1.2.3 病理组织学标本制作及观察取小鼠右肺下叶,用4%多聚甲醛固定,石蜡包埋后制成3 μm厚切片。经二甲苯脱蜡、无水乙醇洗蜡、95%乙醇洗片,抗原微波修复,95 ℃15 min,自然冷却至室温。正常羊血清封闭,37 ℃ 60 min,4 ℃过夜,用磷酸盐平衡生理盐水冲洗5 min,加入荧光素,避光37 ℃孵育60 min,防淬灭封片。荧光显微镜下观察。
1.2.4 血清IL-18和PD-1水平检测按照ELISA试剂盒的说明书,检测小鼠血清IL-18和PD-1水平。
1.2.5 p-NF-κBP65、PD-1蛋白表达检测用Western blotting检测小鼠肺组织p-NF-κBP65、PD-1蛋白表达情况。提取左肺组织总蛋白,BCA试剂盒检测蛋白含量。蛋白上样,行8%SDS-PAGE电泳,转至聚偏氟乙烯膜。5%牛血清白蛋白室温封闭2 h。分别加入兔抗鼠p-NF-κBP65、PD-1及内参β-actin抗体,4 ℃孵育过夜。山羊抗兔IgG室温孵育2 h。检测蛋白相对表达水平。
1.2.6 肺组织淋巴细胞分离及T淋巴细胞亚群测定无菌条件下分离小鼠右肺中叶,加入1 mL 4 ℃预冷PBS,研磨至匀浆;用10 mL冷PBS冲洗,收集细胞悬液,经200目尼龙网过滤,2 500 r/min离心20 min,去除细胞碎片,用PBS洗3次,离心沉淀制成单细胞悬液;加荧光标记的CD3+和CD25+Foxp3+ FITC抗体各5 μL。加细胞裂解液,室温避光孵育20 min,加入PBS洗涤2次,2 000 r/min离心5 min,弃上清,加入500 μL PBS,用流式细胞仪检测,计算CD3+和CD25+Foxp3+T淋巴细胞的百分比。
1.3 统计学分析采用SPSS 20.0软件进行统计分析。计量资料以x±s表示,多组间比较采用方差分析,差异有统计学意义时采用LSD-t检验进一步进行两两比较。P < 0.05为差异有统计学意义。
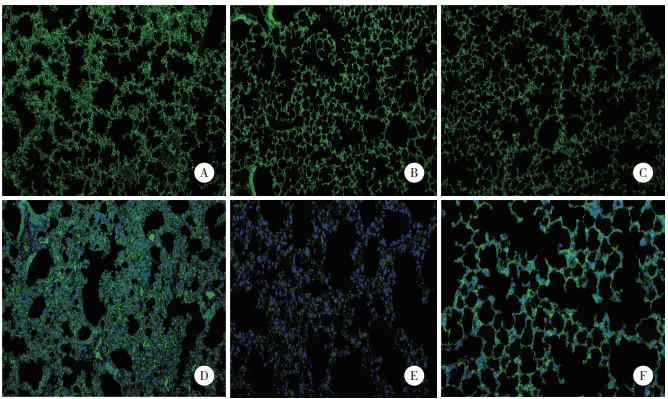
2 结果 2.1 各组小鼠肺组织病理变化N组和NS组小鼠右肺下叶间质无炎症细胞浸润;NS+D组右肺下叶间质有少量炎症细胞浸润;A组和A+D组小鼠右肺下叶间质有大量炎症细胞浸润、肺泡壁增厚、肺泡结构破坏,肺泡腔消失;A+J组小鼠右肺下叶间质炎症细胞浸润较少,肺泡腔有少许破损。见图 1。
|
| A, group N; B, group NS; C, group NS+D; D, group A; E, group A+D; F, group A+J. 图 1 各组小鼠肺组织病理变化 荧光染色×100 Fig.1 Pathological changes of the lung tissue of mice in each group Fluorescent staining ×100 |
2.2 各组小鼠血清IL-18和PD-1水平比较
ELISA结果显示,A组和A+D组小鼠血清IL-18和PD-1水平均高于其他4组,差异有统计学意义(P < 0.05)。A组和A+D组比较以及其他4组间比较差异无统计学意义。见表 1。
| Group | IL-18(pg/mL) | PD-1(ng/mL) |
| N | 35.51±16.831),2) | 2.40±0.481),2) |
| NS | 36.94±12.661),2) | 2.46±0.541),2) |
| NS+D | 41.54±14.211),2) | 3.72±0.561),2) |
| A | 111.35±36.81 | 8.59±0.76 |
| A+D | 124.44±27.54 | 9.77±0.81 |
| A+J | 73.26±33.391),2) | 5.80±1.051),2) |
| 1)P < 0.05 vs. group A;2)P < 0.05 vs. group A+D. | ||
2.3 各组小鼠左肺p-NF-κBP65、PD-1表达情况比较
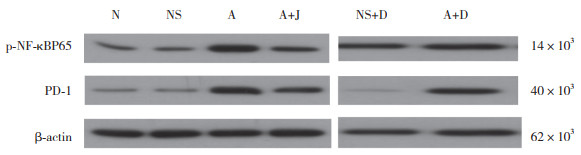
Western blotting结果显示,A组和A+D组小鼠左肺组织p-NF-κBP65及PD-1的表达水平高于N组、NS组、NS+D组、A+J组,差异有统计学意义(P < 0.05)。A组和A+D组间比较以及其他4组间比较差异无统计学意义。见表 2、图 2。
| Group | p-NF-κBP65 | PD-1 |
| N | 0.34±0.221),2) | 0.55±0.341),2) |
| NS | 0.52±0.381),2) | 0.58±0.451),2) |
| NS+D | 0.82±0.131),2) | 0.76±0.351),2) |
| A | 2.16±1.07 | 2.86±0.28 |
| A+D | 2.37±0.86 | 2.91±0.17 |
| A+J | 1.21±0.601),2) | 1.22±0.211),2) |
| 1)P < 0.05 vs. group A;2)P < 0.05 vs. group A+D. | ||
|
| 图 2 各组小鼠左肺组织p-NF-κBP65和PD-1蛋白表达 Fig.2 Expression of p-NF-κBP65 and PD-1 protein in left lung tissue of mice in each group |
2.4 各组小鼠T淋巴细胞亚群的变化
A组和A+D组小鼠CD3+T淋巴细胞百分比高于其他4组,差异有统计学意义(P < 0.05)。A组和A+D组比较以及其他4组间比较差异无统计学意义。见表 3。
| Group | CD3+ | CD25+Foxp3+ |
| N | 2.66±0.551),2) | 3.01±0.791),2) |
| NS | 3.62±1.461),2) | 3.31±0.721),2) |
| NS+D | 4.47±0.621),2) | 4.17±0.561),2) |
| A | 8.55±1.07 | 8.98±0.91 |
| A+D | 9.78±0.88 | 9.84±1.11 |
| A+J | 5.94±0.271),2) | 5.00±1.151),2) |
| 1)P < 0.05 vs. group A;2)P < 0.05 vs. group A+D. | ||
3 讨论
激活迷走神经后,胆碱能神经元分泌的递质与其受体结合,对机体的炎症反应产生抑制效应,其神经调节通路为CAP。研究[10]表明,切断肺损伤动物模型颈部两侧迷走神经后,肺损伤加重,而激活nAChR可使肺损伤减轻。敲除小鼠nAChR基因或经颈部两侧切除迷走神经,肺损伤炎症细胞浸润程度和肺结构破坏程度增加,且病死率增高[11-12]。本研究中,通过荧光染色发现,N组和NS组小鼠右肺下叶结构未出现病理变化,NS+D组右肺下叶间质有少量炎症细胞浸润,A组和A+D组小鼠右肺下叶间质水肿、炎症细胞浸润、增厚,肺泡结构破坏,符合ARDS组织病理学特征,而A+J组小鼠右肺下叶间质炎症细胞浸润较轻、肺间质增厚不明显,肺泡基本结构破坏较少。说明激活nAChR可减轻ARDS小鼠的肺水肿、减少肺间质炎性渗出,减轻肺损伤的严重程度,从而保护肺泡结构的稳定性,与其他研究[11]结果一致。
NF-κB是一种核转录调节蛋白,参与多种炎症介质和免疫相关基因的转录和调控,是免疫炎症反应中多个信号通路的关键点和聚集点[5]。NF-κB是由P50和P65这2种多肽组合的二聚体,NF-κB的激活需要与其结合的抑制蛋白B的磷酸化[13]。抑制蛋白B磷酸化及降解使NF-κBP65磷酸化和核转位,形成p-NF-κBP65。p-NF-κBP65含有反式激活区,与靶基因转录元件相互作用而促进其转录,形成活化的NF-κB,因此,p-NF-κBP65在启动转录NF-κB并促使其活化中起重要作用[6]。本研究结果显示,在切断迷走神经并给予nAChR激动剂后,A+J组小鼠左肺组织中p-NF-κBP65含量较A组和A+D组小鼠的表达降低,说明刺激迷走神经后通过nAChR可以降低抑制蛋白NF-κB的磷酸化及降解,从而减少p-NF-κBP65的生成,使活化的NF-κB减少,减轻ARDS的炎症反应。IL-18不仅可以促进T淋巴细胞活化并趋化多形核白细胞向急性炎症区游走,且激活的IL-18与其受体结合形成复合体,通过NF-κB信号途径促进炎症“瀑布效应”发生,加重细胞损伤。ARDS早期血浆中IL-18浓度升高与ARDS患者的死亡及多器官功能衰竭相关,也有研究[7]表明抑制NF-κB可减少脂多糖所致ARDS大鼠血清IL-18含量升高,保护ARDS大鼠。研究[14-15]表明,抑制NF-κB信号途径可降低IL-18的转录水平,减轻ARDS大鼠炎症反应。本研究中,A+J组小鼠肺组织p-NF-κBP65蛋白含量和血清IL-18水平显著低于A组和A+D组,说明激活nAChR后可通过抑制p-NF-κBP65蛋白的生成,阻止NF-κB发生核转录、降低其活性,减少NF-κB的释放和活化,由此降低通过NF-κB信号途径产生的IL-18水平。有研究[16]表明,nAChR拮抗剂可增加细胞核内NF-κB的表达,逆转迷走神经电刺激的保护作用,本研究中A+J组小鼠肺组织的荧光染色所见也证实了这一结果。
PD-1是免疫细胞抑制性共刺激分子,通常在活化的T细胞、单核细胞、自然杀伤细胞、B细胞、树突状细胞上表达,在内皮细胞上也有表达[17]。活化的树突状细胞表面上的PD-1可以抑制NF-κB的生成,减轻炎症反应[18]。ARDS患者外周血PD-1过度表达与病死率相关,抑制PD-1过度表达可以降低ARDS的病死率[19]。临床研究[20-22]表明,脓毒症患者外周血PD-1明显升高,而且随着脓毒症的发展,PD-1水平也升高,阻断PD-1的生成可以改善脓毒症的临床症状,给予外源性PD-1抗体有助于脓毒症患者的恢复,因此PD-1是判断临床预后独立的预测指标。本研究中,A+J组小鼠左肺PD-1的含量及血清PD-1水平均低于A组和A+D组,说明激活nAChR可减少PD-1的表达,减轻ARDS炎症反应。
炎症反应是ARDS的本质,而过度的炎症反应会导致机体免疫调节机制失衡,其中细胞免疫功能紊乱与过度炎症反应的发生息息相关,两者叠加促进ARDS不断恶化[23]。T淋巴细胞亚群不仅是机体免疫细胞群的重要组成部分,也是检测细胞免疫功能的重要指标[24]。CD3+分布于T淋巴细胞表面,参与特异性抗原识别、活化和信号传导,反映机体的免疫状态,是鉴定T淋巴细胞的重要标记。CD3+T淋巴细胞是ARDS、重症肺炎等肺部疾病临床预后的重要监测指标[25-27]。CD25+和Foxp3+也是T淋巴细胞激活的标志[28]。本研究中,A组和A+D组的CD3+和CD25+Foxp3+T淋巴细胞百分比高于其他各组,提示细胞免疫紊乱在ARDS的发生中起重要作用,A+J组CD3+和CD25+Foxp3+T淋巴细胞百分比显著低于A组和A+D组,表明激活nAChR可以纠正ARDS的细胞免疫紊乱,减轻炎症反应。
综上所述,激活nAChR后,CAP不仅可以抑制PD-1、p-NF-κBP65和IL-18的生成,同时还可抑制p-NF-
κBP65活化,减少IL-18的释放,纠正细胞免疫系统T淋巴细胞过度激活,减轻ARDS小鼠的炎症反应,改善肺损伤。本研究的不足之处在于未从细胞水平阐明激活nAChR后的抗炎基因靶点和纠正T淋巴细胞紊乱的机制,以及如何通过活化的PD-1抑制p-NF-κBP65的活化,有待今后进一步研究。
| [1] |
LAM DCL, LUO SY, FU KH, et al. Nicotinic acetylcholine receptor expression in human airway correlates with lung function[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 310(3): L232-L239. DOI:10.1152/ajplung.00101.2015 |
| [2] |
张雨寒, 罗凤鸣. 慢性阻塞性肺疾病与毒蕈碱型胆碱能受体[J]. 中国呼吸与危重监护杂志, 2021, 20(9): 673-676. DOI:10.7507/1671-6205.201812005 |
| [3] |
黄林林, 张楠. 老年COPD患者Treg/Th17免疫失衡与急性加重发作的关系及预测预后价值分析[J]. 中国急救复苏与灾害医学杂志, 2023, 18(1): 94-97, 105. DOI:10.3969/j.issn.1673-6966.2023.01.023 |
| [4] |
曾娟, 罗世林, 蔡懿, 等. 老年COPD患者全身炎症反应综合征与Th17/Treg失衡及TGF-β水平变化的关系[J]. 国际呼吸杂志, 2023, 43(4): 419-424. DOI:10.3760/cma.j.cn131368-20221008-00878 |
| [5] |
YANG HL, QIAN H, LIU B, et al. Triptolide dose-dependently improves LPS-induced alveolar hypercoagulation and fibrinolysis inhibition through NF-κB inactivation in ARDS mice[J]. Biomedecine Pharmacother, 2021, 139: 111569. DOI:10.1016/j.biopha.2021.111569 |
| [6] |
ZHANG Q, LENARDO MJ, BALTIMORE D. 30 years of NF-κB: a blossoming of relevance to human pathobiology[J]. Cell, 2017, 168(1/2): 37-57. DOI:10.1016/j.cell.2016.12.012 |
| [7] |
向群, 殷宗宝. IL-18和ESM-1在急性呼吸窘迫综合征大鼠中的作用[J]. 国际呼吸杂志, 2020, 40(22): 1735-1740. DOI:10.3760/cma.j.cn131368-20191225-00038 |
| [8] |
徐畅, 李莉, 甄军海, 等. T细胞表面程序性死亡受体-1表达水平对脓毒症患者预后的预测价值[J]. 中华内科杂志, 2020, 59(10): 796-800. DOI:10.3760/cma.j.cn112138-20200306-00197 |
| [9] |
王华兵, 童延华, 徐玲文, 等. CD4+CD25+调节性T细胞/辅助性T细胞17失衡在急性肺损伤小鼠中的作用[J]. 中华急诊医学杂志, 2016, 25(7): 892-895. DOI:10.3760/cma.j.issn.1671-0282.2016.07.010 |
| [10] |
司亶, 马利军, 齐咏. α7烟碱型乙酰胆碱受体与呼吸系统疾病的研究进展[J]. 国际呼吸杂志, 2017, 37(24): 1907-1910. DOI:10.3760/cma.j.issn.1673-436X.2017.24.015 |
| [11] |
SU X, MATTHAY MA, MALIK AB. Requisite role of the cholinergic alpha7 nicotinic acetylcholine receptor pathway in suppressing Gram-negative sepsis-induced acute lung inflammatory injury[J]. J Immunol, 2010, 184(1): 401-410. DOI:10.4049/jimmunol.0901808 |
| [12] |
马莉, 冷玉芳, 张梦婕, 等. 胆碱能抗炎通路对器官的保护研究进展[J]. 兰州大学学报(医学版), 2020, 46(1): 10-15. DOI:10.13885/j.issn.1000-2812.2020.01.003 |
| [13] |
黎雪琴, 杨凯, 白雪, 等. 吡咯烷二硫代氨基甲酸酯通过抑制NF-κB活化改善脓毒症大鼠心肌损伤机制的研究[J]. 中华急诊医学杂志, 2022, 31(11): 1481-1485. DOI:10.3760/cma.j.issn.1671-0282.2022.11.008 |
| [14] |
FUJISHIMA S. Pathophysiology and biomarkers of acute respiratory distress syndrome[J]. J Intensive Care, 2014, 2(1): 32. DOI:10.1186/2052-0492-2-32 |
| [15] |
KONG GQ, HUANG X, WANG LP, et al. Astilbin alleviates LPS-induced ARDS by suppressing MAPK signaling pathway and protec- ting pulmonary endothelial glycocalyx[J]. Int Immunopharmacol, 2016, 36: 51-58. DOI:10.1016/j.intimp.2016.03.039 |
| [16] |
PENG S, HANG N, LIU W, et al. Andrographolide sulfonate ameliorates lipopolysaccharide-induced acute lung injury in mice by down-regulating MAPK and NF-κB pathways[J]. Acta Pharm Sin B, 2016, 6(3): 205-211. DOI:10.1016/j.apsb.2016.02.002 |
| [17] |
BOUSSIOTIS VA. Molecular and biochemical aspects of the PD-1 checkpoint pathway[J]. N Engl J Med, 2016, 375(18): 1767-1778. DOI:10.1056/nejmra1514296 |
| [18] |
TU CS, WANG ZF, XIANG E, et al. Human umbilical cord mesenchymal stem cells promote macrophage PD-L1 expression and atte- nuate acute lung injury in mice[J]. Curr Stem Cell Res Ther, 2022, 17(6): 564-575. DOI:10.2174/1574888X17666220127110332 |
| [19] |
LI W, TU J, LIU X, et al. Farnesyltransferase inhibitor FTI-277 inhibits PD-L1 expression on septic spleen lymphocytes and promotes spleen lymphocyte activation[J]. Clin Exp Immunol, 2017, 190(1): 8-18. DOI:10.1111/cei.12995 |
| [20] |
JIANG WQ, LI XS, DING HG, et al. PD-1 in Tregs predicts the survival in sepsis patients using sepsis-3 criteria: a prospective, two-stage study[J]. Int Immunopharmacol, 2020, 89(Pt A): 107175. DOI:10.1016/j.intimp.2020.107175 |
| [21] |
康秀文, 刘仁洋, 刘克喜, 等. 程序性死亡因子-1在腹腔感染致脓毒症患者外周血T细胞及中性粒细胞的表达[J]. 中华生物医学工程杂志, 2020, 26(3): 225-230. DOI:10.3760/cma.j.cn115668-20190228-00018 |
| [22] |
杨聿航, 谢剑锋, 杨毅. 程序性死亡受体1及其配体通路在脓毒症免疫细胞功能障碍中的作用研究[J]. 中华内科杂志, 2021, 60(6): 571-574. DOI:10.3760/cma.j.cn112138-20201225-01048 |
| [23] |
黄大伟, 孙金燕. T淋巴细胞亚群在ARDS患者中的变化及意义[J]. 国际检验医学杂志, 2019, 40(20): 2522-2524, 2528. DOI:10.3969/j.issn.1673-4130.2019.20.022 |
| [24] |
刘光伟. 病原体感染的天然免疫防御效应[J]. 科学通报, 2016, 61(27): 2986-2995. DOI:10.1360/N972016-00330 |
| [25] |
畅毅平, 张玉强, 张永利, 等. CD3+、CD4+、CD8+T细胞和CD39+B细胞在急性呼吸窘迫综合征发病中的作用[J]. 中华急诊医学杂志, 2018, 27(7): 769-773. DOI:10.3760/cma.j.issn.1671-0282.2018.07.012 |
| [26] |
于乃浩, 褚玉茹, 刘娜娜, 等. CD3+T淋巴细胞计数联合早期预警评分对重症肺炎患者28 d死亡风险的预测价值[J]. 中国现代医学杂志, 2023, 33(2): 72-77. DOI:10.3969/j.issn.1005-8982.2023.02.012 |
| [27] |
王亚通, 张东霞, 丁雪辉, 等. 肺炎支原体肺炎外周血淋巴细胞CD3+HLA-DR+表达水平与疾病严重程度及预后关系研究[J]. 创伤与急危重病医学, 2023, 11(1): 53-55. DOI:10.16048/j.issn.2095-5561.2023.01.13 |
| [28] |
KAWAKAMI R, KITAGAWA Y, CHEN KY, et al. Distinct Foxp3 enhancer elements coordinate development, maintenance, and function of regulatory T cells[J]. Immunity, 2021, 54(5): 947-961. DOI:10.1016/j.immuni.2021.04.005 |
 2025, Vol. 54
2025, Vol. 54