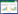文章信息
- 黄霁, 邓秀娟, 程显
- HUANG Ji, DENG Xiujuan, CHENG Xian
- LINC00839调节miR-625-5p/MSI1轴对子宫内膜癌细胞恶性生物学行为的影响
- Effect of LINC00839 on the malignant biological behavior of endometrial cancer cells by regulating the miR-625-5p/MSI1 axis
- 中国医科大学学报, 2025, 54(2): 121-126, 132
- Journal of China Medical University, 2025, 54(2): 121-126, 132
-
文章历史
- 收稿日期:2023-11-13
- 网络出版时间:2025-01-15 16:19:27
子宫内膜癌(endometrial cancer,EC)是全世界范围内发病率和死亡率较高的妇科恶性肿瘤之一[1]。近年来,EC的发病率逐年上升,EC患者因复发和远处转移而预后较差[2]。因此,进一步研究EC相关基因是了解EC分子机制的重要方向。长链非编码RNA(long non-coding RNA,lncRNA)在多种肿瘤中异常表达,并与肿瘤的恶性转化密切相关。LINC00839已被证明是多种人类恶性肿瘤的促癌因子,如LINC00839介导H460肺癌细胞的凋亡、迁移和侵袭[3],LINC00839还促进结直肠癌进展[4]。而LINC00839在EC中的表达和作用机制尚不清楚。通过StarBase预测发现,miR-625-5p是LINC00839的靶基因。miR-625-5p在EC组织和细胞中表达水平降低,参与EC进展[5]。MSI1是一种神经RNA结合蛋白,敲低MSI1可抑制EC生长,提高细胞对辐射的敏感性[6]。
本研究探讨了LINC00839对EC细胞恶性生物学行为及miR-625-5p/MSI1轴的影响,以期为EC的治疗提供依据。
1 材料与方法 1.1 临床样本收集收集2022年3月至2023年9月在我院接受手术治疗的52例EC患者的肿瘤组织和配对的癌旁组织。所有患者术前均未接受放疗或化疗。所有标本切除后立即放入液氮中冻存。本研究经我院医学伦理委员会批准(LLSC-2021-226),所有患者签署知情同意书。
1.2 细胞系EC细胞系KLE、HEC-1A、Ishikawa和RL-952以及人子宫内膜上皮细胞系hEEC,购自ATCC。
1.3 试剂和仪器LINC00839短发夹RNA(sh-LINC00839)及其对照(sh-NC)、miR-625-5p抑制剂(anti-miR-625-5p)及其对照(anti-miR-NC)、miR-625-5p模拟物(miR-625-5p mimics)及其对照(mimics-NC)、MSI1过表达质粒(pcDNA-MSI1,后续研究以MSI1表示)及其对照(pcDNA),合成于上海吉玛制药技术有限公司;反转录试剂盒,购自沈阳万类生物科技有限公司;实时定量PCR试剂盒,购自天根生化科技(北京)有限公司;CCK-8试剂盒,购自弗元(上海)生物科技有限公司;Annexin VFITC/PI检测试剂盒,购自南京诺唯赞生物科技股份有限公司;双萤光素酶报告基因检测试剂盒,购自和元李记(上海)生物技术有限公司;RNA结合蛋白免疫沉淀(RNA-binding protein immunoprecipitation,RIP)试剂盒,购自美国Merck公司;兔源一抗MSI1、Bcl-2、Bax、MMP-2、MMP-9、GAPDH及HRP标记的羊抗兔二抗,购自英国abcam公司。
1.4 实验方法 1.4.1 细胞培养、转染和分组所有细胞均在添加10%胎牛血清和1%青霉素-链霉素的DMEM中培养,保存于37 ℃、含5%CO2的培养箱中。使用Lipofectamine 2000试剂将指定的质粒转染至Ishikawa细胞中,转染48 h。将细胞分为sh-NC组、sh-LINC00839组、sh-LINC00839+anti-miR-NC组、sh-LINC00839+anti-miR-625-5p组、mimics-NC组、miR-625-5p mimics组、miR-625-5p mimics+pcDNA组、miR-625-5p mimics+MSI1组。
1.4.2 实时定量PCR使用TRIzol从组织和细胞中提取RNA,反转录成cDNA,使用PCR试剂盒进行实时定量PCR。实时定量PCR反应条件:95 ℃初始变性30 s,随后95 ℃ 5 s,60 ℃ 10 s,72 ℃ 15 s,35~40个循环。以GAPDH、U6为内参,采用2-ΔΔCt法分析LINC00839、miR-625-5p、MSI1 mRNA相对表达量。引物序列:LINC00839,正向5’-GCTCTCAAGGCTGTTTTCCC-3’,反向5’-ACATGCACAGAGGGTTGACT-3’;miR-625-5p,正向5’-CTCTGCTTGACTGTGCTG-3’,反向5’-TACCAGAACCTAACCAACTG-3’;MSI1,正向5’-GCTCGACTCCAAAACAATTGACC-3’,反向5’-GGCTGAGCTTTCTTACATTCCAC-3’;U6,正向5’-AAAGCAAATCATCGGACGACC-3’,反向5’-GTACAACACATTGTTTCCTCGGA-3’;GAPDH,正向5’-GGAGAAGCTGAGTCATGGGT-3’,反向5’-GGTGGGAGATCTGGTTTCCG-3’。
1.4.3 双萤光素酶报告基因实验将含有预测miR-625-5p结合位点的野生型(wildtype,WT)或突变型(mutant,MUT)LINC00839序列或来自MSI1 mRNA的WT 3’非翻译区或MUT 3’非翻译区片段插入到pmiRGLO载体中,构建报告载体LINC00839-WT、LINC00839-MUT、MSI1-WT、MSI1-MUT。将相应载体和miR-625-5p mimics或mimics-NC共转染到Ishikawa细胞中,孵育48 h,采用双萤光素酶报告系统评估萤光素酶活性。
1.4.4 RIP实验取1×107个Ishikawa细胞,用RIPA裂解液裂解,分别与经抗Ago2或IgG偶联的磁珠孵育(IgG作为阴性对照)。实时定量PCR检测微珠富集的LINC00839、miR-625-5p和MSI1水平。
1.4.5 细胞增殖测定 1.4.5.1 CCK-8法将各组Ishikawa细胞接种于96孔板中,37 ℃培养24、48和72 h后,加入10 μL CCK-8,37 ℃孵育2 h后,测量450 nm处的光密度(optical density,OD)。
1.4.5.2 集落形成实验将各组Ishikawa细胞(1×103个)接种于6孔板中约2周,甲醇固定后,0.1%结晶紫染色,计算集落形成数。
1.4.6 细胞凋亡测定将各组Ishikawa细胞(1×106个)用1×PBS洗涤2次,重悬,在细胞重悬液中加入5 μL Annexin V-FITC和5 μL PI,避光孵育30 min。采用流式细胞仪检测凋亡细胞百分比。
1.4.7 细胞侵袭和迁移测定将各组Ishikawa细胞用胰蛋白酶消化并悬浮在不含胎牛血清的DMEM培养基中,Transwell上室接种5×105个细胞,下室加入含10%胎牛血清的DMEM,24 h后弃培养基,4%多聚甲醛室温固定细胞10 min,0.5%结晶紫染色20 min。在Leica AM6000显微镜(德国Leica Biosystems公司)下计数迁移细胞数。侵袭实验用基质胶预先包被Transwell小室,其余步骤与上述实验相同。
1.4.8 Western blotting检测蛋白表达使用RIPA裂解缓冲液提取总蛋白,应用BCA蛋白试剂盒对总蛋白进行定量,将10 μg蛋白用于SDS-PAGE,并转移到PVDF膜上。5%脱脂乳封闭1 h后,与一抗MSI1、Bcl-2、Bax、MMP-2、MMP-9在4 ℃下孵育过夜。加入与辣根过氧化物酶结合的二抗孵育1 h。应用ECL试剂观察蛋白条带,应用ImageJ软件进行定量分析。
1.4.9 体内成瘤实验BALB/c裸鼠12只,雌性,6周龄,体重(13.8±1.9)g,购自济南朋悦实验动物繁育有限公司,饲养于无特定病原体环境中。1周后,随机分为sh-NC组和sh-LINC00839组,每组6只,分别于右侧腋窝皮下接种稳定转染sh-NC或sh-LINC00839的Ishikawa细胞(1 × 107个)。每周计算肿瘤体积,4周后处死小鼠,将肿瘤称重并拍照。采用实时定量PCR和免疫组织化学方法检测靶分子的表达水平。
1.5 统计学分析采用SPSS 22.0软件进行统计分析。计量资料用x±s表示,多组间比较用单因素方差分析,两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2 结果 2.1 LINC00839、miR-625-5p、MSI1在EC组织和细胞中的表达癌旁组织和EC组织中,LINC00839、miR-625-5p、MSI1 mRNA、MSI1蛋白的表达水平分别为1.00±0.11和1.72±0.19、1.02±0.11和0.45±0.07、1.01±0.10和1.57±0.17、0.45±0.07和0.78±0.08。与癌旁组织比较,EC组织中LINC00839、MSI1 mRNA、MSI1蛋白表达水平升高,miR-625-5p表达水平降低(P < 0.05)。见图 1A。
|
| A, expression of MSI1 protein in EC and adjacent tissues; B, expression of MSI1 protein in hEEC, KLE, HEC-1A, Ishikawa, and RL-952 cells. 图 1 EC组织和细胞中MSI1蛋白的表达 Fig.1 MSI1 protein expression in EC tissues and cells |
与hEEC细胞相比,KLE、HEC-1A、Ishikawa、RL-952细胞中LINC00839、MSI1 mRNA、MSI1蛋白表达水平升高,miR-625-5p表达水平降低(P < 0.05),其中Ishikawa细胞变化最显著,选择Ishikawa细胞进行后续实验。见图 1B、表 1。
| Cell | n | LINC00839 | miR-625-5p | MSI1 mRNA | MSI1 protein |
| hEEC | 6 | 1.00±0.10 | 1.01±0.10 | 1.03±0.12 | 0.42±0.05 |
| KLE | 6 | 1.55±0.161) | 0.55±0.071) | 1.61±0.181) | 1.05±0.111) |
| HEC-1A | 6 | 1.39±0.151) | 0.68±0.061) | 1.44±0.151) | 0.98±0.101) |
| Ishikawa | 6 | 1.82±0.201) | 0.32±0.041) | 1.71±0.181) | 1.25±0.131) |
| RL-952 | 6 | 1.63±0.171) | 0.46±0.051) | 1.69±0.171) | 1.10±0.121) |
| 1)P < 0.05 vs. hEEC cells. | |||||
2.2 LINC00839靶向调控miR-625-5p表达
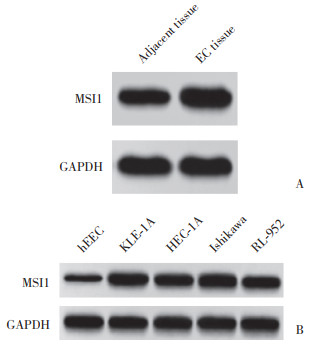
StarBase预测发现,LINC00839与miR-625-5p存在结合位点,见图 2A。LINC00839-WT中,与mimics-NC组相比,miR-625-5p mimics组相对萤光素酶活性降低(P < 0.05),见图 2B。与IgG组相比,Ago2蛋白富集的LINC00839、miR-625-5p增加(P < 0.05),见图 2C。
|
| A, prediction of the relationship between LINC00839 and miR-625-5p targeting; B, results of the dual-luciferase reporter gene assay; C, results of the RIP assay. *P < 0.05 vs. mimics-NC or IgG groups. 图 2 LINC00839靶向调控miR-625-5p表达 Fig.2 LINC00839 targets and regulates miR-625-5p expression |
Ishikawa细胞中,sh-NC组、sh-LINC00839组、sh-LINC00839+anti-miR-NC组、sh-LINC00839+anti-miR-625-5p组LINC00839表达水平分别为1.01±0.11、0.38±0.04、0.35±0.05、0.36±0.04,miR-625-5p表达水平分别为1.05±0.14、1.71±0.18、1.75±0.17、0.92±0.10。与sh-NC组比较,sh-LINC00839组LINC00839表达水平降低,miR-625-5p表达水平升高(P < 0.05);与sh-LINC00839+anti-miR-NC组比较,sh-LINC00839+anti-miR-625-5p组miR-625-5p表达水平降低(P < 0.05)。
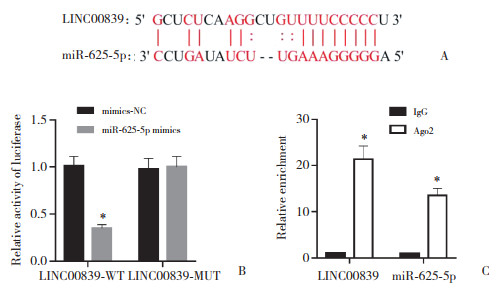
2.3 LINC00839靶向调控miR-625-5p对Ishikawa细胞生物学行为的影响与sh-NC组比较,sh-LINC00839组OD值(24、48和72 h)、集落形成数、迁移细胞数、侵袭细胞数、Bcl-2、MMP-2、MMP-9蛋白表达水平降低,凋亡率、Bax蛋白表达水平升高(P < 0.05);与sh-LINC00839+anti-miR-NC组比较,sh-LINC00839+anti-miR-625-5p组上述指标变化均呈相反趋势(P < 0.05),见图 3、表 2。
|
| *P < 0.05 vs. sh-NC group; #P < 0.05 vs. sh-LINC00839+anti-miR-NC group. 图 3 LINC00839靶向调控miR-625-5p对Ishikawa细胞OD值的影响 Fig.3 Effect of LINC00839-targeted regulation of miR-625-5p on the OD value of Ishikawa cells |
| Item | sh-NC group(n = 6) | sh-LINC00839 group(n = 6) | sh-LINC00839+anti-miR-NC group(n = 6) | sh-LINC00839+anti-miR-625-5p group(n = 6) |
| Number of colony formation | 152.37±16.86 | 86.10±8.721) | 85.38±8.42 | 139.05±13.582) |
| Apoptosis(%) | 5.83±0.76 | 22.57±2.851) | 23.16±2.52 | 8.15±0.922) |
| Number of migrating cells | 135.72±14.62 | 68.45±6.581) | 65.73±6.69 | 112.47±13.502) |
| Number of invading cells | 108.25±10.08 | 47.53±4.821) | 48.26±4.38 | 95.37±9.422) |
| Bcl-2 protein | 0.95±0.10 | 0.42±0.051) | 0.45±0.06 | 0.88±0.092) |
| Bax protein | 0.38±0.05 | 0.85±0.091) | 0.89±0.10 | 0.42±0.062) |
| MMP-2 protein | 0.51±0.06 | 0.27±0.031) | 0.25±0.04 | 0.62±0.072) |
| MMP-9 protein | 0.99±0.10 | 0.42±0.061) | 0.40±0.05 | 0.82±0.092) |
| 1)P < 0.05 vs. sh-NC group;2)P < 0.05 vs. sh-LINC00839+anti-miR-NC group. | ||||
2.4 miR-625-5p与MSI1靶向关系的验证
StarBase预测发现,miR-625-5p与MSI1存在结合位点,见图 4A。MSI1-WT中,与mimics-NC组比较,miR-625-5p mimics组相对萤光素酶活性降低(P < 0.05),见图 4B。
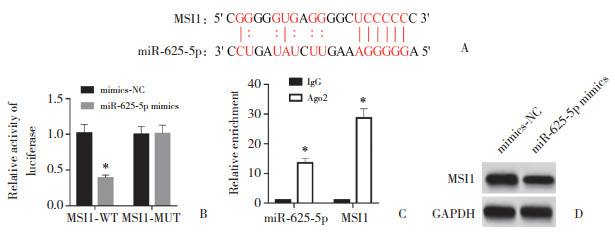
|
| A, prediction of the relationship between miR-625-5p and MSI1 targeting; B, results of the dual-luciferase reporter gene assay; C, results of the RIP assay; D, results of Western blotting. *P < 0.05 vs. mimics-NC or IgG groups. 图 4 miR-625-5p与MSI1靶向关系的验证 Fig.4 Validation of miR-625-5p and MSI1 targeting relationship |
与IgG组相比,Ago2蛋白富集的miR-625-5p、MSI1显著增加(P < 0.05),见图 4C。Ishikawa细胞中,与mimics-NC组比较,miR-625-5p mimics组miR-625-5p表达水平升高(1.59±0.16和1.00±0.10,P < 0.05),MSI1 mRNA和蛋白表达水平降低(0.48±0.06和1.00± 0.11,0.68±0.07和1.05±0.12,均P < 0.05),见图 4D。
2.5 miR-625-5p靶向调控MSI1对Ishikawa细胞生物学行为的影响与mimics-NC组比较,miR-625-5p mimics组OD值(24、48、72 h)、集落形成数、迁移细胞数、侵袭细胞数、Bcl-2、MMP-2、MMP-9蛋白表达水平降低,凋亡率、Bax蛋白表达水平升高(P < 0.05);与miR-625-5p mimics+pcDNA组比较,miR-625-5p mimics+MSI1组上述指标变化均呈相反趋势(P < 0.05),见图 5、表 3。
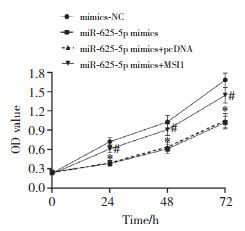
|
| *P < 0.05 vs. mimics-NC; #P < 0.05 vs. miR-625-5p mimics+pcDNA. 图 5 miR-625-5p靶向调控MSI1对Ishikawa细胞OD值的影响 Fig.5 Effect of miR-625-5p-targeted regulation of MSI1 on the OD value of Ishikawa cells |
| Item | mimics-NC group(n = 6) | miR-625-5p mimics group(n = 6) | miR-625-5p mimics+pcDNA group(n = 6) | miR-625-5p mimics+MSI1 group(n = 6) |
| Number of colony formations | 148.22±12.64 | 88.09±8.921) | 86.31±8.95 | 135.19±14.692) |
| Apoptosis(%) | 6.38±0.79 | 25.74±2.841) | 27.35±2.81 | 8.84±0.912) |
| Number of migrating cells | 147.35±15.22 | 71.43±7.911) | 76.38±7.79 | 125.38±13.742) |
| Number of invading cells | 103.62±12.70 | 51.63±5.291) | 53.85±5.81 | 97.18±9.262) |
| Bcl-2 protein | 0.91±0.12 | 0.38±0.051) | 0.40±0.04 | 0.85±0.092) |
| Bax protein | 0.37±0.04 | 0.93±0.101) | 0.90±0.12 | 0.45±0.052) |
| MMP-2 protein | 0.92±0.10 | 0.51±0.071) | 0.55±0.06 | 0.88±0.092) |
| MMP-9 protein | 1.02±0.10 | 0.48±0.061) | 0.45±0.05 | 0.85±0.102) |
| 1)P < 0.05 vs. mimics-NC group;2)P < 0.05 vs. miR-625-5p mimics + pcDNA group. | ||||
2.6 LINC00839对裸鼠移植瘤生长的影响
sh-LINC00839组与sh-NC组相比,小鼠移植瘤体积、移植瘤质量[(0.48±0.06)g和(1.55±0.17)g]、LINC00839表达水平(0.45±0.06和1.00±0.12)、MSI1阳性率[(12.17±1.63)%和(38.59±3.48)%]降低,miR-625-5p表达水平(1.57±0.16和1.01±0.10)升高(P < 0.05),见图 6。
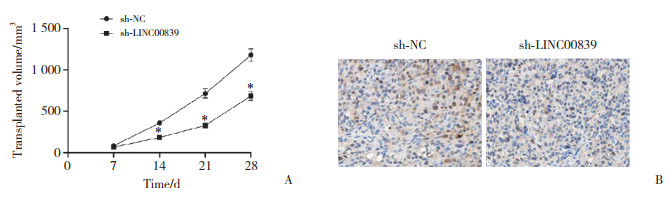
|
| A, effect of silencing LINC00839 on transplanted tumor volume in nude mice; B, expression of MSI1 in transplanted tumor tissues detected by immunohistochemistry (×200). * P < 0.05 vs. sh-NC group. 图 6 LINC00839对裸鼠移植瘤生长的影响 Fig.6 Effect of LINC00839 on the growth of transplanted tumors in nude mice |
3 讨论
研究[7]发现,LINC00839敲低通过海绵miR-454-3p来减弱鼻咽癌细胞的侵袭性。沉默LINC00839通过调控miR-338-3p/GLUT1轴,抑制神经母细胞瘤细胞增殖、迁移、侵袭和糖酵解,促进细胞凋亡[8]。本研究发现,EC组织和细胞中LINC00839表达水平升高,表明LINC00839在EC中异常表达。敲低LINC00839可显著降低EC细胞的体外恶性程度。敲低LINC00839也能抑制EC细胞在体内的成瘤能力。因此,LINC00839在EC中表达上调,其表达失调参与调控EC的发生和发展。
本研究通过生物信息学工具预测LINC00839与miR-625-5p的潜在结合位点,发现miR-625-5p是LINC00839海绵化的直接靶基因。研究发现,miR-625-5p在急性髓系白血病[9]、宫颈癌[10]等多种肿瘤中表达水平降低,发挥抑癌作用。此外,circ-0002577在EC细胞中作为miR-625-5p海绵,调节下游靶基因IGF1R,加速EC进展[5]。本研究发现,EC组织和细胞中miR-625-5p水平下降,过表达miR-625-5p抑制EC细胞增殖、集落形成、迁移和侵袭。抑制miR-625-5p表达可以逆转敲低LINC00839对EC细胞增殖、集落形成、迁移和侵袭的抑制作用,表明LINC00839可能通过海绵miR-625-5p参与EC的发生和发展。
MSI1被预测为miR-625-5p的潜在靶点。MSI1在结直肠癌细胞中表达上调,上调MSI1可逆转miR-296-5p过表达对结直肠癌成瘤性的降低作用和对放射敏感性的增强作用[11]。本研究发现,EC组织和细胞中MSI1表达水平升高,miR-625-5p直接抑制MSI1,过表达MSI1逆转了miR-625-5p对EC细胞增殖、迁移和侵袭的抑制作用,表明MSI1在EC进展中具有致癌性。
综上所述,本研究发现LINC00839可以靶向调节miR-625-5p/MSI1轴,调控EC细胞的增殖、凋亡、迁移和侵袭行为。
| [1] |
CROSBIE EJ, KITSON SJ, MCALPINE JN, et al. Endometrial cancer[J]. Lancet, 2022, 399(10333): 1412-1428. DOI:10.1016/S0140-6736(22)00323-3 |
| [2] |
齐跃, 叶秋霖, 刘娟娟, 等. hMOF对子宫内膜癌细胞生物学行为的影响[J]. 中国医科大学学报, 2020, 49(7): 654-658. DOI:10.12007/j.issn.0258-4646.2020.07.017 |
| [3] |
YU X, JIANG Y, HU X, et al. LINC00839/miR-519d-3p/JMJD6 axis modulated cell viability, apoptosis, migration and invasiveness of lung cancer cells[J]. Folia Histochem Cytobiol, 2021, 59(4): 271-281. DOI:10.5603/FHC.a2021.0022 |
| [4] |
LIU X, CHEN J, ZHANG S, et al. LINC00839 promotes colorectal cancer progression by recruiting RUVBL1/Tip60 complexes to activate NRF1[J]. EMBO Rep, 2022, 23(9): e54128. DOI:10.15252/embr.202154128 |
| [5] |
WANG Y, YIN L, SUN X. CircRNA hsa_circ_0002577 accelerates endometrial cancer progression through activating IGF1R/PI3K/Akt pathway[J]. J Exp Clin Cancer Res, 2020, 39(1): 169. DOI:10.1186/s13046-020-01679-8 |
| [6] |
FALKE I, TROSCHEL FM, PALENTA H, et al. Knockdown of the stem cell marker Musashi-1 inhibits endometrial cancer growth and sensitizes cells to radiation[J]. Stem Cell Res Ther, 2022, 13(1): 212. DOI:10.1186/s13287-022-02891-3 |
| [7] |
ZHANG FY, LI X, HUANG TT, et al. LINC00839 knockdown restrains the metastatic behavior of nasopharyngeal carcinoma by sponging miR-454-3p[J]. Aging (Albany NY), 2021, 13(24): 26022-26033. DOI:10.18632/aging.203792 |
| [8] |
YANG LX, PEI LY, YI JL. LINC00839 regulates proliferation, migration, invasion, apoptosis and glycolysis in neuroblastoma cells through miR-338-3p/GLUT1 axis[J]. Neuropsychiatr Dis Treat, 2021, 17: 2027-2040. DOI:10.2147/NDT.S309467 |
| [9] |
SAMIEYAN DEHKORDI S, MOUSAVI SH, EBRAHIMI M, et al. Upregulation of hsa-miR-625-5p inhibits invasion of acute myeloid leukemia cancer cells through ILK/AKT pathway[J]. Cell J, 2022, 24(2): 76-84. DOI:10.22074/cellj.2022.7658 |
| [10] |
ZHAO F, FANG T, LIU H, et al. Long non-coding RNA MALAT1 promotes cell proliferation, migration and invasion in cervical cancer by targeting miR-625-5p and AKT2[J]. Panminerva Med, 2023, 65(2): 266-267. DOI:10.23736/S0031-0808.19.03845-X |
| [11] |
LI L, JIANG Z, ZOU X, et al. Exosomal circ_IFT80 enhances tumorigenesis and suppresses radiosensitivity in colorectal cancer by regulating miR-296-5p/MSI1 axis[J]. Cancer Manag Res, 2021, 13: 1929-1941. DOI:10.2147/CMAR.S297123 |
 2025, Vol. 54
2025, Vol. 54