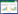文章信息
- 郭贵雅, 宋旺辰, 王爱民, 孔雨佳, 王素珍, 石福艳
- GUO Guiya, SONG Wangchen, WANG Aimin, KONG Yujia, WANG Suzhen, SHI Fuyan
- 哮喘后慢性阻塞性肺疾病发生风险及影响因素
- Risk and influencing factors of chronic obstructive pulmonary disease after asthma
- 中国医科大学学报, 2025, 54(2): 103-108, 114
- Journal of China Medical University, 2025, 54(2): 103-108, 114
-
文章历史
- 收稿日期:2024-03-12
- 网络出版时间:2025-01-15 16:20:27
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种异质性肺病,其特征是由于气道异常和(或)肺泡引起的慢性呼吸道症状,引发持续的、进行性气流阻塞,并可能导致患者个体严重的肺外效应,如心力衰竭、缺血性心脏病、周围血管疾病、高血压、骨质疏松症、肺癌、代谢综合征和糖尿病、胃食管反流和阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)等[1-2]。COPD是全球范围内常见的死亡原因[3]。COPD作为可独立影响死亡率和住院率的疾病,目前依然存在诊断不足、治疗缺乏、费用昂贵等问题[4]。哮喘是COPD发生的重要危险因素,二者都以气道阻塞为特征,但哮喘气道阻塞是可变且可逆的,而COPD气道阻塞是进行性且不可逆的[5]。COPD为肺的加速老化,年龄会增加COPD的易感性[3]。在老年人中,这两种疾病往往表现相似,并且高度重叠。在全球人口老龄化的背景下,识别哮喘发展成为COPD的危险因素,防止哮喘进一步发展成为COPD,对减轻全球疾病负担,提高人类生存质量具有重要意义。
多状态模型能详细描述疾病状态的时间变化过程,动态预测不同疾病状态之间的转移概率,并可分析不同阶段的影响因素及程度[6]。本研究基于英国生物样本(United Kingdom Biobank,UKB)数据库,采用多状态多因素模型深入探讨哮喘患者发生COPD的风险及其主要影响因素,并分析哮喘和COPD的死亡风险因素,以期为改善哮喘预后及COPD防控提供科学依据。
1 材料与方法 1.1 研究对象本研究选取UKB中进入队列后发生哮喘的患者,并随访其发生COPD和死亡2种结局事件及时间。随访截止时间为2021年11月30日,随访时间定义为招募后哮喘发生日到死亡、失访或随访结束的时间,中位随访时间为6.1年。UKB中共有502 411例参与者,排除490 609例参与者(包括485 365例已患或未患哮喘者,4 288例哮喘或COPD报告日期未知者,2 953例先患或同时患COPD者,262例患哮喘或COPD同时死亡者,10 032例协变量缺失者),最终共纳入11 802例参与者。本研究受UKB的支持,项目编号为78500。
1.2 数据预处理本研究中哮喘与COPD的诊断参照《国际疾病分类第10版》(International Classification of Diseases Version 10,ICD-10)[7-8],最终纳入11 802例哮喘患者,病例报告来源包括自报(1 468例)、医院首诊(443例)和医院复诊(9 891例);其中1 133例患者发生COPD转归,病例报告来源包括自报(7例)、医院首诊(98例)、死亡主因(1例)、医院复诊(1 023例)和死亡促成病因(4例)。高腰臀比为男性≥0.90,女性≥0.85[9]。汤森剥夺指数是基于地区的社会剥夺分数(考虑失业、过度拥挤、无车和无房),在参与者加入UKB时根据之前的全国人口普查数据确定[10]。每个参与者被分配了1个与其邮政编码区域相对应的分数,并归为3组:高汤森剥夺指数组(≥2),中汤森剥夺指数组(-2~<2)和低汤森剥夺指数组(<-2)[11]。吸烟情况分为3种:大部分或所有的日子吸烟(经常吸烟)、只有在偶然情况下吸烟(偶尔吸烟)、无吸烟史。慢性支气管炎/肺气肿家族史分为父母双方均有慢性支气管炎/肺气肿(双方家族史)、仅父亲患有慢性支气管炎/肺气肿(父方家族史)、仅母亲患有慢性支气管炎/肺气肿(母方家族史)、父母双方均无慢性支气管炎/肺气肿(无家族史)。饮酒状态分为现在饮酒(现饮酒)、以前饮酒(戒酒)、不饮酒(不饮酒)。
1.3 多状态模型多状态模型是竞争风险模型的延伸,竞争风险模型是由一个暂态[6](从此状态可发生状态的改变,转移到其他状态)和几个互相排斥的吸收态(从其他状态转移到此状态后,不再发生状态的转移)组成,而多状态模型可以引入多个暂态。本研究中引入2个暂态(哮喘和COPD)和一个吸收态(死亡),并分析哮喘确诊年龄、性别、糖尿病、腰臀比、高血压、汤森剥夺指数、吸烟情况、慢性支气管炎/肺气肿家族史和饮酒状态9种因素对3种转归过程的作用。
1.4 统计学分析采用R软件(4.3.1)中的mstate和survival包进行多状态建模、统计分析以及结果可视化分析。研究中的统计检验均采用双侧检验,P<0.05为差异有统计学意义。
2 结果 2.1 研究对象一般情况本研究共筛选出符合条件的研究对象11 802例,其中,男4 801例(40.7%),女7 001例(59.3%),平均年龄为64岁。糖尿病909例,高腰臀比6 748例,高血压3 692例。在患有哮喘的11 802例中,直接发生死亡结局801例(6.8%);发生COPD结局1 133例(9.6%),发生COPD后出现死亡结局251例(2.1%)。见表 1。
| Item | n(%) | Item | n(%) | |
| Age | Townsend deprivation score | |||
| <65 years | 5 623(47.6) | <-2 | 5 622(47.6) | |
| ≥65 years | 6 179(52.4) | -2-<2 | 3 843(32.6) | |
| Sex | ≥2 | 2 337(19.8) | ||
| Female | 7 001(59.3) | Smoking status | ||
| Male | 4 801(40.7) | Never | 10 572(89.6) | |
| Diabetes | Occasional | 285(2.4) | ||
| No | 10 893(92.3) | Often | 945(8.0) | |
| Yes | 909(7.7) | Family history of chronic bronchitis/emphysema | ||
| High waist-to-hip ratio | No | 9 557(81.0) | ||
| No | 5 054(42.8) | Mother | 710(6.0) | |
| Yes | 6 748(57.2) | Father | 1 387(11.7) | |
| Hypertension | Both | 148(1.3) | ||
| No | 8 110(68.7) | Drinking status | ||
| Yes | 3 692(31.3) | Never | 694(5.9) | |
| Abstinence | 561(4.7) | |||
| Now | 10 547(89.4) |
2.2 不同状态转归风险分析结果
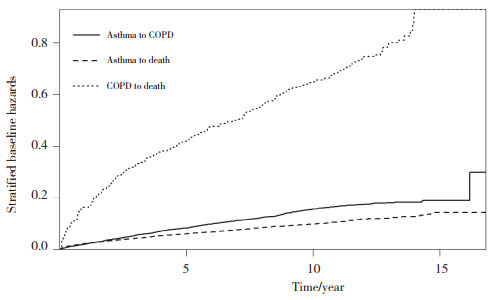
对不同转归路径及转归风险进行分析。在不考虑协变量影响的情况下,由COPD到死亡的累积风险最高,然后为哮喘到COPD、哮喘到死亡。见图 1。绘制堆积转移概率图,临近的2条线表示该时间下停留在对应状态的概率[12]。随着哮喘发病时间的延长,部分患者在哮喘后容易发生COPD,并在死亡哮喘患者中占有一定比例。见图 2。
|
| 图 1 3种转归路径的累计风险曲线 Fig.1 Cumulative risk curves of the three possible outcome paths |
|
| 图 2 未纳入协变量的堆积转归概率图 Fig.2 Stacked outcome probability plot without covariates |
2.3 不同转归状态的影响因素分析
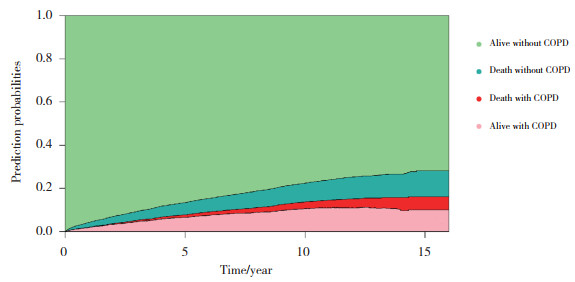
采用多状态多因素模型深入分析患者不同转归路径的主要影响因素。纳入本研究的协变量,在哮喘发病大约10年后,进一步发展为COPD的比例显著提高(> 40%),并且在死亡哮喘患者中发生COPD的比例明显高于未发生COPD的比例。见图 3。
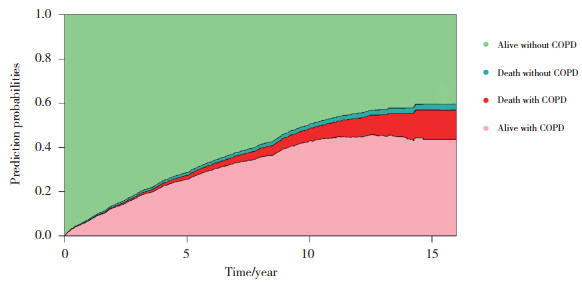
|
| 图 3 纳入协变量的堆积转归概率图 Fig.3 Stacked outcome probability plot with covariates |
在哮喘转归COPD过程中,高龄(≥65岁)、男性、糖尿病、高腰臀比(男性≥0.90,女性≥0.85)、高血压、汤森剥夺指数增高、吸烟频率增加和家族史是哮喘人群发展为COPD的危险因素;并且随着汤森剥夺指数增高、吸烟频率增加和父母家族史人数增加,患者发生COPD的风险也增高,见表 2。同样,在哮喘转归死亡过程中,高龄(≥65岁)、男性、糖尿病、高腰臀比(男性≥0.90,女性≥0.85)、汤森剥夺指数增高和吸烟频率增加是哮喘人群发生死亡的危险因素,见表 2。最后,在COPD转归死亡过程中,高龄(≥65岁)、男性、糖尿病和汤森剥夺指数增高是COPD患者发生死亡的危险因素,见表 3。
| Item | n | Asthma to COPD | Asthma to death | |||||
| HR | 95%CI | P | HR | 95%CI | P | |||
| Age | ||||||||
| <65 years | 5 623 | Reference | Reference | |||||
| ≥65 years | 6 179 | 2.550 | 2.247-2.893 | <0.001 | 3.077 | 2.628-3.602 | <0.001 | |
| Sex | ||||||||
| Female | 7 001 | Reference | Reference | |||||
| Male | 4 801 | 1.364 | 1.202-1.548 | <0.001 | 1.428 | 1.228-1.661 | <0.001 | |
| Diabetes | ||||||||
| No | 10 893 | Reference | Reference | |||||
| Yes | 909 | 1.310 | 1.085-1.582 | 0.005 | 1.529 | 1.240-1.886 | <0.001 | |
| High waist-to-hip ratio | ||||||||
| No | 5 054 | Reference | Reference | |||||
| Yes | 6 748 | 1.238 | 1.081-1.419 | 0.002 | 1.264 | 1.072-1.491 | 0.005 | |
| Hypertension | ||||||||
| No | 8 110 | Reference | Reference | |||||
| Yes | 3 692 | 1.255 | 1.109-1.420 | <0.001 | 1.125 | 0.972-1.302 | 0.115 | |
| Townsend deprivation score | ||||||||
| <-2 | 3 843 | Reference | Reference | |||||
| -2-<2 | 2 337 | 1.336 | 1.158-1.542 | <0.001 | 1.181 | 1.007-1.386 | 0.041 | |
| ≥2 | 5 622 | 1.962 | 1.690-2.278 | <0.001 | 1.357 | 1.127-1.634 | 0.001 | |
| Smoking status | ||||||||
| Never | 945 | Reference | Reference | |||||
| Occasional | 285 | 2.883 | 2.178-3.816 | <0.001 | 1.218 | 0.771-1.925 | 0.398 | |
| Often | 10 572 | 5.281 | 4.586-6.082 | <0.001 | 1.537 | 1.200-1.970 | 0.001 | |
| Family history | ||||||||
| No | 148 | Reference | Reference | |||||
| Mother | 1 387 | 1.622 | 1.314-2.003 | <0.001 | 1.068 | 0.798-1.429 | 0.658 | |
| Father | 710 | 1.296 | 1.096-1.534 | 0.003 | 1.128 | 0.920-1.384 | 0.246 | |
| Both | 9 557 | 1.785 | 1.168-2.729 | 0.007 | 0.418 | 0.157-1.119 | 0.082 | |
| Drinking status | ||||||||
| Never | 561 | Reference | Reference | |||||
| Abstinence | 10 547 | 1.132 | 0.810-1.581 | 0.468 | 0.972 | 0.656-1.440 | 0.886 | |
| Now | 694 | 1.000 | 0.774-1.292 | 0.999 | 0.821 | 0.621-1.085 | 0.165 | |
| Item | n | HR | 95%CI | P |
| Age | ||||
| <65 years | 5 623 | Reference | ||
| ≥65 years | 6 179 | 2.029 | 1.516-2.716 | <0.001 |
| Sex | ||||
| Female | 7 001 | Reference | ||
| Male | 4 801 | 1.373 | 1.038-1.817 | 0.026 |
| Diabetes | ||||
| No | 10 893 | Reference | ||
| Yes | 909 | 1.811 | 1.308-2.508 | <0.001 |
| High waist-to-hip ratio | ||||
| No | 5 054 | Reference | ||
| Yes | 6 748 | 1.214 | 0.879-1.676 | 0.240 |
| Hypertension | ||||
| No | 8 110 | Reference | ||
| Yes | 3 692 | 1.112 | 0.859-1.438 | 0.420 |
| Townsend deprivation score | ||||
| <-2 | 3 843 | Reference | ||
| -2-<2 | 2 337 | 1.090 | 0.786-1.512 | 0.604 |
| ≥2 | 5 622 | 1.374 | 1.001-1.884 | 0.049 |
| Smoking status | ||||
| Never | 945 | Reference | ||
| Occasional | 285 | 1.105 | 0.607-2.011 | 0.744 |
| Often | 10 572 | 1.182 | 0.884-1.580 | 0.260 |
| Family history | ||||
| No | 148 | Reference | ||
| Mother | 1 387 | 1.337 | 0.857-2.087 | 0.200 |
| Father | 710 | 1.037 | 0.723-1.488 | 0.844 |
| Both | 9 557 | 0.943 | 0.345-2.577 | 0.909 |
| Drinking status | ||||
| Never | 561 | Reference | ||
| Abstinence | 10 547 | 1.668 | 0.844-3.297 | 0.141 |
| Now | 694 | 1.112 | 0.626-1.975 | 0.716 |
3 讨论
本研究是一项前瞻性的大样本研究,基于UKB数据库采用多状态模型,探究哮喘后COPD和死亡风险并分析3种转归的主要影响因素。结果显示,高龄(≥65岁)、男性、糖尿病和汤森剥夺指数增高为3种状态转归的重要危险因素。研究[13]表明COPD加速肺衰老,且肺部僵尸细胞能够分泌诱导衰老的炎症介质并扩散,加速各器官衰老;COPD正以男性为主的两表型转变为多表型的疾病模式[14];糖尿病对COPD的潜在机制可能是体重指数增加、呼吸顺应性改变或其他未定义因素[15]。高汤森剥夺指数群体的教育、住房和资金水平和质量往往较差,其健康素质与能力获得和发展也受到影响[10]。本研究结果也为社会剥夺与非传染性疾病间的联系提供了证据。这提示应加强对老年男性高汤森剥夺指数的糖尿病患者的健康教育,提升对哮喘和COPD的认知,并开展重点筛查以提高诊断率和治疗率。
高腰臀比、吸烟频率增加是哮喘转归COPD或死亡的危险因素。肥胖哮喘患者体内瘦素作为气道疾病重要介质可通过直接作用于气道引起高反应和炎症反应,使哮喘患者肺部更易衰退[16]。在哮喘转归COPD过程中,随着吸烟频率的增加,患者转归风险也随之增加,同样在哮喘转归死亡过程中,吸烟频率增加患者的死亡风险明显高于无吸烟史患者,进一步证明吸烟是COPD的主要风险因素,随着吸烟频率增加哮喘患者更易发展成为COPD [17]。另外,哮喘与COPD在老年群体中难以区分,若不尽早戒烟很有可能导致漏诊和误诊,使患者错过最佳治疗时间,最终发展成为不完全可逆的气流限制[5]。
在哮喘转归COPD的过程中,高血压和家族史均为危险因素,对哮喘患者进行高血压的有效控制具有重要意义,这也进一步印证了肺功能受损和心血管功能受损之间的双向关系[18];COPD发展受遗传和环境共同影响,早期研究[19]已经证明COPD在家族中聚集,而吸烟也会在家庭中聚集,二者都会增加子代COPD的患病风险,因此对存在家族史的患者在哮喘发生时更应及时接受有效治疗并采取戒烟等控制措施,防止病情进一步恶化[19]。
本研究中并未发现饮酒状态在3种转归中有统计学意义。不过本研究仅对饮酒状态进行分析,其中并未涉及饮酒类型与饮酒量的研究,故饮酒与哮喘的关系有待深入研究。
本研究存在一定局限性。首先,本研究仅考虑了哮喘发生COPD的风险,未考虑COPD发生哮喘的风险。其次,研究对象主要来自欧洲,没有考虑种族差异。最后,针对影响因素的研究有待进一步深入。
| [1] |
VENKATESAN P. GOLD COPD report: 2024 update[J]. Lancet Respir Med, 2024, 12(1): 15-16. DOI:10.1016/S2213-2600(23)00461-7 |
| [2] |
BHATTARAI MD. Asthma mistaken for chronic obstructive pulmonary disease[J]. Lancet, 2003, 361(9372): 1914-1915. DOI:10.1016/S0140-6736(03)13530-1 |
| [3] |
DECRAMER M, JANSSENS W, MIRAVITLLES M. Chronic obstructive pulmonary disease[J]. Lancet, 2012, 379(9823): 1341-1351. DOI:10.1016/S0140-6736(11)60968-9 |
| [4] |
DECRAMER M, INITIATIVE ERR. The European respiratory road-map[J]. Lancet, 2011, 378(9805): 1765-1767. DOI:10.1016/S0140-6736(11)60619-3 |
| [5] |
BARNES PJ. Immunology of asthma and chronic obstructive pulmonary disease[J]. Nat Rev Immunol, 2008, 8(3): 183-192. DOI:10.1038/nri2254 |
| [6] |
杨珊珊, 李新毅, 周立业, 等. 基于多状态Markov模型的老年人认知损害转归研究[J]. 中国卫生统计, 2012, 29(4): 516-519. DOI:10.3969/j.issn.1002-3674.2012.04.015 |
| [7] |
FAWCETT KA, DEMIDOV G, SHRINE N, et al. Exome-wide analysis of copy number variation shows association of the human leukocyte antigen region with asthma in UK Biobank[J]. BMC Med Genomics, 2022, 15(1): 119. DOI:10.1186/s12920-022-01268-y |
| [8] |
JOO J, HOBBS BD, CHO MH, et al. Trait insights gained by comparing genome-wide association study results using different chronic obstructive pulmonary disease definitions[J]. AMIA Jt Summits Transl Sci Proc, 2020, 2020: 278-287. |
| [9] |
HAUFS MG, ZÖLLNER YF. Waist-hip ratio more appropriate than body mass index[J]. Dtsch Arztebl Int, 2020, 117(39): 659. DOI:10.3238/arztebl.2020.0659a |
| [10] |
WOODWARD M, PETERS SAE, HARRIS K. Social deprivation as a risk factor for COVID-19 mortality among women and men in the UK biobank: nature of risk and context suggests that social interventions are essential to mitigate the effects of future pandemics[J]. J Epidemiol Community Health, 2021, 75(11): 1050-1055. DOI:10.1136/jech-2020-215810 |
| [11] |
SHEN C, ROLLS ET, CHENG W, et al. Associations of social isolation and loneliness with later dementia[J]. Neurology, 2022, 99(2): e164-e175. DOI:10.1212/WNL.0000000000200583 |
| [12] |
MANEVSKI D, PUTTER H, POHAR PERME M, et al. Integrating relative survival in multi-state models-a non-parametric approach[J]. Stat Methods Med Res, 2022, 31(6): 997-1012. DOI:10.1177/09622802221074156 |
| [13] |
BARNES PJ. COPD 2020:new directions needed[J]. Am J Physiol Lung Cell Mol Physiol, 2020, 319(5): L884-L886. DOI:10.1152/ajplung.00473.2020 |
| [14] |
OHAR J, FROMER L, DONOHUE JF. Reconsidering sex-based stereotypes of COPD[J]. Prim Care Respir J, 2011, 20(4): 370-378. DOI:10.4104/pcrj.2011.00070 |
| [15] |
MANNINO DM, THORN D, SWENSEN A, et al. Prevalence and outcomes of diabetes, hypertension and cardiovascular disease in COPD[J]. Eur Respir J, 2008, 32(4): 962-969. DOI:10.1183/09031936.00012408 |
| [16] |
BROEKHUIZEN R, VERNOOY JH, SCHOLS AM, et al. Leptin as local inflammatory marker in COPD[J]. Respir Med, 2005, 99(1): 70-74. DOI:10.1016/j.rmed.2004.03.029 |
| [17] |
CORRÊA PC. The Lancet COPD Commission: broader questions remain[J]. Lancet, 2023, 401(10388): 1568. DOI:10.1016/S0140-6736(23)00553-6 |
| [18] |
CHRISTIANSEN SC, ZURAW BL. Treatment of hypertension in patients with asthma[J]. N Engl J Med, 2019, 381(11): 1046-1057. DOI:10.1056/NEJMra1800345 |
| [19] |
SILVERMAN EK. Genetics of copd[J]. Annu Rev Physiol, 2020, 82: 413-431. DOI:10.1146/annurev-physiol-021317-121224 |
 2025, Vol. 54
2025, Vol. 54