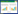文章信息
- 陈峣, 于漫, 李昕, 尉玉婷, 刘旭丹, 王欢欢, 王梅
- CHEN Yao, YU Man, LI Xin, WEI Yuting, LIU Xudan, WANG Huanhuan, WANG Mei
- 胞外信号调节激酶信号通路对亚砷酸钠诱导的小鼠海马神经元细胞凋亡的调控作用
- Role of the extracellular signal-regulated kinase pathway in arsenic-induced apoptosis in mouse hippocampal neuron cells
- 中国医科大学学报, 2025, 54(1): 24-29
- Journal of China Medical University, 2025, 54(1): 24-29
-
文章历史
- 收稿日期:2024-01-12
- 网络出版时间:2025-01-09 15:03:25
2. 中国医科大学公共卫生学院劳动卫生教研室, 沈阳 110122
2. Department of Occupational Health, School of Public Health, China Medical University, Shenyang 110122, China
砷是一种常见的环境有毒物质,人们主要通过饮食[1]和职业暴露(如矿工、农药生产和电子废物处理等) [2]接触砷化合物。研究[3]表明,长期暴露于高砷环境中可能导致各种健康问题,如癌症、心血管疾病和神经系统损伤等。大量流行病学研究[4]证实,砷可通过血脑屏障进入大脑,干扰神经细胞的正常功能,长期接触砷与认知功能下降、学习和记忆障碍、神经发育异常以及神经退行性变性疾病(如帕金森病和阿尔茨海默病等) 有关。然而,砷诱导神经毒性的潜在机制复杂,目前尚不完全了解,且砷暴露在日常生活和职业生活中无法完全避免。因此,探讨砷导致神经毒性的机制、寻找潜在的治疗靶点具有重要意义。
海马对哺乳动物学习和记忆的构建十分重要[5]。海马损伤会损害人类记忆、注意力以及执行功能的能力和速度[6]。因此,海马细胞凋亡是神经系统损伤重要指标之一。研究[7]证实,砷暴露可通过多种途径诱导细胞凋亡,如线粒体途径、内质网途径、自噬途径等。这些途径可能都与活性氧(reactive oxygen species,ROS) 有关。ROS在细胞信号传导和组织稳态中起重要作用。胞外信号调节激酶(extracellular signal-regulated kinase,ERK) 是一种蛋白激酶细胞内信号分子,参与各种细胞反应,如增殖、迁移、分化和凋亡[8]。最近的研究[9]发现,ERK在神经系统中起关键作用,包括神经发育、突触可塑性和学习记忆等。研究[10]表明,ERK信号通路的调控异常可能与神经系统疾病(如阿尔茨海默病和帕金森病等) 相关。活化的ERK易位至细胞核内以发挥多种功能,包括细胞增殖和存活[11]。一旦发生核易位,ERK会对cAMP反应元件结合蛋白(cAMP response element binding protein,CREB) 进行磷酸化修饰[12]。研究[13]证实,CREB在促进神经元存活、前体增殖、神经突触生长和神经元分化中起关键作用。但砷暴露与CREB信号通路的关系尚不清楚。本研究使用亚砷酸钠(NaAsO2) 作用于体外培养的神经细胞,模拟环境砷暴露条件,探究其对中枢神经系统的潜在损伤效应,从而探讨ROS在NaAsO2诱导神经元细胞凋亡的调控机制中的作用,以深入理解砷的神经毒性作用,并为砷相关神经疾病的治疗提供潜在的治疗靶点和策略。
1 材料与方法 1.1 细胞培养和分组小鼠海马神经元细胞系HT-22 (北京北纳创联生物技术研究院),在MEM培养基(以色列Biological Industries公司) 中培养,培养基中添加10%胎牛血清(以色列Biological Industries公司)、50 U/mL青霉素-链霉素(美国Invitrogen公司)、1%非必需氨基酸(美国Cyagen公司)。在37 ℃、5% CO2的培养箱中培养HT-22细胞,用不同浓度的NaAsO2处理细胞24 h,收集细胞进行下一步实验。
将细胞分为对照组,4、6、8、10 μmol/L NaAsO2暴露组,N-乙酰半胱氨酸(N-acetylcysteine,NAC,5 mmol/L) 独立干预组、NAC (5 mmol/L) 与NaAsO2 (10 μmol/L) 联合干预组。对照组细胞不进行任何处理;4、6、8、10 μmol/L NaAsO2暴露组细胞分别使用4、6、8、10 μmol/LNaAsO2进行处理,处理时间为24 h;NAC独立干预组细胞使用终浓度为5 mmol/L NAC处理细胞1 h,之后不再进行其他处理;NAC与NaAsO2联合干预组细胞使用5 mmol/L NAC处理细胞1 h,之后使用终浓度为10 μmol/L NaAsO2进行处理,处理时间为24 h。
1.2 2,7-二氯荧光素二乙酸酯(2,7-dichlorofuorescin diacetate,DCFH-DA) 法检测ROS将HT-22细胞以1×105/孔的密度接种于6孔板中,加载DCFH-DA (北京索莱宝科技有限公司) 探针于NaAsO2和(或) NAC干预终点的HT-22细胞中,通过Revolve正倒置一体显微镜(美国Echo Labs公司) 检测荧光强度,DCFH-DA的荧光强度越强,细胞的氧化应激强度越高。使用Echo软件收集和分析数据。
1.3 流式细胞术检测细胞凋亡率采用AnnexinⅤ-FICT/PI凋亡测定试剂盒(美国BD公司) 检测细胞凋亡率。将HT-22细胞以1×105/孔的密度接种于6孔板中,用PBS洗涤细胞,并重新悬浮在缓冲液中。在避光条件下,分别用FITC和PI探针溶液孵育细胞30和10 min。最后用缓冲液冲洗细胞,用流式细胞仪(美国BD公司) 检测细胞凋亡率。使用ModFit LT软件收集和分析数据。
1.4 Western blotting采用Western blotting检测CREB、p-CREB、ERK、p-ERK、lamin B (1∶1 000,美国Cell Signaling Technology公司)、GAPDH (1∶8 000,武汉三鹰生物技术有限公司) 蛋白水平。
用含有1% PMSF (上海碧云天生物技术股份有限公司) 和1%磷酸酶抑制剂(上海碧云天生物技术股份有限公司) 的RIPA裂解缓冲液(上海碧云天生物技术股份有限公司) 裂解体外培养细胞。等量蛋白(30 μg/孔) 经SDS-PAGE分离。使用电泳凝胶成像分析系统(美国Analytik Jena公司) 显示膜上的蛋白条带。采用ImageJ软件对蛋白进行定量。
1.5 统计学分析采用SPSS 22.0软件对数据进行分析。所有实验至少重复3次。计量资料用x±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,2组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 NaAsO2暴露激活HT-22细胞氧化应激与对照组比较,6、8、10 μmol/L NaAsO2暴露组HT-22细胞内DCFH-DA的荧光强度呈显著上升趋势,且10 μmol/L NaAsO2暴露组的荧光强度最高。结果证实,NaAsO2暴露诱导细胞ROS水平上调,激活HT-22细胞氧化应激,且该上调效应与NaAsO2暴露浓度呈现明显的剂量-效应关系。见图 1。

|
| 图 1 NaAsO2暴露后HT-22细胞中ROS水平×200 Fig.1 Levels of ROS in HT-22 cells exposed to NaAsO2 ×200 |
2.2 NaAsO2暴露阻滞HT-22细胞中ERK的细胞核易位过程并激活细胞凋亡
Western blotting结果显示,与对照组相比,4、6、8、10 μmol/L NaAsO2暴露组细胞核中p-ERK蛋白水平显著降低(P < 0.05,图 2A);与对照组相比,6、8、10 μmol/L NaAsO2暴露组细胞质中p-ERK蛋白水平显著升高(P < 0.05,图 2B);与对照组相比,6、8、10 μmol/L NaAsO2暴露组细胞中p-CREB蛋白水平显著降低(P < 0.05,图 2C),且这一降低趋势随NaAsO2剂量的增加呈现明显的剂量-效应关系(P < 0.05)。另外,与对照组相比,4、6、8、10 μmol/L NaAsO2暴露组细胞中Bcl-2蛋白水平显著降低(P < 0.05,图 2C)。结果证实,NaAsO2暴露能够显著抑制p-ERK的细胞核易位过程,并对CREB/Bcl-2通路产生抑制作用。
|
| A,p-ERK protein level in the nucleus;B,p-ERK protein level in the cytoplasm;C,p-CREB and Bcl-2 protein levels in the cells. 1,control group;2,4 μmol/L NaAsO2 group;3,6 μmol/L NaAsO2 group;4,8 μmol/L NaAsO2 group;5,10 μmol/L NaAsO2 group. * P < 0.05 vs. control group;# P < 0.05 vs. 4 μmol/L NaAsO2 group;& P < 0.05 vs. 6 μmol/L NaAsO2 group;$ P < 0.05 vs. 8 μmol/L NaAsO2 group. 图 2 NaAsO2暴露HT-22细胞中p-ERK的细胞核易位及CREB/Bcl-2通路相关蛋白水平 Fig.2 Nuclear translocation of p-ERK and expression of proteins related to the CREB/Bcl-2 signaling pathway in HT-22 cells exposed to NaAsO2 |
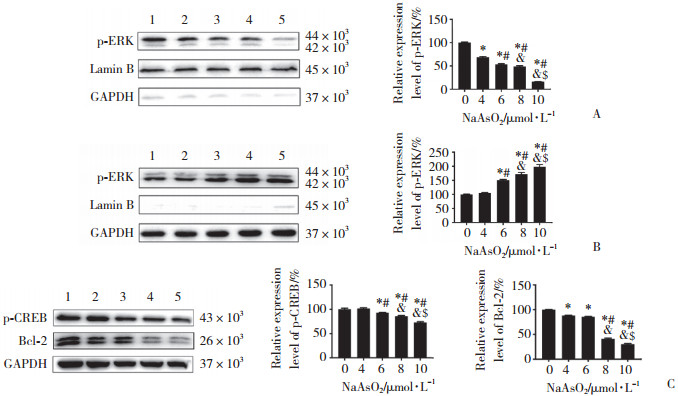
流式细胞术结果显示,与对照组相比,8、10 μmol/L NaAsO2暴露组细胞凋亡率呈现显著上升趋势(P < 0.05),表明NaAsO2显著激活HT-22细胞凋亡。见图 3。
|
| * P < 0.05 vs. control group;# P < 0.05 vs. 4 μmol/L NaAsO2 group;& P < 0.05 vs. 6 μmol/L NaAsO2 group;$ P < 0.05 vs. 8 μmol/L NaAsO2 group. 图 3 NaAsO2暴露HT-22细胞的凋亡率 Fig.3 Apoptosis rate of HT-22 cells exposed to NaAsO2 |
2.3 NAC干预降低NaAsO2暴露HT-22细胞中ROS水平
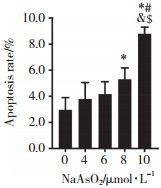
为了研究ROS在NaAsO2暴露诱导的细胞凋亡中的作用,使用抗氧化剂NAC对细胞进行干预,并对细胞进行DCFH-DA荧光标记。结果显示,与10 μmol/L NaAsO2暴露组相比,NAC与NaAsO2联合干预组细胞荧光强度显著下降,HT-22细胞中ROS水平显著降低。结果提示,NAC有效抑制了NaAsO2暴露诱导的氧化应激。见图 4。
|
| 图 4 NAC干预后HT-22细胞中ROS水平×200 Fig.4 Levels of ROS in HT-22 cells following administration of NAC ×200 |
2.4 NAC干预提高NaAsO2暴露HT-22细胞中ERK的细胞核易位水平并降低细胞凋亡
Western blotting结果显示,与10 μmol/L NaAsO2暴露组相比,NAC与NaAsO2联合干预组细胞核中p-ERK蛋白水平显著升高(P < 0.05,图 5A),细胞质中p-ERK蛋白水平也显著升高(P < 0.05,图 5B)。结果提示,NAC干预显著逆转了NaAsO2诱导的p-ERK细胞核易位减少。与10 μmol/L NaAsO2暴露组相比,NAC与NaAsO2联合干预组细胞中p-CREB和Bcl-2蛋白水平均显著升高(P < 0.05,图 5C)。结果提示,抑制ROS可显著逆转NaAsO2暴露导致的CREB/Bcl-2通路抑制。
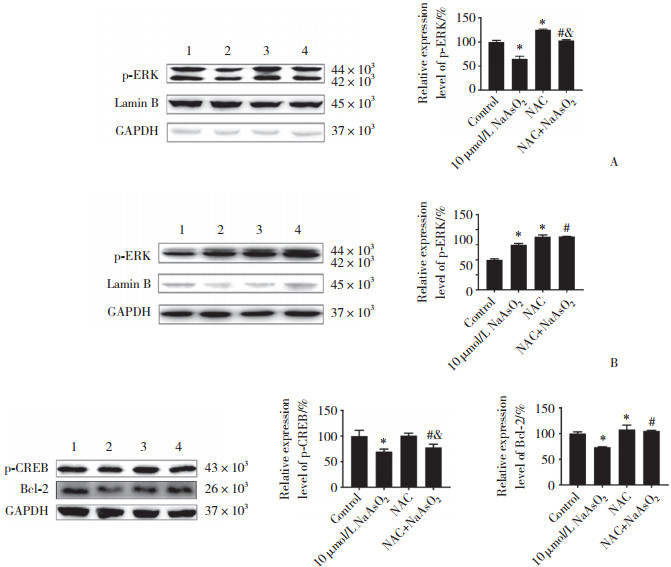
|
| 图 5 NAC干预后HT-22细胞中p-ERK的细胞核易位及CREB/Bcl-2通路相关蛋白水平 Fig.5 Nuclear translocation of p-ERK and expression of proteins related to the CREB/Bcl-2 signaling pathway in HT-22 cells following administration of NAC |
流式细胞术检测结果显示,与10 μmol/L NaAsO2暴露组相比,NAC与NaAsO2联合干预组细胞凋亡率显著降低(P < 0.05)。结果表明,NAC明显降低了NaAsO2对HT-22细胞凋亡的诱导作用,见图 6。结果提示,抑制细胞ROS水平能有效减轻NaAsO2暴露诱导的细胞凋亡。
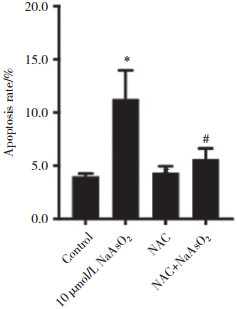
|
| * P < 0.05 vs. control group;# P < 0.05 vs. 10 μmol/L NaAsO2 group. 图 6 NAC干预后HT-22细胞的凋亡率 Fig.6 Apoptosis rate of HT-22 cells following administration of NAC |
3 讨论
砷对人体的每个器官或组织几乎都有影响,其神经毒性尤其引人关注。砷可以导致神经细胞凋亡,已有大量研究证实其致毒机制。细胞凋亡被认为是砷引发神经毒性的潜在机制之一[14],但其具体调控机制尚不清楚。本研究深入探讨了NaAsO2暴露诱导小鼠神经元HT-22细胞凋亡的调控机制。本研究结果显示,NaAsO2暴露增加了HT-22细胞的氧化应激水平。正常情况下,细胞处于氧化与抗氧化的动态平衡状态,机体内ROS含量维持在较低水平。大量ROS的产生可诱导细胞凋亡。本研究结果表明,在NaAsO2作用下,HT-22细胞中ROS水平显著升高,细胞凋亡水平也明显升高。
ERK通路是丝裂原活化蛋白激酶家族成员之一,它在细胞的生长、分化和存活等重要生理过程中起关键作用。ERK通路在多种生物学过程中都发挥重要作用,包括细胞增殖、分化、迁移、存活和凋亡等。ERK通路活化出现异常时,可能引发多种疾病的发生和发展,如癌症[8]、神经退行性变性疾病[15]等。因此,ERK通路成为药物研发和疾病治疗的重要靶点之一。
研究[8]显示,ERK通路的活化可以受到ROS的调节。当ERK通路被激活后,活化的p-ERK会易位至细胞核内,通过磷酸化细胞核内的靶蛋白(包括转录因子、细胞核内激酶和其他调控因子) 来调控特定基因的转录和表达。本研究发现,当HT-22细胞暴露于NaAsO2时,易位至细胞核的p-ERK显著减少,而滞留在细胞质中的p-ERK显著增加。同时,其下游通路CREB/Bcl-2被阻滞,表现为CREB蛋白Ser133位点磷酸化水平显著降低,Bcl-2蛋白水平呈剂量依赖性下降。这些结果表明,NaAsO2阻滞了p-ERK向细胞核易位过程,通过抑制下游CREB/Bcl-2通路,激活了细胞凋亡。
NAC作为一种广泛应用的抗氧化剂,能够有效保护机体遭受过氧化应激带来的损伤。本研究中,NAC干预显著降低了HT-22细胞中NaAsO2暴露诱导的ROS水平升高。同时,细胞核中p-ERK蛋白水平呈升高趋势,其下游分子p-CREB (Ser133) 蛋白水平亦升高。此外,Bcl-2蛋白表达也呈上调趋势。结果表明,NAC能够抑制HT-22细胞的氧化应激过程,通过促进p-ERK向细胞核内易位,激活其下游的CREB/Bcl-2信号通路,进而在一定程度上降低NaAsO2暴露诱导的细胞凋亡加剧现象,增强HT-22细胞的抗凋亡能力。本研究结果进一步证实了ERK信号通路在NaAsO2诱导的HT-22细胞凋亡过程中起到至关重要的作用。
综上所述,本研究发现,NaAsO2能够激活细胞氧化应激,通过抑制p-ERK细胞核易位,抑制下游CREB/Bcl-2通路的活性,从而促使细胞凋亡发生。NaAsO2作为一种潜在的抗癌药物,其促进细胞凋亡的作用为癌症治疗提供了新的思路和目标。本研究不仅提供了NaAsO2神经毒性机制的实验证据,还为NaAsO2作为抗癌药物提供了重要的理论依据和实验基础。
| [1] |
GARBINSKI LD, ROSEN BP, CHEN J. Pathways of arsenic uptake and efflux[J]. Environ Int, 2019, 126: 585-597. DOI:10.1016/j.envint.2019.02.058 |
| [2] |
NURCHI VM, DJORDJEVIC AB, CRISPONI G, et al. Arsenic toxicity: molecular targets and therapeutic agents[J]. Biomolecules, 2020, 10(2): 235. DOI:10.3390/biom10020235 |
| [3] |
KONONENKO M, FRISHMAN WH. Association between arsenic exposure and cardiovascular disease[J]. Cardiol Rev, 2021, 29(4): 217-221. DOI:10.1097/CRD.0000000000000357 |
| [4] |
KAUR I, BEHL T, ALEYA L, et al. Role of metallic pollutants in neurodegeneration: effects of aluminum, lead, mercury, and arsenic in mediating brain impairment events and autism spectrum disorder[J]. Environ Sci Pollut Res Int, 2021, 28(8): 8989-9001. DOI:10.1007/s11356-020-12255-0 |
| [5] |
邹佳芮, 陈克研, 张振. 5-HT1A受体拮抗剂对七氟烷致老年认知功能障碍模型大鼠突触可塑性的作用及其机制[J]. 中国医科大学学报, 2024, 53(1): 60-66, 74. DOI:10.12007/j.issn.0258-4646.2024.01.010 |
| [6] |
LANGE M, JOLY F, VARDY J, et al. Cancer-related cognitive impairment: an update on state of the art, detection, and management strategies in cancer survivors[J]. Ann Oncol, 2019, 30(12): 1925-1940. DOI:10.1093/annonc/mdz410 |
| [7] |
MEDDA N, DE SK, MAITI S. Different mechanisms of arsenic related signaling in cellular proliferation, apoptosis and neo-plastic transformation[J]. Ecotoxicol Environ Saf, 2021, 208: 111752. DOI:10.1016/j.ecoenv.2020.111752 |
| [8] |
GUO YJ, PAN WW, LIU SB, et al. ERK/MAPK signalling pathway and tumorigenesis[J]. Exp Ther Med, 2020, 19(3): 1997-2007. DOI:10.3892/etm.2020.8454 |
| [9] |
DENG S, LIU S, JIN P, et al. Albumin reduces oxidative stress and neuronal apoptosis via the ERK/Nrf2/HO-1 pathway after intra- cerebral hemorrhage in rats[J]. Oxid Med Cell Longev, 2021, 2021: 8891373. DOI:10.1155/2021/8891373 |
| [10] |
RAI SN, DILNASHIN H, BIRLA H, et al. The role of PI3K/Akt and ERK in neurodegenerative disorders[J]. Neurotox Res, 2019, 35(3): 775-795. DOI:10.1007/s12640-019-0003-y |
| [11] |
ELBADAWY M, USUI T, YAMAWAKI H, et al. Novel functions of death-associated protein kinases through mitogen-activated protein kinase-related signals[J]. Int J Mol Sci, 2018, 19(10): 3031. DOI:10.3390/ijms19103031 |
| [12] |
SGAMBATO V, PAGÈS C, ROGARD M, et al. Extracellular signal- regulated kinase (ERK) controls immediate early gene induction on corticostriatal stimulation[J]. J Neurosci, 1998, 18(21): 8814-8825. DOI:10.1523/JNEUROSCI.18-21-08814.1998 |
| [13] |
KUSAKABE M, HASEGAWA Y. Nimodipine promotes neurit outgrowth and protects against neurotoxicity in PC12 cells[J]. Iran J Basic Med Sci, 2021, 24(1): 51-57. DOI:10.22038/ijbms.2020.48567.11152 |
| [14] |
DING B, MA X, LIU Y, et al. Arsenic-induced, mitochondria- mediated apoptosis is associated with decreased peroxisome proliferator-activated receptor γ coactivator α in rat brains[J]. Toxics, 2023, 11(7): 576. DOI:10.3390/toxics11070576 |
| [15] |
LIN LL, SONG GJ, ZHANG H, et al. GPR34 knockdown relieves cognitive deficits and suppresses neuroinflammation in Alzheimer’s disease via the ERK/NF-κB signal[J]. Neuroscience, 2023, 528: 129-139. DOI:10.1016/j.neuroscience.2023.08.001 |
 2025, Vol. 54
2025, Vol. 54