文章信息
- 郭宏鹏, 李尤, 刘奇, 张睿, 孙成林, 潘星合
- GUO Hongpeng, LI You, LIU Qi, ZHANG Rui, SUN Chenglin, PAN Xinghe
- NKX2-1-AS1介导miR-96-5p/PRDM16轴对未分化甲状腺癌细胞增殖、迁移和侵袭的影响
- Effects of NKX2-1-AS1-mediated miR-96-5p/PRDM16 axis on anaplastic thyroid cancer cell proliferation, migration, and invasion
- 中国医科大学学报, 2024, 53(6): 547-554
- Journal of China Medical University, 2024, 53(6): 547-554
-
文章历史
- 收稿日期:2023-11-19
- 网络出版时间:2024-05-31 11:40:40
2. 沈阳医学院附属中心医院普外一科,沈阳 110024;
3. 沈阳医学院附属中心医院放射科,沈阳 110024
2. Department of General Surgery, Central Hospital Affiliated to Shenyang Medical College, Shenyang 110024, China;
3. Department of Radiology, Central Hospital Affiliated to Shenyang Medical College, Shenyang 110024, China
目前,未分化甲状腺癌(anaplastic thyroid cancer,ATC)较罕见,是最致命的癌症之一,患者中位总生存期仅为3个月[1]。ATC细胞无法进行碘摄取和甲状腺球蛋白的合成,这导致它们对传统的化疗和放射性碘治疗不敏感[2]。目前,还未找到能够治愈或显著延长ATC患者生存期的有效治疗方法。因此,深入研究ATC的发展机制并寻找新的治疗靶点尤为重要。长链非编码RNA(long non-coding RNA,lnc-RNA)是一类长度超过200个核苷酸的非编码RNA,它们通过吸附微RNA(microRNA,miRNA)在转录后水平调节miRNA下游靶基因表达,从而影响肿瘤发展[3]。本研究基于生物信息学筛选了ATC组织和细胞中差异表达的lncRNA NK2同源异形盒1-反义RNA 1(NK2 homeobox 1-antisense RNA 1,NKX2-1-AS1)和其调控的miR-96-5p及其下游靶基因含有PR结构域的蛋白16(PR domain-containing protein 16,PRDM16)。NKX2-1-AS1位于14号染色体q13.3,目前尚无在ATC中发挥作用的相关报道。本研究探讨了NKX2-1-AS1介导miR-96-5p/PRDM16轴对ATC细胞增殖、迁移和侵袭的影响,旨在为寻找ATC的潜在靶点提供理论基础。
1 材料与方法 1.1 主要试剂和仪器胎牛血清和DMEM高糖培养基购自美国Gibco公司,慢病毒购自上海吉凯基因医学科技股份有限公司,Lipofectamine 3000转染试剂购自美国Thermo公司,双荧光素酶报告基因检测试剂盒购自美国Promega公司,Western blotting相关试剂均购自上海碧云天生物技术有限公司,PRDM16和GAPDH抗体购自美国Abcam公司,细胞培养箱购自美国Thermo公司,化学发光仪购自美国Promega公司,酶标仪购自美国BioTek公司,凝胶扫描成像系统购自美国Bio-Rad公司,光学显微镜购自日本奥林巴斯公司。
1.2 方法 1.2.1 生物信息学分析基因表达图谱(gene expression omnibus,GEO)数据库(https://www.ncbi.nlm.nih.gov/geo)下载GSE65144和GSE85457数据集。GSE65144数据集包括12例ATC患者肿瘤组织样本(实验组)和13例正常甲状腺组织样本(对照组);GSE85457数据集包括4例ATC细胞样本(实验组)和3例正常甲状腺细胞样本(对照组)。
采用GEO2R软件(https://www.ncbi.nlm.nih.gov/geo/geo2r)分析实验组和对照组的差异表达基因,筛选标准为校正P<0.05且|log2FC|<2。miRcode在线数据库(http://www.mircode.org)用于预测NKX2-1-AS1的标靶miRNA。ENCORI在线数据库(https://rnasysu.com/encori)用于预测miR-96-5p的下游靶基因。
1.2.2 细胞培养及转染人ATC CAL-62细胞购自武汉普诺赛生命科技有限公司。细胞用含10%胎牛血清的DMEM高糖培养基培养于37 ℃含5%CO2的细胞培养箱中。严格按照慢病毒转染试剂盒说明书敲减及过表达慢病毒转染CAL-62细胞,并通过嘌呤霉素筛选稳定转染的细胞。严格按照Lipofectamine 3000转染试剂说明书将荧光素酶报告基因质粒以及miR模拟物转染CAL-62细胞。
1.2.3 双荧光素酶报告基因实验取对数生长期CAL-62细胞均匀铺板于24孔板中,培养过夜后,将细胞分为8组:模拟物对照和NKX2-1-AS1-WT共转染组、miR-96-5p模拟物和NKX2-1-AS1-WT共转染组、模拟物对照和NKX2-1-AS1-MUT共转染组、miR-96-5p模拟物和NKX2-1-AS1-MUT共转染组、模拟物对照和PRDM16-WT共转染组、miR-96-5p模拟物和PRDM16-WT共转染组、模拟物对照和PRDM16-MUT共转染组以及miR-96-5p模拟物和PRDM16-MUT共转染组。各组细胞依照实验方案转染相应荧光素酶报告基因质粒以及miR模拟物或对照。转染后细胞继续培养24 h,弃培养基,按照双荧光素酶报告基因检测试剂盒说明书检测细胞的荧光素酶活性。
1.2.4 Western blotting检测取对数生长期CAL-62细胞均匀铺板于6孔板中,培养过夜后,将细胞分为过表达对照(ov-NC)组、ov-NKX2-1-AS1组、ov-NKX2-1-AS1+模拟物对照组和ov-NKX2-1-AS1+miR-96-5p模拟物组。各组细胞依照实验方案转染相应慢病毒以及miR模拟物或对照。转染后细胞继续培养48 h,弃培养基,PBS洗去残余培养基,用RIPA裂解液提取组织总蛋白,BCA法定量蛋白。上样并进行SDS-聚丙烯酰胺凝胶电泳,将蛋白转移至PVDF膜,5%脱脂奶粉封闭,加入PRDM16(1∶1 000稀释)和β-actin(1∶5 000稀释)抗体,4 ℃孵育过夜。PBST洗膜3次,二抗室温孵育1 h,PBST洗膜3次,ECL化学发光,使用ImageJ软件进行蛋白分析。
1.2.5 平板克隆形成实验收集稳定转染的细胞并计数,完全培养基重悬细胞,将各组细胞以1×103/孔的密度接种于6孔板中,继续培养14 d,每隔3 d更换新鲜培养基。培养结束后弃培养基,4 %多聚甲醛固定,结晶紫染色。自来水洗去多余染色液,待晾干后拍照。
1.2.6 裸鼠成瘤实验收集稳定转染的细胞并计数,PBS重悬细胞,将细胞稀释至1×107/mL。取100 μL细胞悬液,向其中加入30 μL基质胶,将混匀后的悬液皮下注射裸鼠。继续饲养,每隔3 d用游标卡尺检测移植瘤的长径和短径并计算肿瘤体积。实验结束后,脱颈椎法安乐死裸鼠,取出移植瘤,称量肿瘤重量。
1.2.7 划痕实验收集稳定转染的细胞并计数,完全培养基重悬细胞,将各组细胞以1×105/孔密度接种于6孔板中,待细胞汇合度达90%,沿中线用移液器枪头划线。PBS洗去刮下的细胞并倒置显微镜下拍照。继续培养24 h后,PBS洗涤1次,倒置显微镜下拍照。
1.2.8 Transwell实验收集稳定转染的细胞并计数,无血清培养基重悬,将细胞加入包被基质胶的Transwell小室上室,下室中加入含20%胎牛血清的DMEM高糖培养基,继续培养24 h后弃培养基,甲醇固定30 min,0.1 %结晶紫染色20 min,棉签轻轻擦掉上层未迁移细胞,光学显微镜下观察并拍照。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析。计量资料采用x±s表示,多组间比较采用单因素方差分析,并采用Tukey事后检验进行组间两两比较。P<0.05为差异有统计学意义。
2 结果 2.1 ATC组织和细胞中差异表达基因筛选GSE65144数据集中共筛选出2 006个差异表达基因,GSE85457数据集共筛选出297个差异表达基因。2个数据集取交集,获得68个差异表达基因。其中下调62个,上调6个。NKX2-1-AS1是唯一下调的lncRNA。见表 1、2。
| Gene | ID | log2FC | Adjusted P | Gene | ID | log2FC | Adjusted P | |
| DEPTOR | 218858_at | -5.695 72 | 0.016 00 | LOC100507477 | 1555869_a_at | -4.033 97 | 0.030 46 | |
| ID4 | 226933_s_at | -7.160 93 | 0.005 52 | NOX4 | 219773_at | -6.333 76 | 0.020 33 | |
| TPO | 210342_s_at | -9.002 28 | 0.002 69 | COL4A3 | 214641_at | -4.866 45 | 0.017 57 | |
| ATP8A1 | 213106_at | -5.365 55 | 0.042 52 | ZNF862 | 213444_at | -4.027 03 | 0.013 67 | |
| ID4 | 209292_at | -8.212 46 | 0.023 97 | Previous version conserved probe |
239066_at | -6.679 20 | 0.026 98 | |
| PRDM16 | 232424_at | -7.146 99 | 0.022 80 | ACADL | 206068_s_at | -2.477 18 | 0.030 46 | |
| SMAD9 | 227719_at | -6.467 82 | 0.004 18 | MXRA5 | 209596_at | -7.708 81 | 0.005 52 | |
| HLF | 204753_s_at | -6.948 26 | 0.032 19 | Previous version conserved probe |
222325_at | -5.260 28 | 0.046 58 | |
| ST6GALNAC3 | 235334_at | -4.411 71 | 0.034 63 | CYP39A1 | 220432_s_at | -2.814 37 | 0.046 58 | |
| SCUBE3 | 228407_at | -3.402 03 | 0.045 16 | Previous version conserved probe |
241873_at | -4.202 42 | 0.010 60 | |
| ID4 | 209291_at | -7.959 97 | 0.005 52 | TMEM132B | 236824_at | -7.080 32 | 0.005 52 | |
| NEBL | 203962_s_at | -4.670 64 | 0.023 22 | RMST | 229782_at | -9.033 80 | 0.005 52 | |
| DYNLRB2 | 238116_at | -3.042 27 | 0.048 76 | PDE1A | 231213_at | -7.881 88 | 0.012 65 | |
| Previous version conserved probe |
227762_at | -3.941 59 | 0.023 70 | GPR27 | 227769_at | -3.464 51 | 0.033 33 | |
| Previous version conserved probe |
228854_at | -6.977 68 | 0.005 52 | BGN | 213905_x_at | -8.291 76 | 0.049 97 | |
| METTL7A | 207761_s_at | -4.562 72 | 0.013 83 | SORBS2 | 220858_at | -4.317 77 | 0.049 97 | |
| NPNT | 225911_at | -8.839 12 | 0.020 20 | COL11A1 | 204320_at | -6.970 81 | 0.048 90 | |
| PBX1 | 212148_at | -4.790 49 | 0.016 99 | CCDC74B | 227966_s_at | -5.008 17 | 0.042 52 | |
| ID4 | 209293_x_at | -3.402 17 | 0.040 32 | LMOD1 | 203766_s_at | -5.879 82 | 0.016 14 | |
| IYD | 231070_at | -4.544 34 | 0.045 67 | IQCA1 | 220274_at | -4.543 60 | 0.030 46 | |
| PPIEL | 222054_at | -3.470 07 | 0.044 28 | ZBTB16 | 205883_at | -3.163 29 | 0.045 67 | |
| SELENBP1 | 214433_s_at | -5.973 60 | 0.010 68 | PDE1A | 1558680_s_at | -9.158 22 | 0.005 52 | |
| IP6K3 | 231179_at | -4.246 48 | 0.040 71 | CLU | 208792_s_at | -5.934 06 | 0.040 32 | |
| EPHX2 | 209368_at | -4.853 35 | 0.009 27 | CAPS | 231729_s_at | -5.566 04 | 0.011 16 | |
| TG | 203673_at | -7.382 29 | 0.042 11 | NKX2-1-AS1 | 236579_at | -4.671 33 | 0.022 54 | |
| PDE1A | 208396_s_at | -10.495 7 | 0.005 52 | HOMER2 | 1556097_at | -3.184 05 | 0.039 57 | |
| NTRK2 | 221796_at | -5.400 73 | 0.017 57 | CRYAB | 209283_at | -4.834 20 | 0.049 74 | |
| HLF | 204754_at | -6.657 37 | 0.030 77 | MAGEL2 | 219894_at | -4.540 53 | 0.042 11 | |
| TSHR | 215443_at | -5.799 69 | 0.022 80 | NCAM1 | 227394_at | -4.418 31 | 0.022 80 | |
| GPX3 | 201348_at | -8.399 22 | 0.033 52 | ASXL3 | 214162_at | -4.072 43 | 0.022 80 | |
| KCNJ16 | 219564_at | -9.050 70 | 0.014 62 | GFRA1 | 227550_at | -6.642 47 | 0.032 80 |
| Gene | ID | log2FC | Adjusted P |
| DUXAP10 | 242546_at | 5.981 624 | 0.010 68 |
| DUXAP10 | 242881_x_at | 4.495 518 | 0.010 68 |
| Previous version conserved probe | 231882_at | 3.963 215 | 0.029 33 |
| NCF2 | 209949_at | 5.448 780 | 0.027 75 |
| MX2 | 204994_at | 3.647 222 | 0.040 54 |
| DUXAP8 | 228116_at | 5.049 554 | 0.005 52 |
2.2 NKX2-1-AS1标靶miR及下游靶基因预测
miRcode在线数据库预测结果显示,miR-96-5p是NKX2-1-AS1的标靶miR。ENCORI在线数据库预测结果显示,miR-96-5p共有202个下游靶基因。将ATC组织和细胞中表达下调的51个基因(除去无意义和重复)与miR-96-5p的下游靶基因取交集,结果显示,PRDM16是唯一的ATC组织和细胞中表达下调的miR-96-5p靶基因。见图 1。
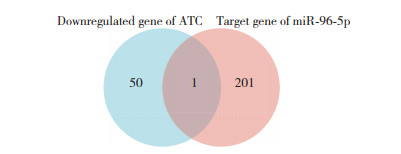
|
| 图 1 ATC组织和细胞中表达下调基因和miR-96-5p下游靶基因的韦恩分析 Fig.1 Venn diagram of downregulated genes and downstream target genes of miR-96-5p in ATC tissues and cells |
2.3 miR-96-5p与NKX2-1-AS1、PRDM16的关系及验证
miRcode在线数据库和ENCORI在线数据库预测的miR-96-5p与NKX2-1-AS1和PRDM16间的潜在结合位点见图 2。双荧光素酶报告基因实验检测结果显示,与模拟物对照和NKX2-1-AS1-WT共转染组(1.05±0.08)比较,miR-96-5p模拟物和NKX2-1-AS1-WT共转染组(0.31±0.02)CAL-62细胞的相对荧光素酶活性明显降低(P<0.05);与模拟物对照和NKX2-1-AS1-MUT共转染组(1.03±0.10)比较,miR-96-5p模拟物和NKX2-1-AS1-MUT共转染组(0.98± 0.09)CAL-62细胞的相对荧光素酶活性无统计学差异(P>0.05)。与模拟物对照和PRDM16-WT共转染组(1.01±0.11)比较,miR-96-5p模拟物和PRDM16-WT共转染组(0.27±0.03)CAL-62细胞的相对荧光素酶活性明显降低(P<0.05);与模拟物对照和PRDM16-MUT共转染组(0.98±0.08)比较,miR-96-5p模拟物和PRDM16-MUT共转染组(0.94±0.05)CAL-62细胞的相对荧光素酶活性差异无统计学意义(P>0.05)。

|
| 图 2 NKX2-1-AS1与miR-96-5p以及miR-96-5p与PRDM16的潜在结合位点 Fig.2 Potential binding sites of NKX2-1-AS1 and PRDM16 with miR-96-5p |
2.4 NKX2-1-AS1介导miR-96-5p调节ATC细胞PRDM16表达
Western blotting检测结果如图 3所示,与ov-NC组比较,ov-NKX2-1-AS1组和ov-NKX2-1-AS1+模拟物对照组CAL-62细胞PRDM16蛋白表达明显升高(P<0.05);与ov-NKX2-1-AS1组和ov-NKX2-1-AS1+模拟物对照组比较,ov-NKX2-1-AS1+miR-96-5p模拟物组CAL-62细胞PRDM16蛋白表达明显降低(P<0.05)。
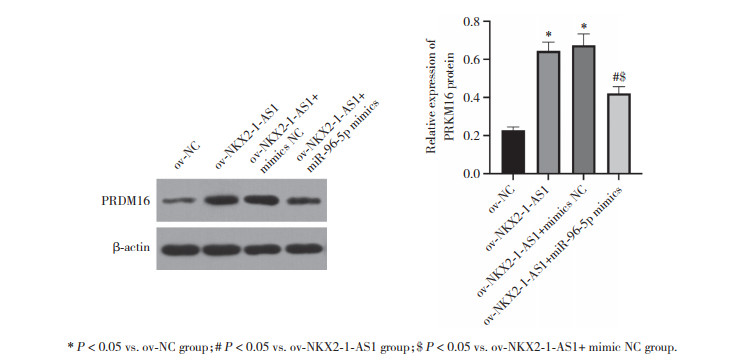
|
| * P<0.05 vs. ov-NC group; # P<0.05 vs. ov-NKX2-1-AS1 group; $ P<0.05 vs. ov-NKX2-1-AS1+ mimic NC group. 图 3 Western blotting检测各组细胞中PRDM16蛋白表达情况 Fig.3 Cellular PRDM16 protein expression detected using Western blotting in each group |
2.5 NKX2-1-AS1介导PRDM16调节ATC细胞增殖
平板克隆形成实验检测结果显示,与ov-NC组比较,ov-NKX2-1-AS1组和ov-NKX2-1-AS1+sh-NC组CAL-62细胞克隆形成数明显降低(P<0.05);与ov-NKX2-1-AS1组和ov-NKX2-1-AS1+sh-NC组比较,ov-NKX2-1-AS1+sh-PRDM16组CAL-62细胞克隆形成数明显升高(P<0.05)。见图 4。
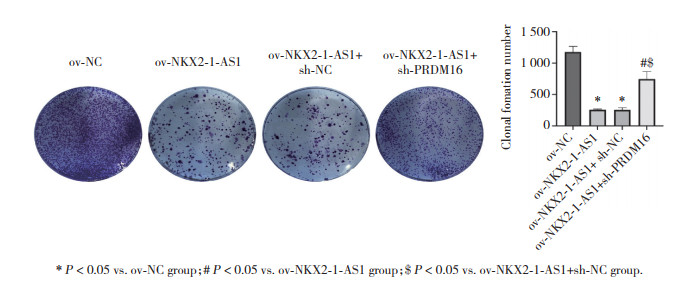
|
| * P<0.05 vs. ov-NC group; # P<0.05 vs. ov-NKX2-1-AS1 group; $ P<0.05 vs. ov-NKX2-1-AS1+sh-NC group. 图 4 平板克隆形成实验检测各组细胞增殖 Fig.4 Cellular proliferation detected using plate cloning assay in each group |
2.6 NKX2-1-AS1介导PRDM16调节ATC细胞移植瘤生长
结果显示,与ov-NC组比较,ov-NKX2-1-AS1组和ov-NKX2-1-AS1+sh-NC组CAL-62细胞移植瘤体积和重量均明显降低(P<0.05);与ov-NKX2-1-AS1组和ov-NKX2-1-AS1+sh-NC组比较,ov-NKX2-1-AS1+sh-PRDM16组CAL-62细胞移植瘤体积和质量均明显升高(P<0.05),见图 5。

|
| * P<0.05 vs. ov-NC group; # P<0.05 vs. ov-NKX2-1-AS1 group; $ P<0.05 vs. ov-NKX2-1-AS1+sh-NC group. 图 5 各组细胞移植瘤生长情况 Fig.5 Transplanted tumor cell growth status in each group |
2.7 NKX2-1-AS1介导PRDM16调节ATC细胞迁移和侵袭
划痕实验检测结果显示,与ov-NC组比较,ov-NKX2-1-AS1组和ov-NKX2-1-AS1+sh-NC组CAL-62细胞划痕愈合率明显降低(P<0.05);与ov-NKX2-1-AS1组和ov-NKX2-1-AS1+sh-NC组比较,ov-NKX2-1-AS1+sh-PRDM16组CAL-62细胞划痕愈合率明显升高(P<0.05),见图 6。
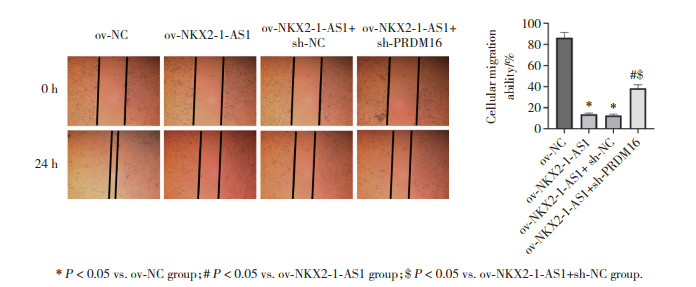
|
| * P<0.05 vs. ov-NC group; # P<0.05 vs. ov-NKX2-1-AS1 group; $ P<0.05 vs. ov-NKX2-1-AS1+sh-NC group. 图 6 划痕实验检测各组细胞迁移能力 ×400 Fig.6 Cellular migration ability in scratch experiment in each group ×400 |
Transwell实验检测结果显示,与ov-NC组比较,ov-NKX2-1-AS1组和ov-NKX2-1-AS1+sh-NC组CAL-62细胞侵袭能力明显降低(P<0.05);与ov-NKX2-1-AS1组和ov-NKX2-1-AS1+sh-NC组比较,ov-NKX2-1-AS1+sh-PRDM16组CAL-62细胞侵袭能力明显升高(P<0.05)。见图 7。

|
| * P<0.05 vs. ov-NC group; # P<0.05 vs. ov-NKX2-1-AS1 group; $ P<0.05 vs. ov-NKX2-1-AS1+sh-NC group. 图 7 Transwell实验检测各组细胞侵袭能力 ×400 Fig.7 Cellular invasion ability in Transwell assay in each group ×400 |
3 讨论
ATC是最具侵袭性和致命性的人类恶性肿瘤,传统的治疗方法无法延长患者的生存期[4]。近年来,对ATC遗传和分子机制的深入探究有望为有效靶点的开发提供新方向。以往研究[3, 5]表明,lncRNA可能作为ATC治疗的潜在靶点。本研究基于生物信息学分析了ATC组织和细胞中的差异表达基因,并筛选出NKX2-1-AS1是唯一表达明显下调的lncRNA。以往研究表明NKX2-1-AS1在胃癌和肺癌中发挥作用。一项生物信息学研究[6]表明,NKX2-1-AS1可能在胃癌中充当竞争性内源性RNA(competing endogenous RNA,ceRNA)。TENG等[7]研究发现,NKX2-1-AS1在胃癌细胞系和肿瘤组织中表达上调,其高表达与肿瘤进展和血管生成增强显著相关,其过表达促进胃癌细胞的增殖、转移、侵袭和血管生成。它的作用机制可能是NKX2-1-AS1作为ceRNA与miR-145-5p竞争结合其靶基因纤溶酶原激活物抑制因子1(plasminogen activator inhibitor 1,PAI1),导致PAI1表达上调,从而激活血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)-2信号通路,促进肿瘤进展和血管生成。KATHURIA等[8]研究发现,NKX2-1-AS1在肺癌组织中表达上调,通过干扰NKX2-1蛋白与程序性死亡配体-1(programmed death ligand-1,PD-L1)基因的启动子结合,负调节NKX2-1表达,从而抑制肺癌细胞的迁移。本研究结果显示,过表达NKX2-1-AS1抑制ATC细胞体外增殖、迁移和侵袭以及体内移植瘤生长,表明NKX2-1-AS1在ATC中发挥抑制作用。
miR-96-5p在甲状腺癌中发挥的作用已广泛报道。HU等[9]研究发现,miR-96-5p在甲状腺乳头状癌(papillary thyroid cancer,PTC)组织中表达上调,且磷脂酰肌醇蛋白聚糖3(glypican 3,GPC3)是其下游靶基因。ZHAO等[10]研究发现miR-96-5p通过靶向抑制琥珀酸脱氢酶复合物铁硫亚基B(succinate dehydrogenase complex iron sulfur subunit B,SDHB)表达导致蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路激活,从而促进PTC细胞侵袭和迁移。LIU等[11]研究发现miR-96-5p通过靶向抑制含有卷曲螺旋结构域的蛋白67(coiled-coil domain-containing protein 67,CCDC67)表达促进PTC发展。此外,还有研究[12]发现lncRNA生长停滞特异基因5(growth arrest specific 5,GAS5)通过海绵化miR-96-5p抑制ATC细胞增殖及阿霉素耐药。本研究通过生物信息学分析了与NKX2-1-AS1具有潜在结合位点的miRNA,发现了miR-96-5p与NKX2-1-AS1的结合关系并获得验证。
PRDM16也称为MDS1/EVI1样基因1(MDS1/EVI1-like gene 1,MEL1),是PR结构域锌指家族的成员之一[13]。本研究通过生物信息学分析并筛选miR-96-5p的下游靶基因,发现PRDM16是唯一的ATC组织和细胞中表达下调的miR-96-5p的靶基因;并且本研究验证了miR-96-5p与PRDM16的结合关系。LIU等[14]研究发现PRDM16在PTC组织中表达下调,其通过直接结合丙酮酸羧化酶启动子下调其表达,从而抑制PTC细胞增殖和迁移。本研究结果显示,过表达NKX2-1-AS1上调ATC细胞中PRDM16蛋白表达;而过表达miR-96-5p可逆转此上调作用。此外,本研究结果显示,敲减PRDM16逆转了过表达NKX2-1-AS1对ATC细胞体外增殖、迁移和侵袭以及体内移植瘤生长的抑制作用,与以往研究结果一致。
综上所述,NKX2-1-AS1可能作为ceRNA与miR-96-5p竞争结合其下游靶基因PRDM16,上调PRDM16表达,从而抑制ATC细胞体外增殖、迁移和侵袭以及体内移植瘤生长。然而,本研究存在一些局限性。首先,本研究主要集中在体外细胞实验和裸鼠移植瘤模型上,缺乏对ATC患者样本的深入分析。其次,本研究虽然分析了NKX2-1-AS1对miR-96-5p和PRDM16的调节作用,但未涉及NKX2-1-AS1通过其他可能的分子机制或信号通路影响ATC发展的可能性。因此,未来应进一步验证NKX2-1-AS1在ATC患者样本中的表达及其临床意义,探索NKX2-1-AS1是否通过其他分子机制参与ATC的发病过程。同时,需深入研究NKX2-1-AS1、miR-96-5p和PRDM16之间的相互作用及其在其他癌症中的作用,以便为癌症治疗提供更多的靶点。
| [1] |
LIN B, MA HQ, MA MG, et al. The incidence and survival analysis for anaplastic thyroid cancer: a SEER database analysis[J]. Am J Transl Res, 2019, 11(9): 5888-5896. |
| [2] |
MANIAKAS A, ZAFEREO M, CABANILLAS ME. Anaplastic thyroid cancer: new horizons and challenges[J]. Endocrinol Metab Clin North Am, 2022, 51(2): 391-401. DOI:10.1016/j.ecl.2021.11.020 |
| [3] |
JAVED Z, AHMED SHAH F, RAJABI S, et al. LncRNAs are potential therapeutic targets for thyroid cancer[J]. Asian Pac J Cancer Prev, 2020, 21(2): 281-287. DOI:10.31557/APJCP.2020.21.2.281 |
| [4] |
YANG J, BARLETTA JA. Anaplastic thyroid carcinoma[J]. Semin Diagn Pathol, 2020, 37(5): 248-256. DOI:10.1053/j.semdp.2020.06.005 |
| [5] |
SAMIMI H, SAJJADI-JAZI SM, et al. Molecular mechanisms of long non-coding RNAs in anaplastic thyroid cancer: a systematic review[J]. Cancer Cell Int, 2020, 20(1): 352. DOI:10.1186/s12935-020-01439-w |
| [6] |
WANG J, DING YR, WU YY, et al. Identification of complex regulatory relationships related to gastric cancer from the lncRNA-miRNA- mRNA network[J]. J Cell Biochem, 2020, 121(1): 876-887. DOI:10.1002/jcb.29332 |
| [7] |
TENG F, ZHANG JX, CHEN Y, et al. The lncRNA NKX2-1-AS1 promotes tumor progression and angiogenesis by upregulating SERPINE1 expression and activating the VEGFR-2 signaling pathway in gastric cancer[J]. Mol Oncol, 2021, 15(4): 1234-1255. DOI:10.1002/1878-0261.12911 |
| [8] |
KATHURIA H, MILLIEN G, MCNALLY L, et al. NKX2-1-AS1 negatively regulates CD274/PD-L1 cell-cell interaction genes and limits human lung carcinoma cell migration[J]. Sci Rep, 2018, 8(1): 14418. DOI:10.1038/s41598-018-32793-5 |
| [9] |
HU HB, QUAN GQ, YANG F, et al. MicroRNA-96-5p negatively regulates GPC3 during papillary thyroid cancer metastasis[J]. SAGE Open Med, 2023, 11: 20503121231205710. DOI:10.1177/20503121231205710 |
| [10] |
ZHAO XP, LI YJ, ZHOU Y. MicroRNA-96-3p promotes metastasis of papillary thyroid cancer by targeting SDHB[J]. Cancer Cell Int, 2019, 19: 287. DOI:10.1186/s12935-019-1003-y |
| [11] |
LIU ZM, WU ZY, LI WH, et al. MiR-96-5p promotes the prolifera- tion, invasion, and metastasis of papillary thyroid carcinoma by downregulating CCDC67[J]. Eur Rev Med Pharmacol Sci, 2019, 23(8): 3421-3430. DOI:10.26355/eurrev_201904_17706 |
| [12] |
SONG CQ, WANG M, ZHANG SM, et al. The lncRNA GAS5 inhi- bits cell proliferation and doxorubicin resistance in anaplastic thyroid carcinoma by regulating miR-96[J]. J Biol Regul Homeost Agents, 2020, 34(5): 1787-1792. DOI:10.23812/20-420-L |
| [13] |
JIANG N, YANG M, HAN YC, et al. PRDM16 regulates adipocyte transformation and thermogenesis, and is a promising therapeutic target for obesity and diabetes[J]. Front Pharmacol, 2022, 13: 870250. DOI:10.3389/fphar.2022.870250 |
| [14] |
LIU WL, GUAN Q, WEN D, et al. PRDM16 inhibits cell prolife- ration and migration via epithelial-to-mesenchymal transition by directly targeting pyruvate carboxylase in papillary thyroid cancer[J]. Front Cell Dev Biol, 2021, 9: 723777. DOI:10.3389/fcell.2021.723777 |
 2024, Vol. 53
2024, Vol. 53




