文章信息
- 郭丹丹, 钱佳燕, 陈悦, 翁嘉晨, 黄子慧
- GUO Dandan, QIAN Jiayan, CHEN Yue, WENG Jiachen, HUANG Zihui
- 基于网络药理学探讨槲皮素治疗结核性溃疡的机制
- Mechanism of quercetin in tuberculous ulcer treatment using network pharmacology
- 中国医科大学学报, 2024, 53(6): 509-515, 524
- Journal of China Medical University, 2024, 53(6): 509-515, 524
-
文章历史
- 收稿日期:2023-06-12
- 网络出版时间:2024-05-31 11:22:03
结核性溃疡(tuberculous ulcer,TU)是指由结核分枝杆菌侵犯局部机体组织,引起病灶周围软组织、皮下及皮肤坏死,最终破溃所形成的创面,是临床最为常见的一种特异性感染性疾病[1]。TU病程易反复,临床治疗难度大[2]。
南京市中西医结合医院瘰疬科院内制剂复方五凤草液(五凤草、白芨、猫爪草)促进TU创面愈合的临床疗效显著。复方五凤草液的体外化学成分包含槲皮素。槲皮素可以通过调控巨噬细胞极化发挥抗炎作用[3],且槲皮素对结核分枝杆菌有明显的抑制作用,效果与链霉素相同[4],动物实验表明槲皮素可以减轻糖尿病伤口过度炎症反应从而促进创面愈合[5]。由此推测,槲皮素可能是复方五凤草液发挥疗效的关键物质。本研究基于网络药理学构建疾病-单体-靶点-通路作用网络,探讨槲皮素对TU的作用机制,以期为新药的开发提供依据。
1 材料与方法 1.1 网络药理学资料与方法 1.1.1 药物靶点筛选在PubChem数据库中收集槲皮素的Canonical SMILES名称及2D结构信息,将SMILES名称输入SwissTarget数据库(http://www.swisstargetprediction.ch/)及Targetnet数据库(http://targetnet.scbdd.com/)进行药物靶点预测,筛选出可能性 > 0的结果,合并去重后得到槲皮素的相关靶点,利用UniProt数据库(https://www.uniprot.org/)将靶点蛋白转换为对应的人源性基因,剔除非人源基因,得到槲皮素靶点基因。
1.1.2 疾病靶点筛选选取前期课题组[6]基因测序相关数据集,数据集纳入3例TU患者创面组织标本及3例创面旁正常组织,所有标本经过病理切片形态学鉴定。
1.1.3 绘制韦恩图将药物靶点与疾病靶点导入Jvenn(http://jvenn.toulouse.inra.fr/app/example.html)获得两者的交集基因,作为槲皮素治疗TU的潜在靶点。
1.1.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建及核心靶点筛选将槲皮素-TU交集靶点上传至STRING平台,限定物种为“智人”,置信度设置为高等(0.7),隐藏网络中断开的节点,得到交集基因的PPI网络图,将文件以“TSV”格式导入Cytoscape3.9.1软件,使用CytoHubba插件中MCC算法,筛选出度值排行前10的基因为核心基因。
1.1.5 药物靶点富集分析通过DAVID数据库对基因本体(gene ontology,GO)富集分析与京都基因和基因组数据库(Kyoto encyclopedia of genes and genomes,KEGG)信号通路进行富集分析,所得数据按P值降序排列(P < 0.05),取前10条信息进行可视化。
1.1.6 构建“疾病-化合物-靶点-通路”网络将交集靶点基因、KEGG通路信息导入Cytoscape3.9.1软件,构建疾病-化合物-靶点-通路网络,经拓扑网络分析后用cytoNCA插件计算各靶点的度值(degree)、中介中心性(betweenness centrality,BC)、接近中心性(closeness centrality,CC),选取三者平均数及以上的交集靶点为关键核心靶点。
1.1.7 分子对接将疾病-化合物-靶点-通路网络图节点最高的基因作为受体,与槲皮素进行下一步分子对接,从PDB数据库(https://www.rcsb.org/)中获得核心靶点受体配体复合物,利用PyMOL软件去除靶蛋白的水分子及配体,从PubChem数据库中下载得到槲皮素的3D-SDF结构,转换为PDB格式,用AutoDock Tolls对受体和配体进行预处理,保存PDBQT格式备用,最后利用PyMol软件进行分子对接可视化。
1.2 细胞实验研究 1.2.1 实验材料及仪器人组织淋巴瘤细胞U937购自中国科学院细胞库。佛波酯(phorbol 12-myristate 13-acetate,PMA,美国Sigma公司),脂多糖(lipopolysaccharide,LPS,美国Solarbio公司),人白细胞介素-4(interleukin-4,IL-4,美国PEPRO TECH公司96-200-04-5),磷酸盐缓冲液(美国Gibco公司),FastPure Cell/Tissue Total RNA Isolation Kit V2试剂盒(诺唯赞生物科技有限公司),槲皮素(北京索莱宝科技有限公司),CCK-8试剂(UEL-C6005M),DEPC水(上海源叶生物科技有限公司),PrimScript RT Master Mix(日本TaKaRa公司),ChamQSYBR qPCR MasterMix(南京Vazyme公司),引物(上海生工生物公司),RPMI1640培养基(美国Corning公司),ExCell胎牛血清(美国Gibco公司),PS(美国Gibco公司)。多功能酶标仪(美国Molecular Devices有限公司),高速低温离心机(德国Hettich公司),IMS-25全自动雪花制冰机(常熟雪科公司),T100梯度PCR仪(美国BIORAD公司),全自动荧光PCR分析仪(瑞士Roche公司)。
1.2.2 细胞培养根据实验所需体积配制培养基,细胞移至有13 mL完全培养基的75 T培养瓶,在37 ℃、5% CO2培养箱中培养,隔天观察,若漂浮细胞多可进行换液,培养瓶中细胞密度 > 90%时进行传代,后继续培养。采用200 ng/mL PMA诱导24 h建立未活化型M0细胞,200 ng/mL LPS诱导48 h建立经典活化型M1细胞,40 ng/mL IL-4诱导48 h建立选择活化型M2细胞。
1.2.3 CCK-8细胞活力检测取对数期生长的U937细胞(2×105/mL,100 μL/孔)接种于96孔板中,铺板的同时加入200 ng/mL PMA,于37 ℃、5% CO2培养箱中培养,诱导24 h得到U937-M0细胞,然后用200 ng/mL LPS诱导48 h,得到U937-M1巨噬细胞。槲皮素稀释至5、2.5、1.25、0.625、0.313、0.156、0.078 mmol/L,按以上浓度给药,干预24 h后每孔加入CCK-8试剂10 μL(总体积的1/10),孵育2 h后酶标仪在吸光度450 nm下检测光密度(optical density,OD)值。计算存活率,确定后续实验浓度。
1.2.4 实时PCR检测U937细胞以3×106/孔接种于6孔板中,分成U937-M1、U937-M2、U937-M1+槲皮素和U937-M2+槲皮素4组进行干预。24 h后收集细胞,按照试剂盒说明书步骤提取RNA,逆转录为cDNA,采用qPCR试剂盒进行实时PCR检测,引物序列如表 1所示,以GAPDH为内参基因,利用2-△△Ct法计算各基因表达水平。
| Gene | Primer sequence(5’-3’) | Length(bp) | |
| TNF | Forward primer | AGCCCATGTTGTAGCAAACC | 227 |
| Reverse primer | TCTGGTAGGAGACGGCGATG | ||
| MMP9 | Forward primer | CCTGGAGACCTGAGAACCAATC | 188 |
| Reverse primer | CCACCCGAGTGTAACCATAGC | ||
| EGFR | Forward primer | GATGTCTGGAGCTACGGGGT | 194 |
| Reverse primer | TTTGGGCGACTATCTGCGT | ||
| ALOX5 | Forward primer | GTCAACTTCGGCCAGTACGA | 271 |
| Reverse primer | CCTCGAGGTTCTTGCGGAAT | ||
| SRC | Forward primer | ACCTTTGTGGCCCTCTATGAC | 243 |
| Reverse primer | CAGTAACCGCTCTGACTCCC | ||
| GAPDH | Forward primer | GGAGCGAGATCCCTCCAAAAT | 140 |
| Reverse primer | GGCTGTTGTCATACTTCTCATGG | ||
1.3 统计学分析
采用SPSS 26.0软件进行统计分析。组间比较先进行正态性检验,若服从正态分布,以x±s表示;各组间差异比较采用单因素方差分析,采用Graphpad prism 8.0软件进行数据分析和显著性差异分析。P < 0.05为差异有统计学意义。
2 结果 2.1 生物信息分析结果 2.1.1 槲皮素靶点与TU的韦恩交集在SwissTarget数据库获得106个靶点,Targetnet数据库剔除非人源基因后获得109个靶点,合并去重后共获得176个靶点,课题组前期TU患者创面组织及创面旁正常组织基因测序结果中,共有3 270个差异基因,最终获得54个交集基因,见图 1。
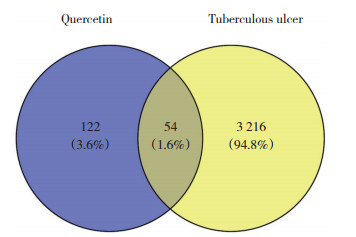
|
| 图 1 槲皮素与TU疾病共同靶点韦恩图 Fig.1 Venn diagram of the common quercetin and TU disease targets |
2.1.2 PPI网络图及核心基因的筛选
将韦恩图中交集靶点基因导入STRING平台,物种选择为“智人”,绘制PPI网络图(图 2),并将结果以“TSV”格式导出,上传至Cytoscape3.9.1软件,运用CytoHubba插件中MCC算法得到化学单体与TU共同靶点排名前10的核心基因作为潜在的靶点基因,颜色越红表示该节点关联度越强(图 3)。
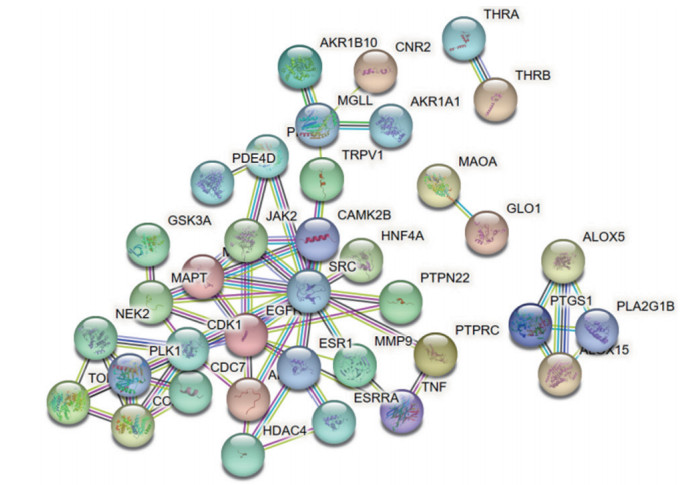
|
| 图 2 槲皮素-TU交集靶点PPI网络图 Fig.2 PPI network diagram of the quercetin-TU intersection targets |
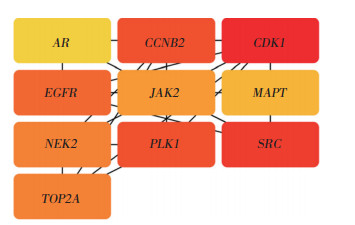
|
| 图 3 槲皮素-TU共同靶点排名前10的基因 Fig.3 The top 10 genes in the quercetin-TU common target list |
2.1.3 GO和KEGG分析
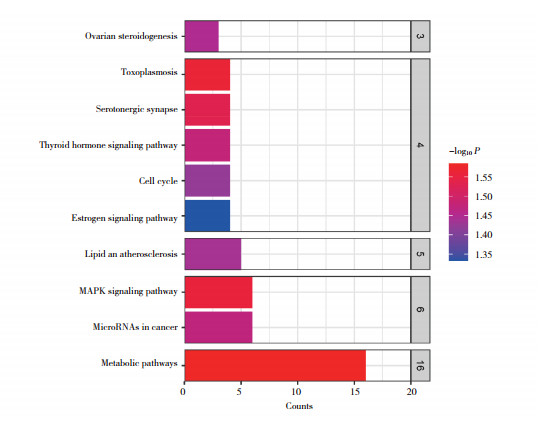
将生物过程、分子功能、细胞组分功能富集分析和KEGG通路富集分析所得结果按P < 0.05进行矫正并排序,选取前10条信息在微生信平台进行可视化分析,GO功能富集共获得210条结果,其中生物学过程条目143条,分子功能条目16条,细胞成分条目51条(图 4),KEGG通路富集分析共获得24条信号通路,涉及MAPK信号通路、细胞周期、脂质与动脉粥样硬化等(图 5)。
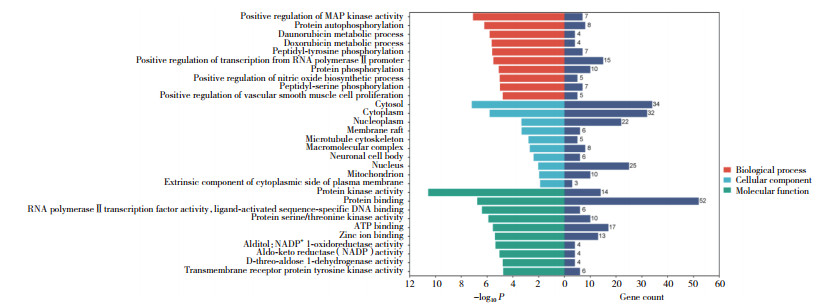
|
| 图 4 GO功能富集分析结果 Fig.4 GO function enrichment analysis results |
|
| 图 5 KEGG富集分析结果 Fig.5 KEGG enrichment analysis results |
2.1.4 疾病-化合物-靶点-通路网络图
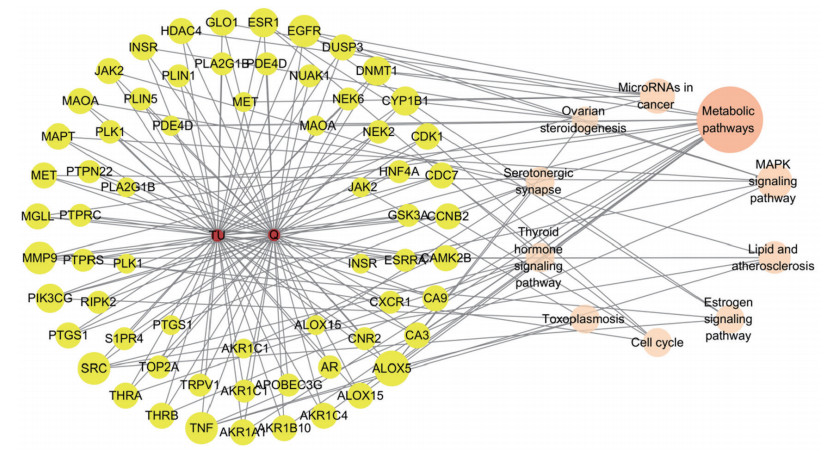
将槲皮素-TU的交集靶点及富集通路信息导入Cytoscape3.9.1软件,进行疾病-化合物-靶点-通路网络图的构建(图 6),利用cytoNCA插件计算各靶点的degree、BC、CC值。排名前10的靶点基因及富集通路如表 2所示,ALOX5、TNF、SRC、MMP9、EGFR可能是槲皮素治疗TU的关键基因,代谢途径、脂质与动脉粥样硬化、癌症中的微RNA、MAPK信号通路及雌激素信号通路可能是槲皮素治疗TU的关键通路。
|
| 图 6 槲皮素治疗TU的化合物-疾病-靶点-通路网络图 Fig.6 Compound-disease-target-pathway network diagram for quercetin-mediated TU treatment |
| Target gene/pathway | Degree | Betweenness | Closeness |
| Metabolic pathways | 12.0 | 58.428 14 | 0.382 352 95 |
| ALOX5 | 6.0 | 162.043 46 | 0.500 000 00 |
| Lipid and atherosclerosis | 5.0 | 11.399 52 | 0.357 142 87 |
| microRNAs in cancer | 5.0 | 10.863 86 | 0.357 142 87 |
| MAPK signaling pathway | 5.0 | 10.189 66 | 0.353 260 87 |
| TNF | 5.0 | 89.600 13 | 0.492 424 25 |
| SRC | 5.0 | 85.199 02 | 0.492 424 25 |
| MMP9 | 5.0 | 77.405 82 | 0.492 424 25 |
| EGFR | 5.0 | 79.458 08 | 0.492 424 25 |
| Estrogen signaling pathway | 4.0 | 6.271 20 | 0.349 462 36 |
2.1.5 分子对接结果
结果显示,ALOX5、TNF、SRC、MMP9、EGFR与槲皮素对接分子结合能均 < 0,提示存在对接可能,见表 3。
| Ligand compound | Receptor protein | PDB(ID) | Binding energy(kJ/mol) |
| Quercetin | ALOX5 | 3v98 | -3.48 |
| Quercetin | TNF | 2e7a | -6.18 |
| Quercetin | SRC | 3geq | -3.81 |
| Quercetin | MMP9 | 1itv | -4.21 |
| Quercetin | EGFR | 1xkk | -4.91 |
2.1.6 基因测序关键基因表达结果
课题组前期3例TU患者创面组织标本及3例创面旁正常组织基因测序结果显示,除EGFR外,ALOX5、TNF、SRC、MMP9均在TU组织中高表达[6],见表 4。
| Gene | log2FC | P |
| TNF | 1.992 585 7 | 0.030 471 35 |
| MMP9 | 4.120 010 0 | 0.004 694 50 |
| EGFR | -3.292 872 2 | 0.003 515 56 |
| ALOX5 | 3.236 446 4 | 0.009 073 98 |
| SRC | 2.120 821 5 | 0.019 018 00 |
2.2 细胞实验结果 2.2.1 槲皮素不同浓度对巨噬细胞活力的影响
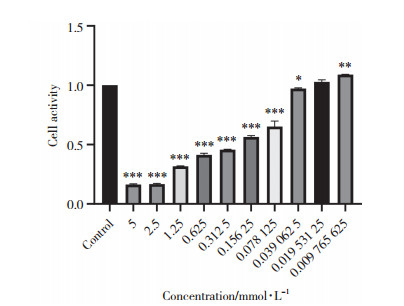
与对照组相比,干预24 h后,槲皮素给药浓度与细胞活力呈负相关,取细胞活性在80%左右的0.05 mmol/L(0.039 062~0.078 125 mmol/L)作为后续实验浓度,见图 7。
|
| *P < 0.05, **P < 0.01, ***P < 0.000 1 vs. control group. 图 7 不同浓度干预U937-M1型巨噬细胞24 h后细胞活性 Fig.7 Cell activity of U937-M1 macrophages treated with different concentrations for 24 h |
2.2.2 实时PCR结果
槲皮素干预后,M1巨噬细胞MMP9表达水平显著降低,M2巨噬细胞TNF及ALOX5表达水平显著升高,M1、M2巨噬细胞SRC及EGFR表达水平显著升高,差异有统计学意义(P < 0.05),见表 5。
| Gene | Contorl-M1 | M1-Q | Contorl-M2 | M2-Q |
| TNF | 1±0.399 2 | 1.402 2±0.373 9 | 1±0.443 3 | 5.788 0±1.970 41) |
| ALOX5 | 1±0.499 4 | 5.437 4±6.947 4 | 1±0.319 6 | 0.266 4±0.125 21) |
| SRC | 1±0.385 6 | 2.367 2±1.167 72) | 1±0.478 3 | 6.325 8±1.252 61) |
| MMP9 | 1±0.484 2 | 0.284 5±0.094 42) | 1±0.511 6 | 0.900 1±0.314 81) |
| EGFR | 1±0.483 9 | 6.844 1±6.047 12) | 1±0.418 8 | 2.890 8±0.797 51) |
| 1)P<0.05 compared with contorl-M2 group;2)P<0.05 compared with contorl-M1 group. n = 6. | ||||
3 讨论
TU是一种临床较为常见的慢性特异性感染性创面[1],其发病机制尚不完全明确,已有研究[7-8]证实其发病可能与巨噬细胞极化及生长因子表达相关。槲皮素是一种天然膳食类黄酮[9],研究[10]表明,槲皮素可以通过降低还原型辅酶Ⅱ(NAPDH)的表达抑制氧化应激,抑制核因子-κB的核易位,从而抑制肿瘤坏死因子-α及白细胞介素-1β的表达,最终达到抑制氧化应激及抗炎的作用。但是槲皮素治疗TU的信号通路及潜在靶点尚无报道,本研究利用网络药理学方法构建槲皮素-TU-靶点-信号通路网络图,系统分析槲皮素治疗TU的作用机制。
通过相关数据库筛选,共得到槲皮素与TU共同靶点54个,进一步进行KEGG信号通路分析得到24个相关通路,最后通过构建PPI,得出排名前10的关键基因及信号通路,涉及到的关键基因有ALOX5、TNF、SRC、MMP9和EGFR,相关信号通路包括代谢通路、脂质与动脉粥样硬化通路、肿瘤中微RNA通路、MAPK通路和雌激素通路。
细胞实验验证结果显示,槲皮素主要通过影响SRC、EGFR及MMP9表达水平实现其调控巨噬细胞极化的作用。研究[11]表明,抑制SRC可以增强诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达,而激活SRC可以促进IL-4诱导的精氨酸酶1(arginase 1,Arg-1)表达,本研究发现槲皮素可显著激活M1/M2型巨噬细胞SRC的表达,从而发挥抗炎作用。EGFR位于细胞膜表面,与配体结合后被磷酸化激活,研究[12]显示,磷酸化EGFR可以抑制IL-4诱导的巨噬细胞及M2巨噬细胞极化,与本研究结果相悖,但本研究为总EGFR mRNA水平测定,其具体机制有待进一步研究。MMP9作为一种胶原酶,已被证明在各种炎症和伤口愈合模型中发挥重要作用,研究[13]发现,与健康对照组相比,肺结核患者肺泡灌洗液中M1型巨噬细胞显著增多,MMP9表达也明显上调,进一步细胞实验结果显示,与对照组相比,牛结核分枝杆菌诱导的肺泡巨噬细胞MMP9表达也显著升高。另一项研究[14]结果显示,槲皮素可以通过降低痤疮分枝杆菌刺激的THP-1巨噬细胞MMP9的表达,从而减轻皮肤炎症,由此推测,槲皮素可以通过抑制巨噬细胞MMP9的表达减轻TU炎症状态。
本研究通过网络药理学及分子对接技术分析了槲皮素在治疗TU中的分子生物学机制,得出可能的潜在治疗靶点ALOX5、TNF、SRC、MMP9、EGFR,进一步在巨噬细胞模型上得到验证,结果显示,槲皮素干预后,M1、M2巨噬细胞SRC、EGFR表达显著升高,MMP9表达水平显著下降,表明槲皮素可能通过影响SRC、EGFR及MMP9表达水平发挥其调控巨噬细胞极化的作用。
| [1] |
刘万里, 黄子慧. 淋巴结结核中西医诊疗学[M]. 北京: 中国中医药出版社, 2018.
|
| [2] |
孙佳玥, 黄子慧, 钱佳燕, 等. 泄毒生新法外治结核性溃疡经验[J]. 中华中医药杂志, 2021, 36(7): 4037-4040. |
| [3] |
TSAI CF, CHEN GW, CHEN YC, et al. Regulatory effects of quercetin on M1/M2 macrophage polarization and oxidative/antioxidative balance[J]. Nutrients, 2021, 14(1): 67. DOI:10.3390/nu14010067 |
| [4] |
SASIKUMAR K, GHOSH AR, DUSTHACKEER A. Antimycobacterial potentials of quercetin and rutin against Mycobacterium tuberculosis H37Rv[J]. 3 Biotech, 2018, 8(10): 427. DOI:10.1007/s13205-018-1450-5 |
| [5] |
付佳, 黄潇红, 黄静娟, 等. 槲皮素对糖尿病伤口的促愈合作用及相关机制研究[J]. 广东药科大学学报, 2019, 35(3): 395-401. DOI:10.16809/j.cnki.2096-3653.2019041002 |
| [6] |
HUANG ZH, QIAN JY, JIN QY, et al. Expression and analyses of CXCL9/10/11 and CXCR3 in ulcerative cutaneous tuberculosis[J]. J Interferon Cytokine Res, 2022, 42(4): 180-190. DOI:10.1089/jir.2021.0163 |
| [7] |
钱佳燕. 复方五凤草液调控M1/M2巨噬细胞极化干预结核性溃疡的临床研究[D]. 南京: 南京中医药大学, 2020.
|
| [8] |
黄子慧, 张国英, 洪练青, 等. 复方五凤草液对结核性溃疡VEGF、FGF-2表达的影响[J]. 中医药导报, 2016, 22(8): 73-75. DOI:10.13862/j.cnki.cn43-1446/r.2016.08.024 |
| [9] |
SHEN P, LIN WJ, DENG X, et al. Potential implications of quercetin in autoimmune diseases[J]. Front Immunol, 2021, 12: 689044. DOI:10.3389/fimmu.2021.689044 |
| [10] |
SUL OJ, RA SW. Quercetin prevents LPS-induced oxidative stress and inflammation by modulating NOX2/ROS/NF-kB in lung epithelial cells[J]. Molecules, 2021, 26(22): 6949. DOI:10.3390/molecules26226949 |
| [11] |
HU X, WANG HM, HAN CF, et al. Src promotes anti-inflammatory (M2) macrophage generation via the IL-4/STAT6 pathway[J]. Cytokine, 2018, 111: 209-215. DOI:10.1016/j.cyto.2018.08.030 |
| [12] |
赵钢. EGFR信号通路对巨噬细胞M2型极化及其功能的影响及机制研究[D]. 天津: 天津医科大学, 2016.
|
| [13] |
LE YQ, CAO WL, ZHOU L, et al. Infection of Mycobacterium tuberculosis promotes both M1/M2 polarization and MMP production in cigarette smoke-exposed macrophages[J]. Front Immunol, 2020, 11: 1902. DOI:10.3389/fimmu.2020.01902 |
| [14] |
LIM HJ, KANG SH, SONG YJ, et al. Inhibitory effect of quercetin on Propionibacterium acnes-induced skin inflammation[J]. Int Immunopharmacol, 2021, 96: 107557. DOI:10.1016/j.intimp.2021.107557 |
 2024, Vol. 53
2024, Vol. 53




