文章信息
- 齐爽, 孙旋旋, 王绮萱, 贺意婷, 李佳睿, 苏敬阳, 郝丽英
- QI Shuang, SUN Xuanxuan, WANG Qixuan, HE Yiting, LI Jiarui, SU Jingyang, HAO Liying
- β淀粉样蛋白1-42质粒的构建及其与钙调蛋白的结合作用
- Construction of Aβ1-42 plasmid and its binding to calmodulin
- 中国医科大学学报, 2024, 53(6): 495-500
- Journal of China Medical University, 2024, 53(6): 495-500
-
文章历史
- 收稿日期:2023-08-05
- 网络出版时间:2024-05-31 11:20:45
2. 中国医科大学药学院临床药理学教研室,沈阳 110122
2. Department of Clinical Pharmacology, School of Pharmacy, China Medical University, Shenyang 110122, China
阿尔茨海默病(Alzheimer disease,AD)是一种多原因导致的神经退行性疾病,临床表现为认知功能下降、行为障碍、记忆力受损等[1]。目前AD的发病机制尚不清楚,多数研究认为淀粉样前体蛋白(amyloid precursor protein,APP)代谢紊乱和β淀粉样蛋白(amyloid-β protein,Aβ)沉积是AD最早的分子驱动因素。APP水解主要基于α途径,少量APP被β分泌酶水解,产生不溶性Aβ40和Aβ42。与Aβ40相比,Aβ42更先沉积于海马体、大脑皮质等神经元和毛细血管中,产生病理级联反应,导致斑块形成、神经纤维缠结(neuro fibrillary tangle,NFT)形成、tau蛋白异常磷酸化、突触丢失等,最终导致神经元死亡,故Aβ42被认为与AD的关系更紧密[2-4]。因此,本研究选择Aβ42作为研究对象,探讨其与钙调蛋白(calmodulin,CaM)的结合作用。
CaM是一种具有钙离子结合功能的蛋白,在长时程增强作用(long-term potentiation,LTP)、抑郁、记忆障碍和神经退行性疾病过程中发挥重要作用[5]。研究[6]发现,Aβ1-42与Ca2+/CaM存在直接相互作用,CaM与Aβ1-42结合能减缓Aβ原纤维的形成。当AD发生时,神经元细胞内Ca2+浓度显著增高[7]。钙超载状态下CaM与Aβ1-42之间的结合情况尚未见研究。因此,本研究利用基因表达综合(Gene Expression Omnibus,GEO)数据库筛选高通量测序数据集,进行功能富集分析并获取核心基因,构建GST-Aβ1-42重组质粒,表达、提取、纯化GST-Aβ1-42融合蛋白,进而探讨GST-Aβ1-42蛋白与CaM的相互作用,以期为AD治疗提供新靶点、新思路。
1 材料与方法 1.1 材料大肠杆菌BL21(DE3)(北京全式金生物公司);pGEX-6p-1/ Aβ1-42(中国Sangon Biotech公司);异丙基硫代-β-D半乳糖苷(isopropyl-beta-D-thiogalactopy-ranoside,IPTG)、氨苄西林、溶菌酶(美国Sigma公司);Protein Molecular Weight Marker(日本TaKaRa公司);限制性内切酶BamHⅠ、NotⅠ(美国Thermo Scientific公司);胰蛋白胨、酵母提取物(中国Biosharp公司)。Bradford蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);SanPrep柱式抽提试剂盒(中国Sangon Biotech公司)。凝胶自动成像仪(DNR Bio-Imaging systems,上海中晶科技有限公司)。
1.2 方法 1.2.1 生物信息学方法筛选核心基因、确定靶蛋白GEO数据库(https://www.ncbi.nlm.nih.gov/)中查询AD数据集,下载GSE173955高通量测序数据集,该数据集包括8例AD患者及10例健康人的样本。用GEO数据库GEO2R工具进行在线分析,筛选出差异表达基因(differentially expressed gene,DEG)。以P < 0.05和∣logFC∣ > 1作为条件进行筛选,对生成的数据进行统计学分析,得到的基因为最终的DEG。使用DAVID数据库(https://david.ncifcrf.gov)对P值由小到大排名的前6 000个DEG进行基因本体(gene ontology,GO)和京都基因和基因组数据库(Kyoto encyclopedia of genes and genomes,KEGG)分析。将P值由小到大排名前200的DEG导入STRING数据库(https://www.string-db.org/)生成蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络图,并使用cytoscape得到各个基因的连接度,将连接度排名前20的基因定义为核心基因。
1.2.2 构建GST-Aβ1-42重组质粒应用42 ℃精确热激法将Aβ1-42质粒转化至大肠杆菌BL21感受态细胞。在含氨苄西林的LB固体琼脂培养板上均匀涂抹菌液,将培养板置于37 ℃培养箱内倒置培养12~16 h。取单克隆菌种接种于含氨苄西林的LB培养液中,震荡培养12~16 h。保留菌种,置于高压灭菌含50 %甘油的EP管中,混匀并保存于-80 ℃冰箱备用。取100 μL菌种加入至含50 μg/mL氨苄西林LB培养液的培养基中,振摇12~16 h。当达到对数生长期,即OD600 nm在0.6~1.0范围内时,加入400 μL IPTG(终浓度为1 mmol/L),振摇4 h,诱导融合蛋白表达。
1.2.3 提取和纯化GST-Aβ1-42融合蛋白离心收集细菌,向菌液中分别加入20 mg/mL溶菌酶和1 mol/L DTT 200 μL,冰上处理30 min。超声破碎细菌,12 000 r/min离心取上清,加入预先用PBS洗好的beads中,过夜孵育。
1.2.4 pull-down实验检测CaM与GST-Aβ1-42蛋白间的相互作用向40 μL连接于GS-4B beads的GST-Aβ1-42融合蛋白中加入3 μL 0.001 mol/L CaCl2([Ca2+]10 μmol/L)和不同浓度的CaM(终浓度分别为0.1、0.3、1.0、3.0、5.0、10.0 μmol/L),在300 μL体系的Tris缓冲液(pH8.0)中,4 ℃孵育4 h,用相应浓度的Ca2+缓冲液清洗2次。用考马斯亮蓝对经15% SDS-PAGE电泳的蛋白凝胶染色,脱色2 h,扫描胶图检测CaM与GST-Aβ1-42蛋白间有无相互作用。
1.3 统计学分析使用ImageJ软件统计SDS-PAGE电泳条带的灰度值,应用GraphPad Prism 8软件绘制柱形图。数据以x±s表示,采用t检验比较组间差异。P < 0.05为差异有统计学意义。
2 结果 2.1 筛选核心基因并确定靶蛋白(图 1)
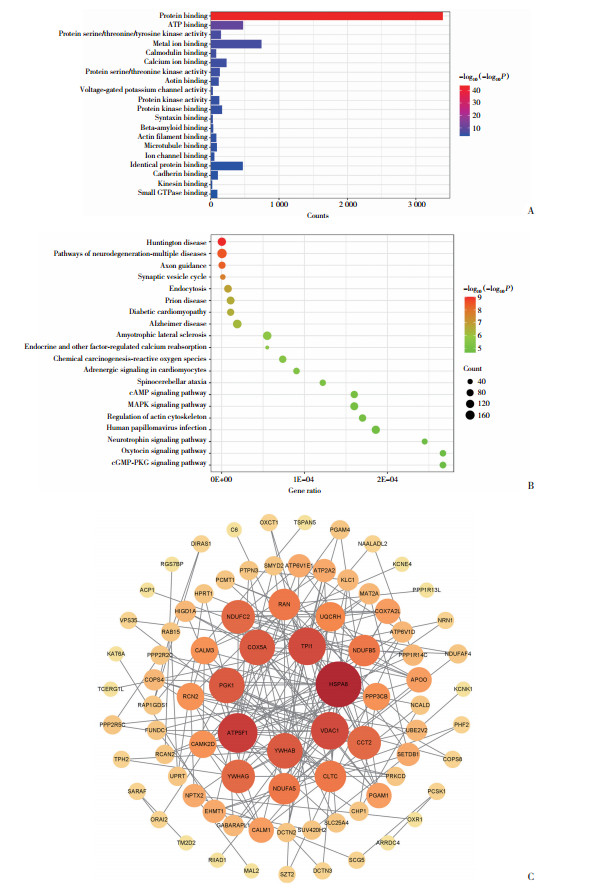
|
| A, the GO enrichment items of DEGs (MF); B, the KEGG pathway enrichment results of DEGs; C, PPI network of DEGs. 图 1 生物信息学筛选AD核心基因 Fig.1 The hub genes expressed in AD obtained by bioinformatics methods |
通过GEO2R获得20 731个DEG,进一步筛选后按P值由小到大排序选前6 000个基因进行GO和KEGG分析。如图 1A所示,GO分析DEG分子功能主要富集在蛋白结合、ATP结合、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性、金属离子结合、钙调蛋白结合、钙离子结合、蛋白质丝氨酸/苏氨酸激酶活性、肌动蛋白结合、电压门控钾通道活性等;如图 1B所示,KEGG分析DEG主要富集在亨廷顿病、多种神经退行性疾病通路、轴突导向、突触囊泡循环、细胞内吞作用、朊病毒病、糖尿病性心肌病、AD、肌萎缩侧索硬化症等。将前200个DEG导入STRING数据库生成PPI网络图,用cytoscape将数据可视化,获取连接度排名前20的核心基因,如图 1C所示,包括HSPA8(连接度=16)、ATP5F1(连接度=13)、VDAC1(连接度=12)、TPI1(连接度=12)、YWHAB(连接度=11)、PGK1(连接度=11)、COX5A(连接度=11)、CCT2(连接度=10)、YWHAG(连接度=10)、NDUFC2(连接度=10)、NDUFA5(连接度=9)、CLTC(连接度=9)、RAN(连接度=9)、NDUFB5(连接度=9)、UQCRH(连接度=8)、CALM3(连接度=7)、RCN2(连接度=7)、CAMK2D(连接度=7)、PPP3CB(连接度=7)、CALM1(连接度=6)。通过分析发现CALM3、CAMK2D、CALM1都参与编码CaM,故将CaM作为靶蛋白进行后续实验验证。
2.2 Aβ1-42重组质粒的酶切鉴定Aβ1-42重组质粒的DNA测序结果如图 2所示,经Pubmed核酸比对软件进行比对分析,重组质粒的碱基与基因库碱基比对,两者同一性为100%,且插入方向正确,读码方向正确,密码子无突变、缺失,测序结果证明本研究重组质粒构建成功。重组质粒经BamHⅠ/NotⅠ双酶切后,如图 3所示,Aβ1-42基因片段分子量大小与理论值符合,进一步说明重组质粒构建成功。
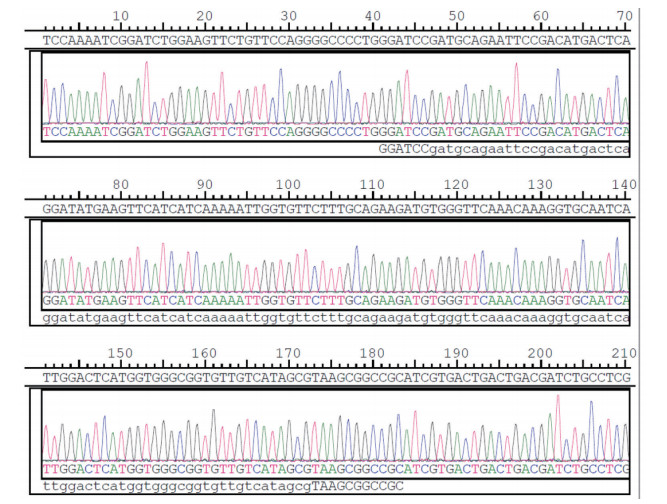
|
| 图 2 Aβ1-42重组质粒测序结果图 Fig.2 Verification of Aβ1-42 recombinant plasmid by DNA sequencing |
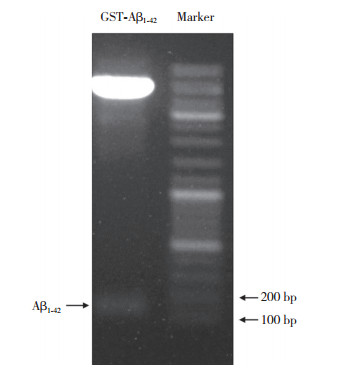
|
| 图 3 重组Aβ1-42质粒酶切鉴定琼脂糖凝胶电泳图 Fig.3 Validation of Aβ1-42 recombinant plasmid construction by agarose gel electrophoresis of restriction enzyme digests |
2.3 GST-Aβ与CaM的结合作用
在2 mmol/L Ca2+条件下,共同孵育不同浓度CaM蛋白(0.1,0.3,1.0,3.0,5.0,10.0 µmol/L)和纯化后的GST-Aβ1-42融合蛋白,pull-down实验结果如图 4所示,CaM蛋白能与GST- Aβ1-42蛋白结合,且具有浓度依赖性。
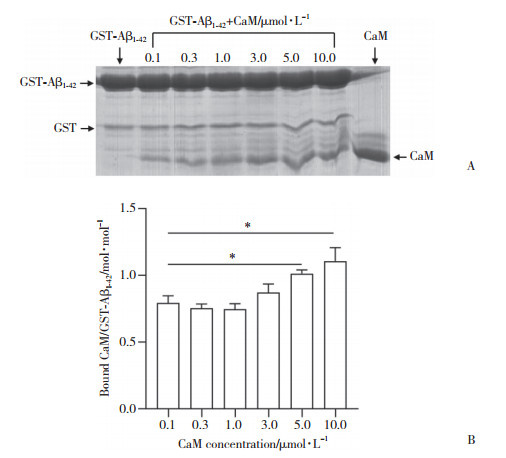
|
| A, concentration-dependent binding of GST-Aβ1-42 to CaM; B, statistical analysis of CaM binding to GST-Aβ1-42. *P < 0.01. 图 4 GST-Aβ1-42与CaM的pull-down实验分析结果 Fig.4 Pull down assay to assess binding of GST- Aβ1-42 to CaM |
3 讨论
随着全球人口老龄化,AD给社会和家庭带来的问题愈加严重。目前,仍然缺乏治疗AD的特效药物。钙调蛋白假说作为钙假说的延伸,表明了钙调蛋白参与Aβ蛋白形成与发展的过程。与产生Aβ的相关蛋白均具有特定的钙调蛋白结合域,且能够与CaM结合并受其调节。尽管AD发病机制尚未明确,但一直以来Aβ假说都是解释AD发病机制的一个重要理论基础和研究依据[8]。Aβ斑块和NFT被广泛认为是AD的2个核心特征。有大量证据表明,CaM在Aβ斑块形成的早期发挥重要作用[9-10]。研究发现,CaM的干扰可能能减少Aβ斑块的产生。BACE1不仅与CaM结合,且其活性通过CaM以剂量依赖性方式显著增加。CaM除能与产生Aβ的酶结合外,还能直接与Aβ1-42本身结合[11]。当Aβ1-42与CaM结合时,Aβ不能抑制脑质膜Ca2+-ATPase并阻止Ca2+进入细胞。以上研究结果表明,在淀粉样蛋白斑块形成途径中,Aβ1-42和CaM之间存在明显的联系,Ca2+水平的失衡与Aβ产生相互促进,CaM在这种相互作用中起着非常重要的作用[13]。研究[12-13]证实,CaM/Ca2+与CaMKⅡ结合使其磷酸化才能发挥CaMKⅡ的记忆功能,而AD患者脑内CaM含量明显减少,导致AD患者记忆能力下降。前期研究已证实CaM能够与Aβ相互作用,减缓Aβ纤维原的形成,在此基础上,本研究创新性地证实了在钙超载的条件下CaM与Aβ1-42的结合作用,更进一步地证明了两者的结合呈浓度依赖性,其结合量随着CaM浓度的增加而增加。
虽然近年来AD患者数量不断增加,但其治疗方法并没有显著进展。Aduhelm(阿杜那单抗)是自2003年以来首个获批用于AD的新型疗法,而在此之前仅有几款药物用于缓解AD,包括多奈哌齐、加兰他敏、卡巴拉汀、美金刚,以及多奈哌齐和美金刚的复方制剂[14]。2019年由我国自主研发的创新药甘露特钠胶囊获批上市,用于治疗轻度或中度AD。然而,这些药物都是用于改善或预防AD的发生和发展,并不能精准有效地遏制AD的发展。2023年1月美国食品药品管理局批准仑卡奈单抗(lecanemab)用于治疗AD,它从根本上解决了AD病因——清除淀粉样斑块,进而改善患者早期的认知障碍[15-16]。已有文献[5]报道,CaM与Aβ1-42结合可影响LTP,导致学习和记忆障碍,但目前尚未见以CaM为靶点的AD治疗药物。迄今为止,几乎所有的临床试验都是单一治疗试验,鉴于AD的复杂性,未来联合用药可能成为治疗AD的趋势[14]。
综上所述,本研究发现,GST-Aβ1-42蛋白能够与CaM结合,且具有浓度依赖性,为AD治疗药物潜在作用靶点的研究提供了新思路。
| [1] |
GE MQ, ZHANG JH, CHEN SM, et al. Role of calcium homeostasis in Alzheimer's disease[J]. Neuropsychiatr Dis Treat, 2022, 18: 487-498. DOI:10.2147/ndt.s350939 |
| [2] |
HEFTER D, LUDEWIG S, DRAGUHN A, et al. Amyloid, APP, and electrical activity of the brain[J]. Neuroscientist, 2020, 26(3): 231-251. DOI:10.1177/1073858419882619 |
| [3] |
MONTAGNA E, CRUX S, LUCKNER M, et al. In vivo Ca2+ imaging of astrocytic microdomains reveals a critical role of the amyloid precursor protein for mitochondria[J]. Glia, 2019, 67(5): 985-998. DOI:10.1002/glia.23584 |
| [4] |
FRISONI GB, ALTOMARE D, THAL DR, et al. The probabilistic model of Alzheimer disease: the amyloid hypothesis revised[J]. Nat Rev Neurosci, 2022, 23(1): 53-66. DOI:10.1038/s41583-021-00533-w |
| [5] |
O'DAY DH. Calmodulin and amyloid beta as coregulators of critical events during the onset and progression of Alzheimer's disease[J]. Int J Mol Sci, 2023, 24(2): 1393. DOI:10.3390/ijms24021393 |
| [6] |
VISCONTE C, CANINO J, GUIDETTI GF, et al. Amyloid precursor protein is required for in vitro platelet adhesion to amyloid peptides and potentiation of thrombus formation[J]. Cell Signal, 2018, 52: 95-102. DOI:10.1016/j.cellsig.2018.08.017 |
| [7] |
MCDAID J, MUSTALY-KALIMI S, STUTZMANN GE. Ca2+ dyshomeostasis disrupts neuronal and synaptic function in Alzheimer's disease[J]. Cells, 2020, 9(12): 2655. DOI:10.3390/cells9122655 |
| [8] |
KARRAN E, DE STROOPER B. The amyloid hypothesis in Alzhei-mer disease: new insights from new therapeutics[J]. Nat Rev Drug Discov, 2022, 21(4): 306-318. DOI:10.1038/s41573-022-00391-w |
| [9] |
O'DAY DH. Calmodulin and amyloid beta as coregulators of critical events during the onset and progression of Alzheimer's disease[J]. Int J Mol Sci, 2023, 24(2): 1393. DOI:10.3390/ijms24021393 |
| [10] |
SALAZAR J, POEJO J, MATA AM, et al. Design and experimental evaluation of a peptide antagonist against amyloid β (1-42) interactions with calmodulin and calbindin-D28k[J]. Int J Mol Sci, 2022, 23(4): 2289. DOI:10.3390/ijms23042289 |
| [11] |
FRISONI GB, ALTOMARE D, THAL DR, et al. The probabilistic model of Alzheimer disease: the amyloid hypothesis revised[J]. Nat Rev Neurosci, 2022, 23(1): 53-66. DOI:10.1038/s41583-021-00533-w |
| [12] |
POEJO J, SALAZAR J, MATA AM, et al. The relevance of amyloid β-calmodulin complexation in neurons and brain degeneration in Alzheimer's disease[J]. Int J Mol Sci, 2021, 22(9): 4976. DOI:10.3390/ijms22094976 |
| [13] |
ZALCMAN G, FEDERMAN N, ROMANO A. CaMKII isoforms in learning and memory: localization and function[J]. Front Mol Neurosci, 2018, 11: 445. DOI:10.3389/fnmol.2018.00445 |
| [14] |
CUMMINGS JL, TONG G, BALLARD C. Treatment combinations for Alzheimer's disease: current and future pharmacotherapy options[J]. J Alzheimers Dis, 2019, 67(3): 779-794. DOI:10.3233/jad-180766 |
| [15] |
VAN DYCK CH, SWANSON CJ, AISEN P, et al. Lecanemab in early Alzheimer's disease[J]. N Engl J Med, 2023, 388(1): 9-21. DOI:10.1056/nejmoa2212948 |
| [16] |
MCDADE E, CUMMINGS JL, DHADDA S, et al. Lecanemab in patients with early Alzheimer's disease: detailed results on biomarker, cognitive, and clinical effects from the randomized and open-label extension of the phase 2 proof-of-concept study[J]. Alzheimers Res Ther, 2022, 14(1): 191. DOI:10.1186/s13195-022-01124-2 |
 2024, Vol. 53
2024, Vol. 53




