文章信息
- 王頔, 王蕊, 马铁, 王哲, 吕庆杰
- WANG Di, WANG Rui, MA Tie, WANG Zhe, LÜ Qingjie
- 快速超声组织处理技术在乳腺穿刺组织活检中的应用
- Application of rapid ultrasonic tissue processing technology in breast core needle biopsy
- 中国医科大学学报, 2024, 53(6): 481-486
- Journal of China Medical University, 2024, 53(6): 481-486
-
文章历史
- 收稿日期:2023-10-19
- 网络出版时间:2024-05-31 15:32:49
乳腺肿瘤是女性最常见的疾病之一,早期诊断和治疗对预后至关重要。乳腺新辅助治疗(neoadjuvant therapy,NAT)不仅能缩小原发恶性肿瘤及淋巴结转移灶,让部分患者获得保乳或手术治疗的机会,甚至术前NAT可间接判断患者预后[1-2]。目前临床上常采用术前粗针穿刺活检(core needle biopsy,CNB)获取乳腺组织进行病理诊断。制作病理切片需要经过固定、脱水、包埋、切片等步骤,往往耗时较久,需要分子检测及免疫组织化学(immunohistochemistry,IHC)染色辅助诊断的病例通常周期长达1周左右。为进一步缩短患者就诊及治疗时间,本研究尝试使用快速超声组织处理仪及配套试剂进行乳腺穿刺标本的快速石蜡制片,并与常规组织脱水石蜡制片进行比较,探讨两者在苏木素-伊红(hematoxylin-eosin,HE)染色、IHC染色和荧光原位杂交(fluorescence in situ hybridization,FISH)基因检测等方面的差异及应用价值。
1 材料与方法 1.1 材料 1.1.1 标本来源选取中国医科大学附属盛京医院病理科经CNB获取的乳腺组织标本100例,组织大小为0.1 cm×0.1 cm×1.0 cm,采用快速超声组织处理技术进行组织处理(快速组);同时对相应患者的手术切除乳腺组织采用常规病理组织处理(常规组),组织大小为0.3 cm×0.3 cm×0.3 cm。患者年龄13~80岁,平均54岁。本研究获得我院医学伦理委员会批准(2024PS778K)。
1.1.2 实验仪器及试剂快速超声组织处理仪(HT-3)及配套病理分析前处理试剂(山东骏腾医疗科技有限公司);Thermo全自动组织脱水机(美国赛默飞世尔科技公司);VENTANA HE 600 System自动染片机,ULTRA全自动免疫组织化学仪,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)抗体、孕激素受体(progesterone receptor,PR)抗体、雌激素受体(estrogen receptor,ER)抗体,二抗试剂盒,DAB显色试剂盒(美国Ventana医疗系统公司)。
1.2 方法 1.2.1 标本处理所有标本均经4%中性甲醛固定120 min。常规组:使用全自动组织脱水机进行常规脱水,75%乙醇60 min;85%乙醇60 min;95%乙醇60 min 2次;100%乙醇60 min 2次;二甲苯透明30 min;二甲苯透明60 min 2次;石蜡浸蜡30 min;石蜡浸蜡60 min 2次。快速组:使用新型快速超声组织处理仪及配套病理分析前处理试剂手动处理13 min 2次;石蜡浸蜡20 min。
1.2.2 HE染色及评分常规4 μm切片,应用罗氏HE600全自动染色仪染色封片。参照《临床技术操作规范·病理学分册》 [3]评估HE染色效果。(1)着色强度评分:深染3分,中等染色2分,浅染1分。(2)细胞核、细胞质及细胞膜着色对比度评分:清晰3分,部分清晰2分,不清晰1分。(3)组织切片完整性评分:完整3分,部分完整2分,不完整1分。(4)细胞结构完整评分:完整3分,部分完整2分,不完整1分。4项得分相加为HE染色效果总分,满分12分。
1.2.3 IHC染色及结果判定常规组织3 μm厚度切片后,应用罗氏ULTRA全自动免疫组织化学仪进行染色。ER、PR的IHC染色结果判定参照《乳腺癌雌、孕激素受体免疫组织化学检测指南》标准[4]。(1)检测结果判读:阳性,≥1%肿瘤细胞核呈不同程度着色;阴性,< 1%肿瘤细胞核呈不同程度着色,或完全无着色;无法判读,检测前处理或检测步骤不符合指南规定,或染色定位于细胞质而非细胞核,或对照未出现预期结果,或阴性染色但标本中缺乏内对照组织。(2)阳性肿瘤细胞百分率:无染色为0分,≤1%为1分,> 1%~10%为2分,> 10%~33%为3分,> 33%~66%为4分,> 66%~100%为5分。(3)整张切片中阳性肿瘤细胞的染色强度:染色强度分为无、弱、中及强阳性4个等级,分别评分为0~3分。计算Allred评分=阳性肿瘤细胞百分率评分+肿瘤细胞染色强度评分。0分记为阴性(-),2~4分记为低阳性(+),5~6分记为中阳性(++),7~8分记为高阳性(+++)。HER2检测结果判读标准[5]:-,无染色或≤10%浸润癌细胞呈不完整、微弱的细胞膜染色;+,> 10%浸润癌细胞呈不完整、微弱的细胞膜染色;++,> 10%浸润癌细胞呈不完整和(或)弱~中等强度的细胞膜染色,或≤10%浸润癌细胞呈强而完整的细胞膜染色;+++,> 10%浸润癌细胞呈强而完整的细胞膜染色。
1.2.4 FISH检测选取IHC染色HER2(++)的乳腺组织进行HER2的FISH基因检测,严格按照试剂盒说明书操作。
1.3 统计学分析采用SPSS 26.0统计学软件进行数据处理。计量资料以x±s表示,组间比较采用t检验;计数资料以率(%)表示,组间比较采用χ2检验。2组ER、PR、HER2表达及染色强度的一致性比较,采用配对资料的Kappa检验,计算Kappa值。P < 0.05为差异有统计学意义。
2 结果 2.1 脱水时间比较快速组组织脱水时间[(46.70±1.42)min]低于常规组[(659.25±6.03)min],2组比较差异有统计学意义(t = 987.44,P < 0.001)。
2.2 HE染色评分比较快速组HE染色总评分(10.13±1.12)与常规组(10.15±0.97)比较,差异无统计学意义(P > 0.05);对快速组和常规组的着色强度、着色对比度、切片完整性及结构完整性进行比较,均无统计学差异(P > 0.05),说明常规组和快速组处理方法对HE染色效果没有影响,见图 1、表 1。
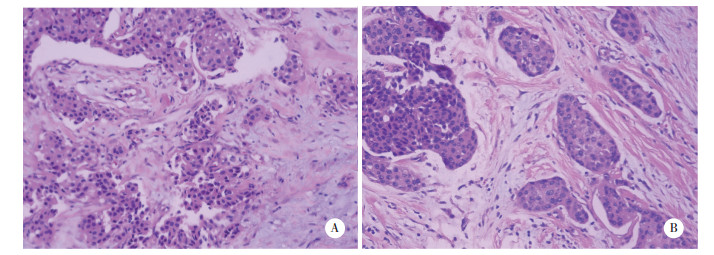
|
| A,the rapid group;B,the conventional group. 图 1 HE染色结果 ×200 Fig.1 HE staining results ×200 |
| Group | Strength | Contrast | Slice integrity | Structural integrity | Total |
| Rapid group(n = 100) | 2.53±0.59 | 2.52±0.50 | 2.54±0.50 | 2.55±0.50 | 10.13±1.12 |
| Conventional group(n = 100) | 2.49±0.54 | 2.62±0.49 | 2.57±0.50 | 2.52±0.50 | 10.15±0.97 |
| t | 0.498 | 1.428 | 0.425 | 0.423 | 0.135 |
| P | 0.619 | 0.155 | 0.671 | 0.672 | 0.892 |
2.3 IHC染色结果比较
100对配对标本中,20例为乳腺腺病及乳腺纤维腺瘤,80例为原位癌及浸润癌。对80例原位癌及浸润癌患者标本进行IHC染色,2组标本均行ER、PR、HER2抗体检测,结果见图 2。快速组和常规组ER阳性表达率为83.75%、85.00%,阳性一致率为92.5%(Kappa=0.794,P < 0.001),见表 2;快速组和常规组PR阳性表达率为86.25%、81.25%,阳性一致率为76.25%(Kappa=0.639,P < 0.001),见表 3;快速组和常规组HER2阳性表达率为71.25%、80.00%,阳性一致率为72.5%(Kappa=0.610,P < 0.001),见表 4。
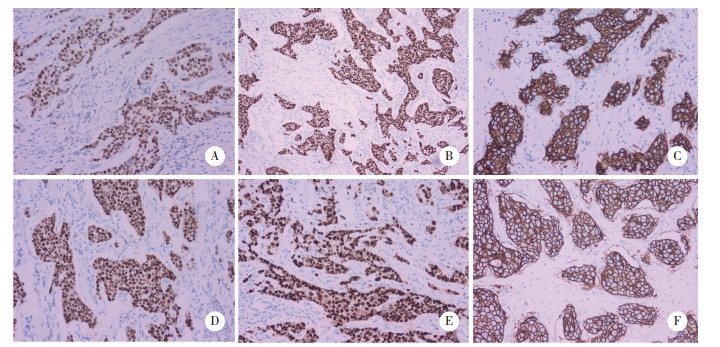
|
| A, ER staining of conventional group (90% strong positive); B, PR staining of conventional group (90% strong positive); C, HER2 staining of conventional group (+++); D, ER staining of rapid group (90% strong positive); E, PR staining of rapid group (90% strong positive); F, HER2 staining of rapid group (+++). 图 2 常规组与快速组免疫组织化学结果 ×200 Fig.2 Immunohistochemistry results of conventional groups and rapid groups ×200 |
| Expression of ER staining in the rapid group | Expression of ER staining in the conventional group | ||||
| - | + | ++ | +++ | Total | |
| - | 12 | 0 | 1 | 0 | 13 |
| + | 0 | 2 | 0 | 3 | 5 |
| ++ | 0 | 0 | 0 | 1 | 1 |
| +++ | 0 | 0 | 1 | 60 | 61 |
| Total | 12 | 2 | 2 | 64 | 80 |
| Kappa=0.794,P<0.001. | |||||
| Expression of PR staining in the rapid group | Expression of PR staining in the conventional group | ||||
| - | + | ++ | +++ | Total | |
| - | 9 | 1 | 1 | 0 | 11 |
| + | 5 | 10 | 1 | 1 | 17 |
| ++ | 1 | 2 | 5 | 5 | 13 |
| +++ | 0 | 1 | 1 | 37 | 39 |
| Total | 15 | 14 | 8 | 43 | 80 |
| Kappa=0.639,P<0.001. | |||||
| Expression of HER2 staining in the rapid group | Expression of HER2 staining in the conventional group | ||||
| - | + | ++ | +++ | Total | |
| - | 13 | 6 | 4 | 0 | 23 |
| + | 2 | 15 | 6 | 0 | 23 |
| ++ | 1 | 2 | 24 | 1 | 28 |
| +++ | 0 | 0 | 0 | 6 | 6 |
| Total | 16 | 23 | 34 | 7 | 80 |
| Kappa=0.610,P<0.001. | |||||
2.4 FISH检测结果
对快速组和常规组组织行HER2基因FISH检测,快速组和常规组信号强度、判读结果一致(Kappa=1.000,P < 0.001),见图 3。
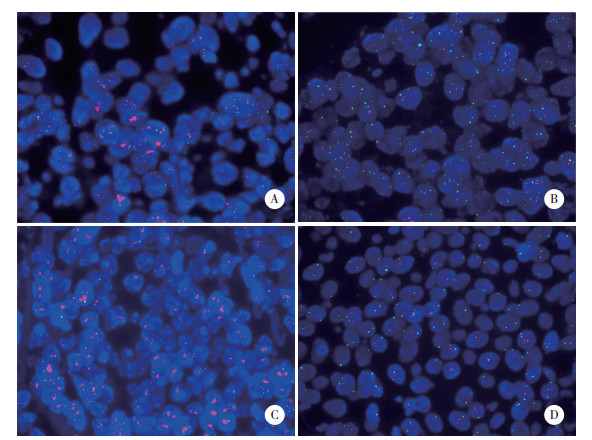
|
| A, HER2 amplification in the rapid group; B, unamplified HER2 in the rapid group; C, HER2 amplification in the conventional group; D, unamplified HER2 in the conventional group. 图 3 HER2基因FISH检测结果 ×1 000 Fig.3 FISH test results of HER2 gene ×1 000 |
3 讨论
乳腺癌的个体精准化治疗模式日渐兴起,以乳腺癌分子分型作为新辅助治疗方案制定和选择的依据,不仅可降期缩瘤、提高保乳率、获取药敏信息、指导后续强化辅助治疗,还可改善患者预后,因此,早期系统治疗成为乳腺癌治愈的关键[6]。乳腺穿刺组织的常规脱水处理耗时较长,通常需要2~3个工作日才能完成报告,若进行IHC或基因检测则耗时更久。快速超声组织处理仪通过专用的病理分析前处理试剂和高频超声共振技术,同时进行水浴加热,以达到加快组织处理的目的。病理分析前处理试剂集脱水、透明于一体,高频的超声波能使组织内分子剧烈运动,加速标本释放剂与标本之间的反应,迅速置换组织里的水份,同时使蛋白质迅速发生凝固,并保持细胞原组织结构,从而使待检组织快速、同步地一次完成固定、脱水、透明等过程[7]。在整个组织处理过程中无需使用甲醛、二甲苯等有害液体,可保证工作环境洁净无污染。
本研究选取乳腺穿刺患者标本及其乳腺切除手术标本作为研究对象,除脱水过程不同外,其余处理条件均相同,排除了组织间异质性对研究的影响。在HE染色中,快速组和常规组乳腺组织皆完整,结构清晰,厚薄均匀,2组染色质量无明显差异。IHC染色结果显示,ER、PR、HER2在组织中表达良好,定位准确,ER、PR主要定位于细胞核,HER2则定位于细胞膜,背景清晰;对所有标本在玻片上同时设置了阳性及阴性对照,并对穿刺活检标本和手术标本结果不一致的标本进行染色复核,复染结果和初次染色无差异。本研究对100例标本中的80例原位癌及浸润性乳腺癌标本进行IHC染色,ER表达不一致6例,PR表达不一致19例,ER较PR一致率更高,MUNCH-PETERSEN等[8]及JEONG等[9]的研究结果显示,PR一致率低于ER,与本研究结果相似,这可能与肿瘤内部PR分布不一致有关。HER2表达不一致22例,其中1例为穿刺标本表达而手术标本不表达,其余20例为HER2表达程度不同,穿刺标本较局限可能不能准确反映全部肿瘤组织的真实情况,且乳腺癌是组织高度异质性肿瘤,肿物多灶性导致了同一病例不同区域存在表达差异性,在原发性HER2阴性肿瘤患者中,ER和PR阳性、HER2阴性的HER2不一致率要高于三阴性乳腺癌[10-11]。PR和HER2表达不一致率高于ER,推测其原因除肿瘤异质性外,还可能与不同病理医师选择镜下计数区域不同有关,即使选择同一区域不同病理医生的判定结果也会存在差异[12]。本研究还选取HER2(++)的组织进行了FISH基因检测,荧光显微镜下可见细胞无明显收缩,信号强度和判读结果无明显差异。
日常工作中发现,甲醛固定时间较短的组织直接进行快速组织处理较甲醛固定时间充裕的组织更易发生HE染色不均或不着色、IHC阳性定位不准确或减弱,冷缺血时间会引起抗原弥散或者抗原活性下降,以上因素也影响病理检测的准确性[13-14],这种非特异性的染色现象与组织处理无关。快速组织处理标本通常为穿刺组织等小标本,固定穿透速度较快,将固定时间控制在合适的范围内可提高组织的染色效果,提供准确的检测结果,对临床医生的指导用药有意义。
综上所述,CNB具有创伤小、检查精确度高的优势,是目前临床上首选的诊断方式。快速组织处理系统不影响HE、IHC及基因检测结果,还能缩短组织脱水时间,具有快速、环保等优点,为乳腺穿刺组织检查在乳腺癌的诊断和个体化治疗中提供帮助,值得在各实验室中推广应用。
| [1] |
中国临床肿瘤学会乳腺癌专家委员会, 中国抗癌协会乳腺癌专业委员会中华医学会外科学分会乳腺外科学组, 等. 中国年轻乳腺癌诊疗专家共识(2022)[J]. 中华医学杂志, 2023, 103(6): 387-403. DOI:10.3760/cma.j.cn112137-20220907-01895 |
| [2] |
唐小燕, 郎荣刚, 付丽. 乳腺癌新辅助化疗效果的病理评估[J]. 中华乳腺病杂志(电子版), 2018, 12(5): 257-262. DOI:10.3877/cma.j.issn.1674-0807.2018.05.001 |
| [3] |
中华医学会. 临床技术操作规范-病理学分册[M]. 北京: 人民军医出版社, 2004.
|
| [4] |
杨文涛, 步宏. 乳腺癌雌、孕激素受体免疫组织化学检测指南[J]. 中华病理学杂志, 2015, 44(4): 237-239. DOI:10.3760/cma.j.issn.0529-5807.2015.04.005 |
| [5] |
《乳腺癌HER检测指南(版) 》编写组. 乳腺癌HER2检测指南(2019版)[J]. 中华病理学杂志, 2019, 48(3): 169-175. DOI:10.3760/cma.j.issn.0529-5807.2019.03.001 |
| [6] |
陈伟玲, 张国君. 乳腺癌新辅助治疗中外指南对比解读[J]. 中国肿瘤外科杂志, 2023, 15(3): 219-224. DOI:10.3969/j.issn.1674-4136.2023.03.003 |
| [7] |
马健波, 李岚, 张睿, 等. 新型超声组织处理仪在子宫颈锥切组织中的应用[J]. 临床与实验病理学杂志, 2018, 34(2): 226-228. DOI:10.13315/j.cnki.cjcep.2018.02.027 |
| [8] |
MUNCH-PETERSEN HD, RASMUSSEN BB, BALSLEV E. Reliability of histological malignancy grade, ER and HER2 status on core needle biopsy vs surgical specimen in breast cancer[J]. APMIS, 2014, 122(9): 750-754. DOI:10.1111/apm.12213 |
| [9] |
JEONG YS, KANG J, LEE J, et al. Analysis of the molecular subtypes of preoperative core needle biopsy and surgical specimens in invasive breast cancer[J]. J Pathol Transl Med, 2020, 54(1): 87-94. DOI:10.4132/jptm.2019.10.14 |
| [10] |
MARCHIÒ C, ANNARATONE L, MARQUES A, et al. Evolving concepts in HER2 evaluation in breast cancer: heterogeneity, HER2-low carcinomas and beyond[J]. Semin Cancer Biol, 2021, 72: 123-135. DOI:10.1016/j.semcancer.202002.016 |
| [11] |
MIGLIETTA F, GRIGUOLO G, BOTTOSSO M, et al. Evolution of HER2-low expression from primary to recurrent breast cancer[J]. NPJ Breast Cancer, 2021, 7(1): 137. DOI:10.1038/s41523-021-00343-4 |
| [12] |
商久妍, 贾珂琪, 郭启涛, 等. 乳腺癌HER2表达异质性的研究进展及临床意义[J]. 临床与实验病理学杂志, 2023, 39(3): 339-342. DOI:10.13315/j.cnki.cjcep.2023.03.017 |
| [13] |
简文静, 王先明, 宋淑芬, 等. 乳腺癌空芯针穿刺标本与手术标本的免疫组织化学检测一致性分析[J]. 中华乳腺病杂志(电子版), 2019, 13(2): 93-97. DOI:10.3877/cma.j.issn.1674-0807.2019.02.006 |
| [14] |
何蕾蕾, 赵弓枭, 马宁, 等. 不同固定时间对乳腺浸润性癌非特殊型组织ER、PR免疫组化染色的影响[J]. 临床医学研究与实践, 2020, 5(21): 27-29. DOI:10.19347/j.cnki.2096-1413.202021010 |
 2024, Vol. 53
2024, Vol. 53




