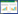文章信息
- 刘俪婷, 熊智倩, 姜燕, 苏朝江, 张帅, 刘宗旸
- LIU Liting, XIONG Zhiqian, JIANG Yan, SU Chaojiang, ZHANG Shuai, LIU Zongyang
- 丹参酮ⅡA对血管紧张素Ⅱ诱导的血管平滑肌细胞增殖及迁移的影响
- Effect of tanshinone ⅡA on angiotensin Ⅱ-induced proliferation and migration of vascular smooth muscle cells
- 中国医科大学学报, 2024, 53(5): 439-445
- Journal of China Medical University, 2024, 53(5): 439-445
-
文章历史
- 收稿日期:2023-06-13
- 网络出版时间:2024-05-14 15:27:28
2. 贵州医科大学附属肿瘤医院肾内科, 贵阳 550003;
3. 贵州医科大学附属肿瘤医院实验室, 贵阳 550003
2. Departmengt of Nephrology, Cancer Hospital Affiliated to Guizhou Medical University, Guiyang 550003, China;
3. Laboratory of Cancer Hospital Affiliated to Guizhou Medical University, Guiyang 550003, China
血管内膜增生是造成许多血管增生性疾病的主要原因之一,而血管平滑肌细胞(vascular smooth muscle cell,VSMC)增殖与迁移已被证实在血管内膜增生中扮演重要角色[1]。VSMC的增殖与迁移与细胞因子及血管活性物质的刺激、VSMC的表型转化以及细胞内自噬水平等息息相关。VSMC由收缩表型向合成表型转化是VSMC发生增殖与迁移的重要环节,血管活性物质血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)能促进VSMC的表型转化以及自噬,而自噬水平的改变被认为可能是VSMC发生表型转化的重要机制。因此,通过调控自噬水平阻断AngⅡ诱导的VSMC表型转化可能成为预防血管内膜增生的治疗靶点,但目前针对血管内膜增生的临床药理学干预效果仍不理想。丹参酮ⅡA(tanshinoneⅡA,TanⅡA)是丹参的主要有效成分,具有抑制血管过度增殖及诱导细胞凋亡、抗血小板凝集、保护血管内皮细胞、抗氧化等作用[2-4],广泛应用于心脑血管疾病的治疗。本研究采用AngⅡ诱导VSMC增殖及迁移,建立细胞模型,采用CCK-8法、细胞划痕试验和Western blotting法观察TanⅡA在AngⅡ诱导VSMC增殖及迁移中的作用,并观察加入自噬抑制剂3-MA后,AngⅡ诱导的VSMC增殖及迁移是否发生变化,从而探讨TanⅡA抗血管内膜增生的可能机制。
1 材料与方法 1.1 材料 1.1.1 细胞小鼠主动脉平滑肌细胞购自American Type Culture Colection细胞库。
1.1.2 药品与试剂丹参酮ⅡA和二甲基亚砜(Dimethylsulfoxide,DMSO)购自美国Sigma公司;血管紧张素Ⅱ购自北京索莱宝公司;3-甲基腺嘌呤购自中国TOCRIS公司;胎牛血清、胰酶、DMEM高糖培养液和青-链霉素购自美国Gibco公司;Cell counting kit 8试剂盒购自日本同仁化学研究所;α-平滑肌动蛋白(α-smooth muscle actin,α-SMA)抗体购自美国NOVUS公司;骨桥蛋白(osteopontin,OPN)抗体购自美国R & D Systems公司;β-actin抗体、p62抗体和LC3A/B抗体购自美国Affinity公司;Beclin-1抗体购自中国Abmart公司;山羊抗兔IgG和山羊抗小鼠IgG购自美国EARTHOX抗体公司。
1.2 方法 1.2.1 细胞培养小鼠主动脉VSMC呈梭形,贴壁生长,用含10%胎牛血清的DMEM高糖培养液培养于5%CO2、37 ℃的细胞培养箱中,每3 d换液1次。
1.2.2 细胞分组为探索AngⅡ建立细胞增殖模型的最适浓度和时间,先分为正常对照(NC)组,10-7 mol/L AngⅡ组,10-6 mol/L AngⅡ组和10-5 mol/L AngⅡ组。AngⅡ建立细胞增殖模型后分为TanⅡA干预组和3-MA处理+TanⅡA干预组。其中TanⅡA干预组分为正常对照(NC)组、AngⅡ(10-6 mol/L)组、TanⅡA(4 μg/mL)组、TanⅡA(8 μg/mL)组、TanⅡA(12 μg/mL)组、TanⅡA(16 μg/mL)组,3-MA处理+TanⅡA干预组分为正常对照(NC)组、AngⅡ组(10-6 mol/L)、TanⅡA(8 μg/mL)组、3-MA(5 mmol/L)组。
1.2.3 CCK-8检测 1.2.3.1 AngⅡ建立细胞增殖模型的最适浓度和时间将对数生长期的VSMC种入96孔板中,于培养箱中过夜培养,在细胞贴壁后取出培养基,根据AngⅡ分组,除NC组外,其余实验组依次加入不同浓度(10-7 mol/L、10-6 mol/L、10-5 mol/L)AngⅡ,每组设5个复孔,置于细胞培养箱培养24和48 h后,弃培养液,于避光条件下向每个复孔加入100 μL DMEM培养基和CCK-8液的混合液(配置比10∶1),培养1 h后终止,在酶标仪450 nm波长下读取各孔的吸光度数值。
1.2.3.2 TanⅡA对VSMC增殖的抑制作用将对数生长期的VSMC接种至96孔板,于培养箱中培养过夜,在细胞贴壁后取出培养基,用AngⅡ(10-6 mol/L)处理细胞48 h后,除NC组、AngⅡ组外,其余实验组依次加入4、8、12、16 μg/mL TanⅡA,每组包括5个复孔,置于细胞培养箱培养24和48 h后,弃培养液,于避光条件下向每个复孔加入100 μL DMEM培养基和CCK-8液的混合液(配置比10∶1),培养1 h后终止,在酶标仪450 nm波长下读取各孔的吸光度数值。
1.2.3.3 3-MA对VSMC增殖的抑制作用将对数生长期的VSMC接种至96孔板中,置于培养箱中过夜,细胞贴壁后吸出培养基,用AngⅡ(10-6 mol/L)处理细胞48 h后,除对照组、AngⅡ组外,其余实验组依次加入TanⅡA(8 μg/mL)、3-MA(5 mmol/L)。每组包括5个复孔,置细胞培养箱培养24 h,于避光条件下向每个复孔加入100 μL DMEM培养基和CCK-8液的混合液(配制比10∶1),加液环节避免引入气泡,培养1 h后终止,在酶标仪上测定每孔450 nm处吸光度值。
1.2.4 划痕试验将VSMC接种于6孔板中,培养至80%密度,吸出培养基,AngⅡ(10-6 mol/L)处理细胞48 h后,用200 μL移液管尖在平板上划出一道笔直划痕,按照实验分组(TanⅡA干预组、3-MA处理+TanⅡA干预组)分别处理细胞24 h。24 h后用倒置显微镜拍摄,采用ImageJ1.53a版图像处理软件并根据恢复面积百分比分析细胞迁移程度。
1.2.5 Western blottingAngⅡ(10-6 mol/L)处理细胞48 h并按照实验分组(TanⅡA干预组、3-MA处理+TanⅡA干预组)分别处理细胞24 h后,使用RIPA蛋白裂解液提取细胞总蛋白,BCA试剂盒检测配平蛋白浓度。取等量蛋白样品进行SDS-PAGE凝胶电泳,转膜,室温摇床封闭1 h,分别加入鼠抗α-SMA抗体(1∶2 000)、鼠抗OPN抗体(1∶2 000)、鼠抗Beclin-1抗体(1∶1 000)、兔抗p62抗体(1∶1 000)、兔抗LC3A/B抗体(1∶1 000)4 ℃孵育过夜,洗涤后再加入相应的二抗(1∶10 000)室温孵育1h,采用全自动化学发光成像分析系统行化学发光法检测,以β-actin蛋白表达为内参,结果以靶蛋白/内参的灰度比值表示。
1.3 统计学分析采用GraphPadPrism9.0软件进行统计分析,2组比较采用t检验,多组间比较采用单因素方差分析,数据以x±s表示,P < 0.05为差异有统计学意义。
2 结果 2.1 AngⅡ诱导VSMC的增殖采用CCK-8法比较不同浓度AngⅡ、不同时间VSMC的增殖情况。结果发现AngⅡ处理48 h可明显增加VSMC的增殖率,但10-5 mol/L AngⅡ作用细胞后的增殖率比中、低浓度低,考虑10-5 mol/L AngⅡ对VSMC可能有毒性作用,而AngⅡ浓度为10-6 mol/L时,细胞增殖率达到峰值,因此后续选用10-6 mol/L AngⅡ作用VSMC 48 h建立细胞增殖模型。见图 1。
|
| 1, NC group; 2, AngⅡ10-7 mol/L group; 3, AngⅡ10-6 mol/L group; 4, AngⅡ10-5 mol/L group. *P < 0.05 vs. NC group. 图 1 不同浓度AngⅡ在不同时间对VSMC增殖的影响 Fig.1 Effects of different concentrations of Ang Ⅱ on VSMC proliferation at different times |
2.2 TanⅡA抑制AngⅡ诱导的VSMC增殖
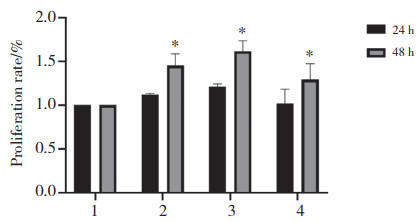
应用CCK-8法对比各浓度条件下TanⅡA处理AngⅡ刺激的细胞增殖状况,与单独使用AngⅡ干预组比较,细胞经不同浓度的TanⅡA处理24 h、48 h后均能够降低由AngⅡ诱导的细胞增殖,且与TanⅡA的浓度呈负相关。见图 2。在4、8、12 μg/mL浓度时,TanⅡA处理细胞24 h时增殖率下降更明显,因此选用不同浓度的TanⅡA(4、8、12、16 μg/mL)作用细胞24 h进行后续实验。
|
| 1, NC group; 2, AngⅡgroup; 3, AngⅡ10-6 mol/L+TanⅡA 4 μg/mL group; 4, AngⅡ10-6 mol/L+TanⅡA 8 μg/mL group; 5, AngⅡ10-6 mol/L+TanⅡA 12 μg/mL group; 6, AngⅡ10-6 mol/L+TanⅡA 16 μg/mL group. *P < 0.05 vs. NC group; #P < 0.05 vs. AngⅡgroup. 图 2 不同浓度TanⅡA对AngⅡ诱导的VSMC增殖的影响 Fig.2 Effect of different concentrations of TanⅡA on AngⅡ-induced VSMC proliferation |
2.3 TanⅡA抑制AngⅡ诱导的VSMC迁移
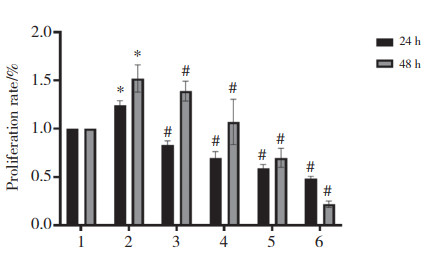
划痕实验结果显示,AngⅡ组VSMC的迁移率(78.75%)能力较正常对照组(45.27%)明显升高,给予各浓度TanⅡA干预后,与AngⅡ组相比,随着TanⅡA浓度升高(4、8、12、16 μg/mL),细胞迁移率(48.05%、40.53%、24.46%、5.57%)逐渐下降。见图 3。
|
| A, VSMC (×50);B, migration rate.*P < 0.05 vs. NC group; #P < 0.05 vs. AngⅡgroup. 1, NC group; 2, AngⅡgroup; 3, AngⅡ10-6 mol/L+TanⅡA 4 μg/mL group; 4, AngⅡ10-6 mol/L+TanⅡA 8 μg/mL group; 5, AngⅡ10-6 mol/L+TanⅡA 12 μg/mL group; 6, AngⅡ10-6 mol/L+TanⅡA 16 μg/mL group. 图 3 不同浓度TanⅡA对AngⅡ诱导的VSMC迁移的影响 Fig.3 Effect of different concentrations of Tan ⅡA on Ang Ⅱ-stimulated VSMC migration |
2.4 TanⅡA对AngⅡ诱导VSMC表型转化的影响
Western blotting结果(图 4)显示,与对照组比较,AngⅡ组VSMC收缩表型蛋白α-SMA表达明显降低,合成表型蛋白OPN表达显著增加。经TanⅡA处理后,与AngⅡ组相比,α-SMA表达上调,OPN表达下调,且随着TanⅡA浓度升高,α-SMA表达水平逐渐增加,OPN表达水平逐渐下降。
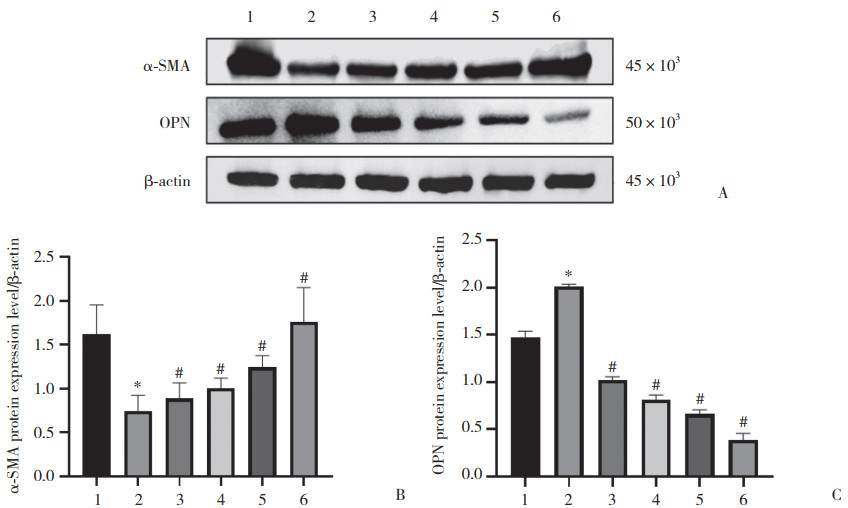
|
| A, α-SMA and OPN protein expression; B, protein expression of α-SMA; C, protein expression of OPN. 1, NC group; 2, AngⅡgroup; 3, AngⅡ10-6 mol/L+TanⅡA 4 μg/mL group; 4, AngⅡ10-6 mol/L+TanⅡA 8 μg/mL group; 5, AngⅡ10-6 mol/L+TanⅡA 12 μg/mL group; 6, AngⅡ10-6 mol/L+TanⅡA 16 μg/mL group. *P < 0.05 vs. NC group; #P < 0.05 vs. AngⅡgroup. 图 4 TanⅡA对AngⅡ诱导VSMC表型转化的影响 Fig.4 Effect of Tan ⅡA on Ang Ⅱ-induced VSMC phenotypic transformation |
2.5 TanⅡA对AngⅡ诱导VSMC的自噬影响
Western blotting检测自噬标志物p62、Beclin-1、LC3A/B。结果显示,与对照组比较,AngⅡ组p62、Beclin-1、LC3A/B的表达水平显著增加。与AngⅡ组相比,TanⅡA可下调p62、Beclin-1、LC3A/B的表达,并且随着TanⅡA浓度升高,p62、Beclin-1、LC3A/B的表达水平逐渐下降。见图 5。
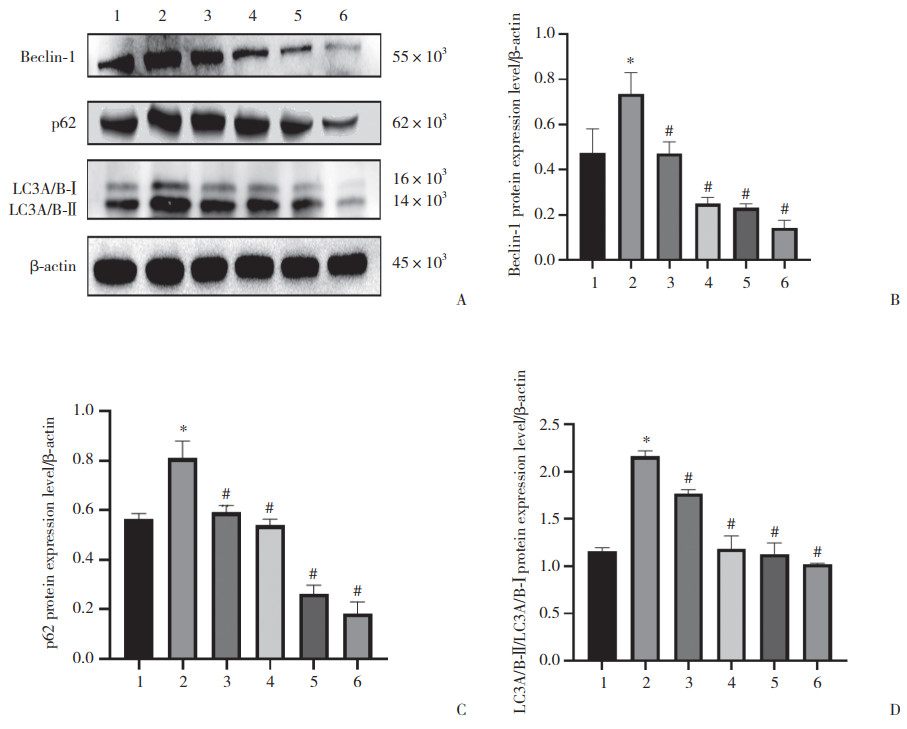
|
| A, p62, Beclin-1, and LC3A/B protein expression; B, protein expression of Beclin-1;C, protein expression of p62;D, protein expression of LC3A/B. 1, NC group; 2, AngⅡgroup; 3, AngⅡ10-6 mol/L+TanⅡA 4 μg/mL group; 4, AngⅡ10-6 mol/L+TanⅡA 8 μg/mL group; 5, AngⅡ10-6 mol/L+TanⅡA 12 μg/mL group; 6, AngⅡ10-6 mol/L+TanⅡA 16 μg/mL group. *P < 0.05 vs. NC group; #P < 0.05 vs. AngⅡgroup. 图 5 TanⅡA对AngⅡ诱导VSMC自噬的影响 Fig.5 Effect of TanⅡA on autophagy induced by AngⅡ in VSMC |
2.6 自噬抑制剂3-MA抑制AngⅡ诱导的VSMC增殖、迁移和表型转化
在使用TanⅡA干预细胞前使用3-MA预处理细胞2 h(TanⅡA浓度根据前期CCK-8实验选择中位浓度8 μg/mL)。CCK-8检测结果显示,AngⅡ组、TanⅡA组、3-MA组增殖率分别为1.19±0.02、0.70±0.08、0.94±0.12,与AngⅡ组比较,TanⅡA组、3-MA组均明显抑制VSMC的增殖。细胞划痕实验结果显示,AngⅡ组、TanⅡA组、3-MA组迁移率分别为0.79±0.01、0.37±0.02、0.21±0.08,与AngⅡ组比较,TanⅡA组、3-MA组均明显抑制VSMC的迁移。
Western blotting检测结果显示,与AngⅡ组比较,TanⅡA组和3-MA组α-SMA蛋白的表达升高,OPN的表达降低。再通过Western blotting检测自噬标志物p62、Beclin-1、LC3A/B,与AngⅡ组比较,TanⅡA组、3-MA组和3-MA+TanⅡA组Beclin-1、LC3A/B的表达均明显降低。见图 6。
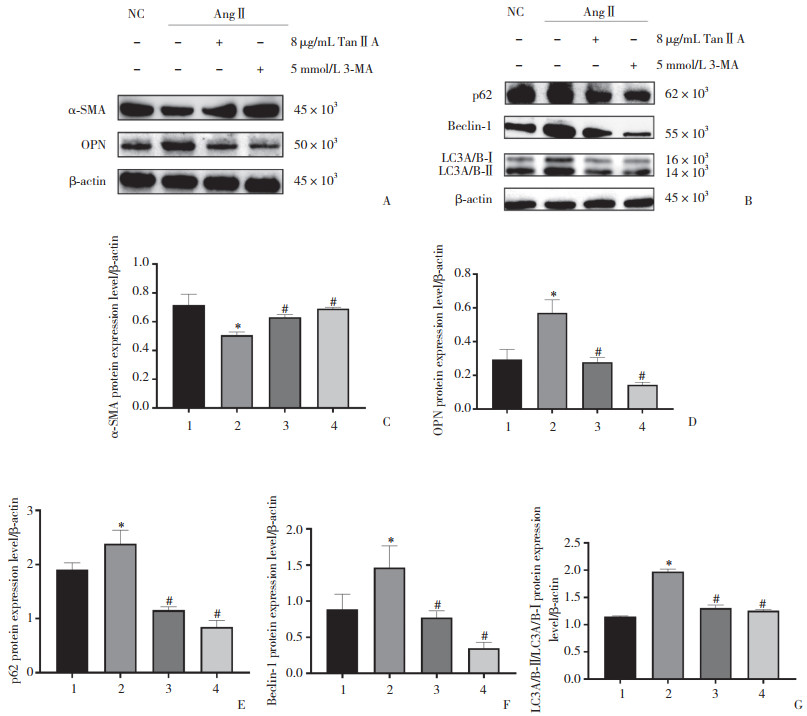
|
| A, α-SMA and OPN protein expression; B, p62, Beclin-1, and LC3A/B protein expression; C, protein expression of α-SMA; D, protein expression of OPN; E, protein expression of p62;F, protein expression of Beclin-1;G, protein expression of LC3A/B. 1, NC group; 2, AngⅡgroup; 3, AngⅡ10-6 mol/L+ TanⅡA 8 μg/mL group; 4, AngⅡ10-6 mol/L+3-MA 5 mmol/L group. *P < 0.05 vs. NC group; #P < 0.05 vs. AngⅡgroup. 图 6 TanⅡA通过下调自噬抑制AngⅡ诱导的VSMC的表型转化 Fig.6 Tan ⅡA inhibits phenotypic transformation of Ang Ⅱ-treated VSMC by downregulating autophagy |
3 讨论
VSMC的增殖及迁移在血管内膜增生的发生发展中起重要作用[5]。VSMC具有可塑性,可以在收缩表型和合成表型之间转化。正常生理状态下,VSMC处于静止的收缩表型,当受到生长因子、细胞因子、炎症反应、血管活性物质等因素刺激时,VSMC从静止的收缩表型转变为合成表型,引发VSMC的增殖及迁移,称为表型转化,VSMC的增殖及迁移与VSMC的表型转化密切相关[6-7]。AngⅡ作为肾素-血管紧张素-醛固酮系统中的重要效应分子,被证实可诱导VSMC的表型转化[8-9]。本研究使用AngⅡ刺激VSMC后,细胞增殖能力明显增强,划痕实验提示细胞迁移能力明显增强,Western blotting检测结果显示,VSMC收缩表型标志物α-SMA的表达逐渐减少,而合成表型标志物OPN蛋白的表达逐渐增加。应用TanⅡA干预AngⅡ诱导后的VSMC,随着TanⅡA浓度的增加,VSMC的增殖及迁移能力逐渐下降,同时,抑制VSMC从收缩表型转化为合成表型。
自噬可以抑制VSMC异常增殖,维持血管的正常功能,但当自噬被过度激活,会破坏胞质溶胶及细胞器,加重内皮细胞的损伤,从而引起VSMC异常增殖;当自噬水平不足,自噬缺陷会触发抗氧化反应,加速VSMC的增殖及迁移。有研究[10]报道,在VSMC发生表型转化的过程中通常可以观察到细胞内自噬水平的改变,这表明自噬可能是VSMC发生表型转化的重要促进因子。Beclin-1、LC3A/B是2种重要的自噬相关蛋白,与自噬水平的改变呈正相关[11]。p62是重要的自噬受体,其表达水平增高与自噬降解通路受损有关[12]。本研究通过Western blotting检测自噬标志物,结果显示,AngⅡ可使Beclin-1、LC3A/B的蛋白表达水平升高,这表明AngⅡ诱导细胞自噬增加,当加入TanⅡA干预细胞后,AngⅡ诱导的Beclin-1、LC3A/B蛋白水平降低,提示TanⅡA可抑制AngⅡ诱导的VSMC自噬。本研究还发现AngⅡ使p62的蛋白表达水平升高,然而在加入TanⅡA干预后,同样也可逆转AngⅡ诱导的p62蛋白表达水平,这可能是由于p62除了是自噬接头蛋白之外,还是一种应激蛋白,在应激条件下(高浓度的AngⅡ环境下等)其表达水平会大幅度上升[13],并且自噬流出现波动时p62的变化具有一定的滞后性。应用3-MA抑制AngⅡ所诱导的自噬后,细胞的增殖及迁移能力下降,说明抑制自噬可抑制AngⅡ诱导的VSMC增殖及迁移。Western blotting检测结果显示,收缩表型标志蛋白α-SMA的含量显著提升,同时合成表型标志蛋白OPN含量下降明显,提示自噬可能参与了VSMC表型转化的过程,且通过抑制自噬可以抑制AngⅡ诱导的VSMC发生表型转化。Western blotting检测还发现,3-MA处理后Beclin-1、LC3A/B表达水平均较AngⅡ干预组明显下降,由此可看出TanⅡA对AngⅡ诱导VSMC发生增殖及迁移的抑制作用与3-MA一致。
综上所述,TanⅡA可抑制AngⅡ诱导的VSMC的增殖、迁移以及表型转化,机制上可能与其下调自噬有关,TanⅡA对血管内膜增生可能具有预防作用。但本研究目前仅局限于细胞实验,后续还应结合动物实验及人体静脉组织等开展更全面的研究。
| [1] |
STOLIC R. Most important chronic complications of arteriovenous fistulas for hemodialysis[J]. Med Princ Pract, 2013, 22(3): 220-228. DOI:10.1159/000343669 |
| [2] |
曹慧敏, 吴瑾, 贾连群, 等. 丹参酮ⅡA对心血管系统药理作用的研究进展[J]. 世界中医药, 2017, 12(7): 1718-1722. DOI:10.3969/j.issn.1673-7202.2017.07.059 |
| [3] |
WEN L, CHENG X, FAN QG, et al. TanshinoneⅡA inhibits excessive autophagy and protects myocardium against ischemia/reperfusion injury via 14-3-3η/Akt/Beclin1 pathway[J]. Eur J Pharmacol, 2023, 954: 175865. DOI:10.1016/j.ejphar.2023.175865 |
| [4] |
张一凡, 杜敏, 王佳柔, 等. 丹参酮ⅡA促进胆固醇逆向转运改善动脉粥样硬化[J]. 中国药理学通报, 2023, 39(10): 1835-1839. DOI:10.12360/CPB202303080 |
| [5] |
LEMSON MS, TORDOIR JH, DAEMEN MJ, et al. Intimal hyperplasia in vascular grafts[J]. Eur J Vasc Endovasc Surg, 2000, 19(4): 336-350. DOI:10.1053/ejvs.1999.1040 |
| [6] |
CHAKRABORTY R, CHATTERJEE P, DAVE JM, et al. Targeting smooth muscle cell phenotypic switching in vascular disease[J]. JVS Vasc Sci, 2021, 2: 79-94. DOI:10.1016/j.jvssci.2021.04.001 |
| [7] |
ST PAUL A, CORBETT CB, OKUNE R, et al. AngiotensinⅡ, hypercholesterolemia, and vascular smooth muscle cells: a perfect trio for vascular pathology[J]. Int J Mol Sci, 2020, 21(12): 4525. DOI:10.3390/ijms21124525 |
| [8] |
SHI J, YANG Y, CHENG AY, et al. Metabolism of vascular smooth muscle cells in vascular diseases[J]. Am J Physiol Heart Circ Physiol, 2020, 319(3): H613-H631. DOI:10.1152/ajpheart.00220.2020 |
| [9] |
刘俪婷, 徐婷, 姜燕, 等. 自噬对血管平滑肌细胞增殖的影响[J]. 血管与腔内血管外科杂志, 2022, 8(2): 187-191, 209. DOI:10.19418/j.cnki.issn2096-0646.2022.02.13 |
| [10] |
GARCíA-MIGUEL M, RIQUELME JA, NORAMBUENA-SOTO I, et al. Autophagy mediates tumor necrosis factor-α-induced phenotype switching in vascular smooth muscle A7r5 cell line[J]. PLoS One, 2018, 13(5): e0197210. DOI:10.1371/journal.pone.0197210 |
| [11] |
BESTEBROER J, V'KOVSKI P, MAUTHE M, et al. Hidden behind autophagy: the unconventional roles of ATG proteins[J]. Traffic, 2013, 14(10): 1029-1041. DOI:10.1111/tra.12091 |
| [12] |
KATSURAGI Y, ICHIMURA Y, KOMATSU M. p62/SQSTM1 functions as a signaling hub and an autophagy adaptor[J]. FEBS J, 2015, 282(24): 4672-4678. DOI:10.1111/febs.13540 |
| [13] |
陈易斯, 宋福永. 选择性自噬接头蛋白p62/sequestosome 1的研究进展[J]. 中国药理学与毒理学杂志, 2016, 30(3): 258-265. DOI:10.3867/j.issn.1000-3002.2016.03.012 |
 2024, Vol. 53
2024, Vol. 53