文章信息
- 范悦, 王珺, 王晓明
- FAN Yue, WANG Jun, WANG Xiaoming
- 孕足月正常血压孕妇血清尿酸水平与新生儿出生体重的相关性
- Relationship between serum uric acid levels in normotensive pregnant women at full-term of pregnancy and birth weight of newborns
- 中国医科大学学报, 2024, 53(5): 427-433, 438
- Journal of China Medical University, 2024, 53(5): 427-433, 438
-
文章历史
- 收稿日期:2023-11-03
- 网络出版时间:2024-05-14 14:55:39
尿酸是嘌呤及其衍生物在肝脏由黄嘌呤氧化酶代谢的终产物 [1-2]。人体生理浓度的尿酸参与抗氧化反应和抗DNA损伤;但高浓度尿酸可引起内皮功能障碍和血管增生,是痛风、心血管及肾脏疾病的危险因素[3]。正常孕妇妊娠期间血清尿酸水平呈现孕早期、孕中期逐渐下降,孕晚期逐渐升高的生理变化[4]。
有研究[5]表明,妊娠期高尿酸血症与不良的胎儿结局和妊娠期高血压疾病相关。尿酸可能通过刺激血管收缩和炎性细胞因子而诱导NO产生,并增加血管平滑肌细胞中血栓素生成,导致内皮细胞功能障碍,引发高血压。也有研究[6]显示子痫前期(preeclampsia,PE)患者中,胎盘缺血引起的氧化应激和细胞因子诱导了尿酸代谢关键酶XO的活性,胎盘中XO和血清腺苷的表达水平升高。XO通过产生氧化剂(超氧阴离子等)将黄嘌呤转化为尿酸[7]。血压正常孕妇血尿酸水平是否与胎儿宫内生长发育相关还存在一定争议[3, 8-9]。本研究比较了孕足月血压正常孕妇尿酸水平与新生儿出生体重的关系,旨在为临床重视孕妇血清尿酸水平的异常并及时干预提供依据。
1 材料与方法 1.1 研究对象及分组收集2012年1月至2022年12月中国医科大学附属盛京医院产科病房住院分娩的130 703例患者的临床资料。其中分娩适于胎龄儿(appropriate for gestational age,AGA)孕妇119 509例,大于胎龄儿(large for gestational age,LGA)孕妇8 695例,小于胎龄儿(small for gestational age,SGA)孕妇2 499例。分层随机抽取1 200例血压正常且足月分娩的汉族孕妇纳入本研究。排除标准:(1)胎儿先天性异常、染色体异常以及新生儿死亡;(2)患有妊娠期高血压;(3)既往患有糖尿病、肾病、系统性红斑狼疮等可能影响尿酸代谢的疾病;(4)入院前2个月内曾服用糖皮质激素、利尿剂或其他可能影响尿酸代谢的药物。本研究属于回顾性研究,获得我院医学伦理委员会批准并豁免受试者的知情同意书(2023PS864K)。将入组孕妇按照新生儿出生体重分为LGA组(n = 300)、AGA组(n = 600)和SGA组(n = 300)。
1.2 诊断标准孕妇入院后静息状态间隔4 h,2次以上测量血压为记录血压,根据第9版《妇产科学》 [10]判断标准,收缩压 < 140 mmHg和舒张压 < 90 mmHg为血压正常。新生儿出生体重的分布曲线和各周龄新生儿出生体重的百分位数参考《中国不同出生胎龄新生儿出生体重、身长和头围的生长参照标准及曲线》 [11]。SGA,新生儿出生体重 < 第10百分位;AGA,新生儿出生体重第10百分位~第90百分位;LGA,新生儿体重 > 第90百分位。
孕妇入院后分娩前抽取清晨空腹血(2 mL)检测血尿酸水平,根据《中国高尿酸血症相关疾病诊疗多学科专家共识》 [12],血尿酸 > 420 μmol/L诊断为高尿酸血症。根据《妊娠期高血糖诊治指南(2022)》 [13],将妊娠24~28周及以前尚未诊断为糖尿病,且口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)结果提示:空腹血糖≥5.1 mmol/L;服糖后1 h血糖≥10.0 mmol/L,2 h血糖≥8.5 mmol/L孕妇诊断为妊娠期糖尿病。
1.3 观察指标收集纳入孕妇和新生儿的一般资料和实验室指标。孕妇临床资料包括年龄、身高、孕前体重指数(body mass index,BMI)、孕期体重增长、孕次、产次、孕周、此次分娩方式、收缩压、舒张压、尿酸和肌酐等。新生儿临床资料包括性别、出生身高、体重、头围、腹围及头围/胸围比值。
1.4 统计学分析利用SPSS 25.0软件进行统计学分析。采用PASS软件确定满足本研究每组统计检验的最小样本量为184例。符合正态分布的计量资料采用x±s表示,多组比较采用方差分析,两组比较采用LSD法;非正态分布数据采用M(P25~P75)表示,两组比较采用Mann-Whitney U检验,多组比较采用Kruskal-Wallis H检验。计数资料采用率(%)表示,组间比较采用χ2检验。采用多因素logistic回归分析影响新生儿出生体重的独立危险因素。采用Kendall’ s Tau-b相关分析探讨尿酸水平与新生儿出生体重的相关性,并进行限制性立方样条回归分析。以尿酸浓度的整10百分位数对应数值为分界点,将研究对象分为10组,以尿酸344~ < 375 μmol/L组为参照组,进行血清尿酸水平与LGA、SGA发病关系的logistic回归模型分析。P < 0.05为差异有统计学意义。
2 结果 2.1 3组一般情况比较结果显示,3组年龄,身高,孕前BMI,孕期体重增长,分娩前收缩压、舒张压,分娩方式比较均有统计学差异(均P < 0.05);3组孕妇高尿酸血症发生率,分娩孕周,新生儿出生体重、身高、头围、胸围、头/胸围比值比较也均有统计学差异(均P < 0.05)。而3组孕妇孕次、产次比较均无统计学差异(均P > 0.05)。与AGA组比较,LGA组及SGA组收缩压、舒张压、剖宫产率及孕期体重增长均显著升高(均P < 0.05);与AGA组比较,SGA组分娩年龄、孕前BMI及分娩孕周均显著降低(均P < 0.05),见表 1。
| Item | AGA group(n = 600) | LGA group(n = 300) | SGA group(n = 300) | P |
| Age(year) | 31(27-36) | 32(29-37) | 29(25-35)1) | 0.011 |
| Height(cm) | 159(156-164) | 162(159-168) | 161(157-165)1) | 0.021 |
| BMI before pregnancy(kg/m2) | 22.4(19.3- 26.0) | 23.0(21.2-26.8) | 21.1(18.1-25.1)1) | < 0.001 |
| Weight gain during pregnancy(kg) | 15.0(12.0-22.3) | 17.0(14.0-24.0)1) | 14.5(11.5-21.0)1) | 0.041 |
| Systolic blood pressure(mmHg) | 115(108-120) | 122(115-130)1) | 130(120-138)1) | < 0.001 |
| Diastolic blood pressure(mmHg) | 70(67-80) | 78(71-82)1) | 78(70-87)1) | < 0.001 |
| Pregnancy | 2(1-3) | 2(1-3) | 2(1-2) | 0.053 |
| Parity | 0(0-0) | 0(0-1) | 0(0-1) | 0.061 |
| Mode of delivery [n(%)] | < 0.001 | |||
| Vaginal delivery | 321(53.5) | 141(47.0)1) | 118(41.4)1) | |
| Cesarean section | 279(46.5) | 159(53.0) | 182(58.7) | |
| Gestational age at delivery(week) | 39(38-39) | 39(38-39) | 37(37-38)1) | < 0.001 |
| Gestational diabetes mellitus [n(%)] | 0.168 | |||
| Yes | 105(17.5) | 64(21.0) | 57(19.0) | |
| No | 495(82.0) | 236(78.7) | 243(81.0) | |
| Hyperuricemia [n(%)] | < 0.001 | |||
| Yes | 56(9.3) | 46(15.3)1) | 105(35.0)1) | |
| No | 544(90.7) | 254(84.7) | 195(65.0) | |
| Uric acid(μmol/L) | 288(243-350) | 336(269-388)1) | 377(297-431)1),2) | < 0.001 |
| Creatinine(mmol/L) | 43.3(38.3-48.2) | 45.2(40.7-50.3)1) | 47.3(40.9-54.9)1),2) | < 0.001 |
| Newborn sex [n(%)] | 0.123 | |||
| Male | 320(53.3) | 168(56.0) | 143(47.7) | |
| Female | 280(46.7) | 132(44.0) | 157(52.3) | |
| Birth weight(g) | 3 310(3 100-3 560) | 4 150(4 060-4 310)1) | 2 290(2 031-2 430)1) | < 0.001 |
| Newborn length(cm) | 50(50-51) | 53(52-54)1) | 46(43-48)1) | < 0.001 |
| Newborn head circumference(cm) | 34(33-35) | 36(35-37)1) | 32(30-33)1) | < 0.001 |
| Newborn chest circumference(cm) | 33(32-34) | 36(35-38)1) | 31(30-33)1) | < 0.001 |
| Head circumstance/chest circumstance | 1.03(1.03-1.03) | 1.00(0.97-1.03)1) | 1.03(1.03-1.07)1) | < 0.001 |
| 1)P < 0.05 compared with AGA group;2)P < 0.05 compared with LGA group. | ||||
根据入院分娩前血清化验结果,高尿酸血症207例(17.2%),其中AGA组56例(9.3%),LGA组46(15.3%),SGA组105例(35.0%)。3组患者空腹尿酸及肌酐比较结果显示,与AGA组比较,LGA组、SGA组血尿酸、肌酐水平均显著升高(均P < 0.05);与LGA组比较,SGA组血尿酸、肌酐水平均显著升高(均P < 0.05),见表 1。
2.2 单因素logistic回归分析影响新生儿出生体重的因素将3组孕妇比较有统计学差异(P < 0.05)指标作为自变量,新生儿出生体重作为因变量(AGA=0,LGA=1,SGA=2)进行单因素logistic回归分析,以AGA组为参考类别,以尿酸增加10 μmol/L作为一个单位,分析各指标与新生儿出生体重的相关性。结果显示,孕前BMI、孕期体重增长、收缩压、舒张压、尿酸、肌酐是增加LGA风险的因素;身高是降低LGA风险的因素。年龄、孕前BMI、收缩压、舒张压、尿酸、肌酐是增加SGA风险的因素;身高和孕期体重增长是降低SGA风险的因素,见表 2。
| Variable | LGA group | SGA group | |||
| OR(95% CI) | P | OR(95% CI) | P | ||
| Age | 1.025(0.997-1.055) | 0.085 | 1.047(1.018-1.007) | 0.001 | |
| Height | 0.933(0.904-0.962) | < 0.001 | 0.881(0.853-0.911) | < 0.001 | |
| BMI before pregnancy | 1.051(1.014-1.090) | 0.007 | 1.051(1.015-1.090) | 0.007 | |
| Weight gain during pregnancy | 1.034(1.010-1.058) | 0.005 | 0.854(0.829-0.880) | < 0.001 | |
| Systolic blood pressure | 1.051(1.039-1.064) | < 0.001 | 1.067(1.054-1.080) | < 0.001 | |
| Diastolic blood pressure | 1.053(1.035-1.071) | < 0.001 | 1.060(1.042-1.078) | < 0.001 | |
| Uric acid | 1.058(1.040-1.077) | < 0.001 | 1.098(1.078-1.117) | < 0.001 | |
| Creatinine | 1.026(1.011-1.042) | 0.001 | 1.055(1.039-1.071) | < 0.001 | |
2.3 多因素logistic回归分析新生儿出生体重的影响因素
将影响新生儿出生体重单因素分析有统计学意义(P < 0.05)因素纳入多因素logistic回归模型。结果显示,孕期体重增长、收缩压升高增加孕妇分娩LGA的风险,身高则是分娩LGA的保护因素(均P < 0.05)。收缩压、肌酐升高是孕妇分娩SGA的危险因素,身高、孕期体重增长是分娩SGA的保护因素(均P < 0.05),见表 3、4。
| Variable | β | SE | Wald | P | OR(95%CI) |
| Height | -0.072 | 0.017 | 18.187 | < 0.001 | 0.931(0.900-0.962) |
| Weight gain during pregnancy | 0.028 | 0.013 | 4.928 | 0.026 | 1.029(1.003-1.055) |
| BMI before pregnancy | 0.024 | 0.020 | 1.437 | 0.231 | 1.024(0.985-1.065) |
| Systolic blood pressure | 0.047 | 0.009 | 25.184 | < 0.001 | 1.048(1.029-1.068) |
| Diastolic blood pressure | -0.006 | 0.013 | 0.204 | 0.651 | 0.994(0.968-1.020) |
| Uric acid | 0.039 | 0.010 | 15.414 | < 0.001 | 1.040(1.020-1.060) |
| Creatinine | 0.008 | 0.009 | 0.756 | 0.385 | 1.008(0.990-1.026) |
| Variable | β | SE | Wald | P | OR(95%CI) |
| Age | 0.019 | 0.017 | 1.182 | 0.277 | 1.019(0.985-1.053) |
| Height | -0.141 | 0.020 | 48.542 | < 0.001 | 0.869(0.835-0.904) |
| Weight gain during pregnancy | -0.166 | 0.017 | 90.629 | < 0.001 | 0.847(0.819-0.877) |
| BMI before pregnancy | 0.019 | 0.022 | 0.730 | 0.393 | 1.019(0.976-1.063) |
| Systolic blood pressure | 0.064 | 0.010 | 38.134 | < 0.001 | 1.066(1.045-1.088) |
| Diastolic blood pressure | -0.027 | 0.015 | 3.125 | 0.077 | 0.974(0.945-1.003) |
| Uric acid | 0.069 | 0.011 | 39.179 | < 0.001 | 1.072(1.049-1.095) |
| Creatinine | 0.032 | 0.010 | 11.147 | 0.001 | 1.033(1.013-1.053) |
研究结果显示,血清尿酸水平与分娩SGA、LGA显著相关。以AGA组为对照组,孕妇血尿酸水平每增加10 μmol/L,发生LGA的风险增加4%(95%CI:1.020~1.060,P < 0.05);发生SGA的风险增加7.2%(95%CI:1.049~1.095,P < 0.05),见表 3、4。
2.4 孕妇尿酸水平与新生儿出生体重的相关性分析采用Kendall’ s tau-b相关性分析探讨孕妇尿酸水平与新生儿出生体重之间的相关性。结果显示,当3组整体进行分析时,孕妇尿酸水平[317(259~388)μmol/L] 与新生儿出生体重[3 310(2 650~3 950)g]呈负相关(r = -0.084,P < 0.001);3组分别进行分析时,AGA组孕妇尿酸水平与新生儿出生体重不相关(r = 0.017,P = 0.532);LGA组孕妇尿酸水平与新生儿出生体重呈正相关(r = 0.108,P = 0.006);SGA组孕妇尿酸水平与新生儿出生体重呈负相关(r = -0.224,P < 0.001)。
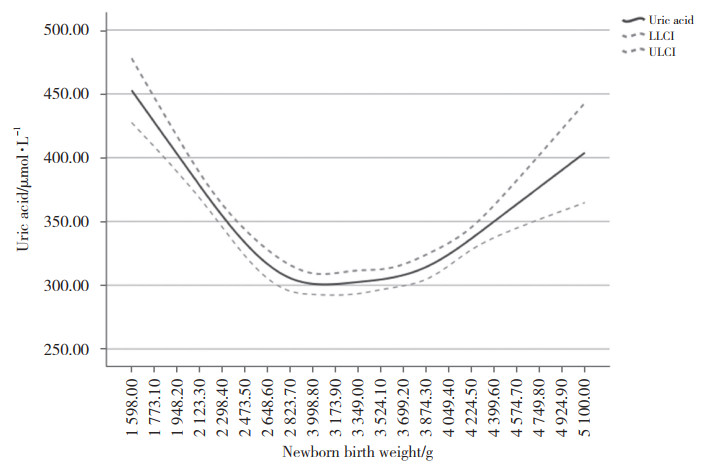
对孕妇血尿酸水平与新生儿出生体重间关系进行限制性立方样条回归分析显示,二者呈现近“U”形关系。新生儿出生体重在3 000 g时,孕妇血尿酸水平处于最低值;新生儿出生体重 > 3 000 g时,孕妇尿酸水平随新生儿出生体重增加而上升;新生儿出生体重 < 3 000 g时,孕妇尿酸水平随新生儿出生体重增加而下降,见图 1。
|
| LLCI, lower limit of the confidence interval; ULCI, upper limit of the confidence interval. 图 1 新生儿出生体重与孕妇血尿酸水平之间的关系 Fig.1 The relationship between neonatal birth weight and serum uric acid levels of pregnant women |
2.5 孕妇尿酸水平与分娩LGA和SGA的关系
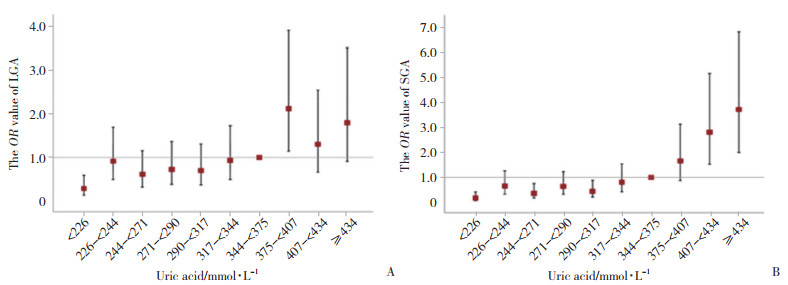
为了进一步探索孕妇血清尿酸水平与LGA和SGA发生风险的关系,以整10百分位数对应的尿酸浓度值为分界点,将所有研究对象分为10组,以尿酸344~ < 375 μmol/L组为参照组,进行血清尿酸水平与LGA、SGA发病风险的logistic回归模型分析。结果显示,尿酸水平375~ < 407 μmol/L孕妇分娩LGA的可能性最大,是分娩AGA可能性的2.101倍(OR=2.101,95%CI:1.144~3.858)。随尿酸水平递增,孕妇发生SGA风险总体呈逐渐上升趋势,当尿酸≥344 μmol/L时,孕妇分娩SGA的可能性明显增大;当尿酸≥434 μmol/L时,孕妇分娩SGA的可能性是分娩AGA的3.677倍(OR=3.677,95%CI:1.98~6.83),见图 2。
|
| A, LGA; B, SGA. 图 2 孕妇尿酸水平与发生LGA、SGA风险的回归性分析 Fig.2 Regression analysis of uric acid levels and risk of LGA and SGA in pregnant women |
3 讨论
近几十年来,高尿酸血症与妊娠的关系一直受到关注。妊娠期血尿酸水平波动较大,孕妇孕早期由于肾血流量和肾小球滤过率增加,血清尿酸水平下降;而在妊娠中晚期,孕妇肾脏代谢尿酸能力下降,胎儿逐渐发育成熟,与母体物质交换能力减弱,胎儿通过羊水排泄尿酸等原因,孕妇出现生理性血尿酸水平升高[14-15]。目前,不同孕龄健康女性血尿酸正常值范围尚缺乏大样本数据,妊娠期高尿酸血症也没有统一的诊断标准。本研究结果显示,血压正常孕妇高尿酸血症发生率为17.2%;AGA组和LGA组和SGA组孕妇高尿酸血症发生率分别为9.3%、15.3%和35.0%,SGA组显著高于AGA组、LGA组(均P < 0.05);3组孕妇年龄、身高、孕前BMI、孕期体重增长、分娩方式及分娩孕周比较均有统计学差异(均P < 0.05)。
尿酸是一种还原性物质,可参与氧化还原反应,有抗氧化、抗DNA损伤作用,对于维持机体内环境稳定具有重要价值。然而,高浓度尿酸会促进血管平滑肌增生,从而导致内皮结构和功能紊乱。研究[16]表明,血清尿酸水平与痛风、心脑血管疾病及代谢综合征等疾病的发生密切相关。近年来一些研究[15, 17]显示妊娠期血尿酸升高与PE、妊娠期糖尿病、胎儿宫内发育迟缓等母婴不良结局相关。LE等[18]研究显示,血尿酸 > 393 μmol/L PE患者发生早产、胎儿生长受限、低APGAR评分、新生儿死亡等不良结局增加。1项大型前瞻性研究 [19]发现尿酸水平越高的孕晚期患者,母体发生早产、妊娠期糖尿病和PE风险,新生儿发生低体重出生儿及SGA的风险均明显增加。除此之外,MISHU等[20]研究发现与非妊娠期糖尿病孕妇相比,妊娠期糖尿病孕妇中孕期血清尿酸水平比较无统计学差异,而妊娠期糖尿病孕妇晚孕期尿酸水平高于非妊娠期糖尿病晚孕期患者。本研究中3组患者妊娠期糖尿病的发生率比较无统计学差异,因此可以排除妊娠期糖尿病造成尿酸水平差异的影响。
本研究结果显示,SGA组及LGA组孕妇尿酸、肌酐水平均显著高于AGA组(均P < 0.05)。值得注意的是,本研究所有孕妇孕期及产后血压均正常,但LGA组和SGA组入院收缩压和舒张压均高于AGA组(均P < 0.05)。有研究[21]认为要重视正常血压高值低风险孕妇的监测和管理,这些孕妇发生不良妊娠的风险增加,本研究结果支持这一观点。
既往研究表明孕妇尿酸水平不仅可以作为新生儿出生体重的独立影响因素,也可以作为孕妇分娩SGA及不良围产期结局的预测因素。RYU等[17]在PE孕妇模型中预测低出生体重儿的血清尿酸阈值为6.35 mg/dL(377 μmol/L)。HAWKINS等[22]发现
妊娠期高血压疾病患者血清尿酸 > 5.9 mg/dL(350 μmol/L)与不良母婴围产期结局有关。本研究多因素logistic回归分析结果显示,孕妇尿酸水平是影响新生儿出生体重的独立危险因素,孕妇血清尿酸水平每增加10 μmol/L,发生LGA的风险增加4%,发生SGA的风险增加7.2%(均P < 0.05),与以往研究结果一致。
关于孕妇血尿酸水平与新生儿出生体重的关系一直备受关注。1项纳入1 291例密歇根州孕妇的研究[23]比较了孕16~27周时血清尿酸水平与新生儿出生体重的关系。结果显示,AGA组孕中期孕妇血尿酸水平与新生儿出生体重无关,在SGA组二者呈J形关系,在LGA组二者呈线性关系。青岛大学的1项队列研究[24]显示,孕晚期孕妇血尿酸水平与新生儿出生体重呈负相关,与SGA分娩的发生风险呈正相关。AKAHORI等[25]研究比较了40例正常血压SGA孕妇和80例正常血压AGA孕妇孕晚期血清尿酸水平。结果显示SGA组尿酸水平显著高于AGA组,重度SGA组尿酸水平与新生儿体重呈显著负相关。本研究结果显示,足月正常血压孕妇血尿酸水平与新生儿出生体重相关。AGA组孕妇血尿酸水平与新生儿出生体重不相关;LGA组孕妇血尿酸水平与新生儿出生体重呈正相关;SGA组血尿酸水平与新生儿出生体重呈负相关。在限制性样条回归分析中,二者呈现类似“U”形关系,即新生儿出生体重3 000 g时孕妇血尿酸水平最低。新生儿出生体重 < 3 000 g时,孕妇血尿酸水平随新生儿出生体重增大逐渐降低;新生儿出生体重 > 3 000 g时,孕妇血尿酸水平随新生儿出生体重增大而逐渐升高。
孕妇血尿酸水平升高与LGA和SGA发生风险增高的机制尚不清楚。LAUGHON等[8]研究观察了212例正常血压孕妇,发现孕妇中孕期尿酸水平升高与胰岛素抵抗及新生儿低出生体重相关,高尿酸水平与低出生体重的相关性被胰岛素抵抗减弱。目前尚未证实高尿酸血症是否直接导致胎儿生长受损。胎盘血管缺乏自主神经支配,局部及循环中的血管活性物质对调控胎盘血流灌注非常重要 [26]。机体内尿酸水平过度升高,可抑制NO的产生,损伤胎盘灌注,影响胎儿生长。患有高尿酸血症孕妇妊娠早期也可能由于滋养细胞侵袭不佳而出现胎盘异常,影响胎儿宫内发育[27]。LGA组孕妇尿酸水平与新生儿体重正相关机制尚不清楚,推测可能由于高体重胎儿产生更多的尿酸进入母血循环所致。
综上所述,本研究比较AGA组、LGA组和SGA组孕妇孕晚期血清尿酸水平,发现LGA组和SGA组孕妇尿酸水平均高于AGA组;LGA组和SGA组尿酸水平与新生儿出生体重相关,表明这些孕期血压正常孕妇机体内亦存在亚临床异常,而尿酸水平的异常可能是早期表现。因此,对于尿酸水平升高孕妇,临床医生应该严格控制患者尿酸水平,必要时监测胎儿生长发育,预防不良围产期结局发生。本研究纳入了较大样本的汉族人群研究,排除妊娠期高血压以及早产对胎儿生长发育的影响,考虑了孕妇尿酸水平与新生儿出生体重之间的非线性关系,对SGA和LGA组进行了单独评估,明确尿酸可以作为新生儿出生体重的独立影响因素。后续还需进一步明确尿酸在胎儿生长发育中的确切作用;深入分析孕妇血尿酸水平是否可以导致母体胎盘微环境的变化,进而影响胎儿生长发育。
| [1] |
LIN J, HONG XY, TU RZ. The value of serum uric acid in predicting adverse pregnancy outcomes of women with hypertensive disorders of pregnancy[J]. Ginekol Pol, 2018, 89(7): 375-380. DOI:10.5603/GP.a2018.0064 |
| [2] |
LU YH, CHANG YP, LI T, et al. Empagliflozin attenuates hyperuricemia by upregulation of ABCG2 via AMPK/AKT/CREB signaling pathway in type 2 diabetic mice[J]. Int J Biol Sci, 2020, 16(3): 529-542. DOI:10.7150/ijbs.33007 |
| [3] |
ROTHENBACHER D, BRAIG S, LOGAN CA, et al. Association of maternal uric acid and cystatin C serum concentrations with maternal and neonatal cardiovascular risk markers and neonatal body composition: the Ulm SPATZ Health Study[J]. PLoS One, 2018, 13(7): e0200470. DOI:10.1371/journal.pone.0200470 |
| [4] |
PECORARO V, TRENTI T. Predictive value of serum uric acid levels for adverse maternal and perinatal outcomes in pregnant women with high blood pressure. A systematic review and meta-analysis[J]. Eur J Obstet Gynecol Reprod Biol, 2020, 252: 447-454. DOI:10.1016/j.ejogrb.2020.07.042 |
| [5] |
PAGKOPOULOU E, SOULAIDOPOULOS S, TRIANTAFYLLIDOU E, et al. Association between uric acid and worsening peripheral microangiopathy in systemic sclerosis[J]. Front Med, 2021, 8: 806925. DOI:10.3389/fmed.2021.806925 |
| [6] |
KANG DH, FINCH J, NAKAGAWA T, et al. Uric acid, endothelial dysfunction and pre-eclampsia: searching for a pathogenetic link[J]. J Hypertens, 2004, 22(2): 229-235. DOI:10.1097/00004872-200402000-00001 |
| [7] |
SUZUKI S, YONEYAMA Y, SAWA R, et al. Relation between serum uric acid and plasma adenosine levels in women with preeclampsia[J]. Gynecol Obstet Invest, 2001, 51(3): 169-172. DOI:10.1159/000052918 |
| [8] |
LAUGHON SK, CATOV J, PROVINS T, et al. Elevated first-trimester uric acid concentrations are associated with the development of gestational diabetes[J]. Am J Obstet Gynecol, 2009, 201(4): 402.e1-402.e5. DOI:10.1016/j.ajog.2009.06.065 |
| [9] |
LIU LN, YU CX, YANG FF, et al. Maternal hyperuricemia superimposed on maternal hypertension aggravates the risk of small-for-gestational-age fetus[J]. Life Sci, 2019, 228: 215-220. DOI:10.1016/j.lfs.2019.04.033 |
| [10] |
谢幸, 孔北华, 段涛. 妇产科学[M]. 9版. 北京: 人民卫生出版社, 2018.
|
| [11] |
九市儿童体格发育调查协作组. 中国不同出生胎龄新生儿出生体重、身长和头围的生长参照标准及曲线[J]. 中华儿科杂志, 2020, 58(9): 738-746. DOI:10.3760/cma.j.cn112140-20200316-00242 |
| [12] |
高尿酸血症相关疾病诊疗多学科共识专家组. 中国高尿酸血症相关疾病诊疗多学科专家共识[J]. 中华内科杂志, 2017, 56(3): 235-248. DOI:10.3760/cma.j.issn.0578-1426.2017.03.021 |
| [13] |
中华医学会妇产科学分会产科学组, 中华医学会围产医学分会, 中国妇幼保健协会妊娠合并糖尿病专业委员会. 妊娠期高血糖诊治指南(2022)[第一部分][J]. 中华妇产科杂志, 2022, 57(1): 3-12. DOI:10.3760/cma.j.cn112141-20210917-00528 |
| [14] |
RIIS JL, COOK SH, LETOURNEAU N, et al. Characterizing and evaluating diurnal salivary uric acid across pregnancy among healthy women[J]. Front Endocrinol, 2022, 13: 813564. DOI:10.3389/fendo.2022.813564 |
| [15] |
DEEPASHREE PG, MADHUSHANKARI GS, NANDINI DB, et al. Saliva as an alternative non-invasive biomarker for the estimation of uric acid levels during pregnancy: a longitudinal study[J]. J Oral Maxillofac Pathol, 2021, 25(3): 457-462. DOI:10.4103/jomfp.jomfp_439_20 |
| [16] |
MATSUBAYASHI M, SAKAGUCHI YM, SAHARA Y, et al. 27-Hydroxycholesterol regulates human SLC22A12 gene expression through estrogen receptor action[J]. FASEB J, 2021, 35(1): e21262. DOI:10.1096/fj.202002077R |
| [17] |
RYU A, CHO NJ, KIM YS, et al. Predictive value of serum uric acid levels for adverse perinatal outcomes in preeclampsia[J]. Medicine, 2019, 98(18): e15462. DOI:10.1097/MD.0000000000015462 |
| [18] |
LE TM, NGUYEN LH, PHAN NL, et al. Maternal serum uric acid concentration and pregnancy outcomes in women with pre-eclampsia/eclampsia[J]. Int J Gynaecol Obstet, 2019, 144(1): 21-26. DOI:10.1002/ijgo.12697 |
| [19] |
YUAN XS, HAN XY, JIA CB, et al. Association of maternal serum uric acid and cystatin C levels in late pregnancy with adverse birth outcomes: an observational cohort study in China[J]. Int J Womens Health, 2022, 14: 213-223. DOI:10.2147/IJWH.S350847 |
| [20] |
MISHU FA, BARAL N, FERDOUS N, et al. Estimation of serum creatinine and uric acid in Bangladeshi gestational diabetic mother attending in tertiary care hospital[J]. Mymensingh Med J, 2019, 28(2): 352-355. |
| [21] |
淮静, 杨慧霞. 重视孕期轻度高血压的管理[J]. 中华围产医学杂志, 2022, 25(5): 366-368. DOI:10.3760/cma.j.cn113903-20220413-00363 |
| [22] |
HAWKINS TLA, ROBERTS JM, MANGOS GJ, et al. Plasma uric acid remains a marker of poor outcome in hypertensive pregnancy: a retrospective cohort study[J]. BJOG, 2012, 119(4): 484-492. DOI:10.1111/j.1471-0528.2011.03232.x |
| [23] |
ZHOU GL, HOLZMAN C, LUO ZH, et al. Maternal serum uric acid levels in pregnancy and fetal growth[J]. J Matern Fetal Neonatal Med, 2020, 33(1): 24-32. DOI:10.1080/14767058.2018.1484093 |
| [24] |
孙文艳, 李长贵, 张辉, 等. 妊娠晚期血尿酸水平与不良妊娠结局的相关性研究[J]. 中华内科杂志, 2021, 60(5): 446-452. DOI:10.3760/cma.j.cn112138-20200521-00502 |
| [25] |
AKAHORI Y, MASUYAMA H, HIRAMATSU Y. The correlation of maternal uric acid concentration with small-for-gestational-age fetuses in normotensive pregnant women[J]. Gynecol Obstet Invest, 2012, 73(2): 162-167. DOI:10.1159/000332391 |
| [26] |
GAO QQ, LI H, DING HM, et al. Hyper-methylation of AVPR1A and PKCΒ gene associated with insensitivity to arginine vasopressin in human pre-eclamptic placental vasculature[J]. EBioMedicine, 2019, 44: 574-581. DOI:10.1016/j.ebiom.2019.05.056 |
| [27] |
BAINBRIDGE SA, ROBERTS JM. Uric acid as a pathogenic factor in preeclampsia[J]. Placenta, 2008, 29(Suppl A): S67-S72. DOI:10.1016/j.placenta.2007.11.001 |
 2024, Vol. 53
2024, Vol. 53