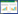文章信息
- 胡明亮, 王强
- HU Mingliang, WANG Qiang
- 转录因子MYB激活CTSF通过谷氨酰胺代谢影响胃癌细胞增殖和细胞干性
- Transcription factor MYB activates CTSF to affect gastric cancer cell proliferation and stemness through glutamine metabolism
- 中国医科大学学报, 2024, 53(5): 405-413
- Journal of China Medical University, 2024, 53(5): 405-413
-
文章历史
- 收稿日期:2023-10-30
- 网络出版时间:2024-05-14 14:23:55
胃癌是消化系统常见的侵袭性恶性肿瘤,其特点是快速增殖和转移[1],这是造成胃癌患者预后不良的关键因素。肿瘤干细胞具有自我更新、无限增殖和维持相对休眠状态的能力,越来越多的证据表明,肿瘤干细胞可能是导致胃癌进展、复发、增殖和转移的主要原因[2]。因此,阐明胃癌细胞干性的分子机制,对基于肿瘤干细胞途径治疗胃癌具有重大意义。
肿瘤细胞代谢重编程是肿瘤发生、发展过程中最显著的特征之一,细胞癌变过程中代谢模式发生显著变化,涉及糖酵解、氧化磷酸化、氨基酸代谢、脂肪酸代谢和核酸代谢等多个方面。近年来,谷氨酰胺代谢在促进肿瘤恶性进展中的作用受到越来越多的关注[3]。前列腺癌中,HepaCAM/PIK3CA轴调控谷氨酰胺代谢重编程,以抑制前列腺癌细胞增殖[4]。因此,进一步探讨谷氨酰胺代谢对胃癌细胞干性的影响,对探索胃癌治疗新方向具有重大意义。组织蛋白酶F(cathepsin F,CTSF)是木瓜蛋白酶家族中溶酶体半胱氨酸蛋白酶之一,包含一系列广泛的蛋白水解酶,可催化多种蛋白质水解,对细胞内蛋白质的降解起到关键的调节作用。研究[5]报道,敲除CTSF可诱导胃癌细胞增殖,并抑制细胞凋亡。然而,CTSF对谷氨酰胺代谢和胃癌细胞干性的影响尚无研究报道。因此,本研究探讨了CTSF对谷氨酰胺代谢和胃癌细胞干性的影响及其潜在的分子调控机制。
1 材料与方法 1.1 生物信息学分析从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库下载胃癌患者mRNA表达量数据(胃癌组织375例,癌旁正常组织32例),通过edgeR差异分析(|log2FC| > 2,校正P < 0.05),得到差异mRNA,并通过文献确定目标mRNA。对靶基因进行基因集富集分析(gene set enrichment analysis,GSEA)单基因富集分析。利用KnockTF数据库预测胃癌中目标基因上游的潜在转录因子,通过Pearson相关分析确定转录因子。预测目标基因与转录因子的结合位点,并进行通路富集分析。
1.2 方法 1.2.1 细胞培养和转染胃黏膜上皮细胞(GES-1)、胃癌细胞(MGC803、AGS和MKN-45)和293T细胞购自北京北纳创联生物技术研究院。MGC803细胞和MKN-45细胞在RPMI 1640培养基中培养,AGS细胞在F12K培养基中培养,GES-1细胞和293T细胞在DMEM-H培养基中培养。培养基中均添加10%胎牛血清、100 U/mL链霉素和100 U/mL青霉素。培养条件为37 ℃、5%CO2。
sh-CTSF、oe-CTSF、oe-MYB以及相应的对照sh-NC和oe-NC均由上海吉玛制药技术有限公司提供。根据说明书,使用Lipofectamine 3000(美国Invitrogen公司)将以上载体转染至胃癌细胞中。转染48 h后收集细胞,用于后续实验。
1.2.2 实时荧光定量PCR使用TRIzol试剂(美国Invitrogen公司)从细胞中提取总RNA。cDNA合成使用PrimeScript™ RT reagent Kit with gDNA Eraser试剂盒(日本TaKaRa公司)完成。根据说明书,使用SsoFast™ EvaGreen® Supermix with Low ROX(美国Bio-Rad公司)进行实时荧光定量PCR。以β-actin为内参,通过2-ΔΔCt公式计算基因相对表达量。
1.2.3 CCK-8细胞增殖实验使用CCK-8细胞增殖毒性检测试剂盒(日本Dojindo公司)检测细胞活力。将细胞按(1.5~2)×103/孔的密度接种到96孔板,每组设5个复孔,在37℃培养箱中继续培养0、24、48、72 h,检测前更换100 μL培养基,加入10 μL CCK-8试剂,培养箱中继续培养1 h后,在450 nm波长下读取光密度(optical density,OD)值。
1.2.4 平板克隆形成实验将细胞按(1.5~2)×103/孔的密度接种到6孔板,每组设置3个复孔,轻轻摇动,使细胞均匀分散,置于培养箱中培养约14 d,当6孔板中出现肉眼可见的克隆时,终止培养。弃培养基,PBS洗涤细胞,4%多聚甲醛固定液固定细胞30 min,加适量的0.1%结晶紫染色30 min,PBS缓慢洗掉染色液,干燥后拍照。
1.2.5 细胞成球实验将2×105个细胞在含0.4%牛血清白蛋白(美国Sigma公司)、2% B27(美国BD Pharmingen公司)、5 μg/mL胰岛素(美国Sigma公司)、20 ng/mL碱性成纤维细胞生长因子(美国Invitrogen公司)和20 ng/mL表皮生长因子(美国Invitrogen公司)的无血清DMEM培养基中培养,每组设置3个复孔。37 ℃下孵育2周后,评估球体的数量。
1.2.6 Western blotting使用RIPA缓冲液(上海碧云天生物技术有限公司)裂解细胞,并用BCA检测试剂盒[生工生物工程(上海)股份有限公司]对总蛋白进行定量。将30 μg总蛋白通过SDS-PAGE进行分离,然后转移到PVDF膜上。在5%脱脂牛奶中封闭1 h后,将膜与一抗OCT4、NANOG、SOX2、SLC1A5和β-actin(英国Abcam公司)在4 ℃孵育过夜。将与辣根过氧化物酶偶联的二抗IgG和膜在室温下孵育2 h。
1.2.7 谷氨酰胺代谢通路相关生化指标检测采用谷氨酰胺检测试剂盒(北京索莱宝科技有限公司)检测谷氨酰胺消耗量;采用谷氨酸测定试剂盒(北京索莱宝科技有限公司)测定谷氨酸浓度;采用α-酮戊二酸(α-ketoglutaric acid,α-KG)检测试剂盒(德国Merck公司)测定α-KG含量,具体操作步骤参照试剂盒说明书。
采用NADPH/NADP+定量试剂盒(德国Merck公司)检测NADPH/NADP+比值,胰蛋白酶消化,计数4×106个细胞,800 μL提取缓冲液进行2次冷冻/解冻循环,450 nm波长下读取OD值,计算NADP+和NADPH的信号强度。NADPH/NADP+比值=(加热样品的强度)/(未加热样品的强度-加热样品的强度)。
采用还原型谷胱甘肽(glutathione,GSH)和氧化型谷胱甘肽(oxidized glutathione,GSSG)检测试剂盒(上海碧云天生物技术有限公司)检测GSH/GSSG比值,具体操作步骤参照试剂盒说明书。
采用天冬氨酸(aspartic acid,Asp)检测试剂盒(德国Merck公司)检测Asp含量;采用草酰乙酸(oxaloacetic acid,OAA)检测试剂盒(德国Merck公司)检测OAA水平,具体操作步骤参照试剂盒说明书。
1.2.8 双荧光素酶实验将pmirGLO-CTSF-promoter-WT和pmirGLO-CTSF-promoter-MUT荧光素酶报告载体(美国Promega公司)和oe-NC、oe-MYB共转染到293T细胞。孵育48 h后,用1×PLB裂解细胞,使用双荧光素酶报告试剂盒(美国Promega公司)评估荧光素酶活性。
1.2.9 染色质免疫沉淀(chromatin immunoprecipitation,ChIP)采用EZ-Magna ChIP® A/G试剂盒(美国Millipore公司)测定ChIP。将OC细胞用PFA固定交联20 min并进行超声处理,将DNA片段化至1 000 bp。将DNA片段与MYB或IgG抗体(英国Abcam公司)混合,4 ℃下免疫沉淀过夜。通过实时荧光定量PCR收集、纯化和分析沉淀的染色质片段。
1.3 统计学分析采用GraphPad Prism 6.0软件进行统计分析。所有实验均重复3次。数据用x±s表示,2组间比较采用student t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 CTSF在胃癌中显著低表达生物信息学分析发现,CTSF在胃癌患者肿瘤组织中表达下调(图 1A)。实时荧光定量PCR结果(图 1B)显示,与人胃黏膜上皮细胞(GES-1)相比,CTSF在人胃癌细胞(SGC-7901、AGS和MGC-803)中的表达显著降低(P < 0.05)。在3种胃癌细胞中,CTSF在MGC-803细胞中的表达量最高,在AGS细胞中的表达量最低。引物序列:CTSF,正向5’-CCCAAAACCATCCAGACAA-3’,反向5’-CGGGCTTCTTCCTTTGACT-3’;β-actin,正向5’- AGAAGGCTGGGGCTCATTTG -3’,反向5’- AGGGGCCATCCACAGTCTTC -3’。以上结果表明,CTSF在胃癌组织和细胞中低表达。
|
| A, gastric cancer tissue; B, gastric cancer cells. * P < 0.05 vs. GES-1 cells. 图 1 CTSF在胃癌组织和细胞中低表达 Fig.1 Low CTSF expression in gastric cancer tissues and cells |
2.2 CTSF对胃癌细胞增殖和干性的影响
分别构建敲低CTSF的MGC-803细胞和过表达CTSF的AGS细胞。实时荧光定量PCR结果(图 2A)显示,与对照组相比,转染sh-CTSF的MGC-803细胞中CTSF的表达显著降低,转染oe-CTSF的AGS细胞中CTSF的表达显著升高(P < 0.05)。CCK-8结果(图 2B)显示,敲低CTSF显著促进MGC-803细胞的活力,而过表达CTSF显著抑制AGS细胞的活力(P < 0.05)。平板克隆形成实验结果(图 2C)显示,与对照组相比,敲低CTSF后MGC-803细胞形成的克隆数量显著增加,而过表达CTSF后AGS细胞形成的克隆数量显著减少(P < 0.05)。干细胞成球实验结果(图 2D)显示,敲低CTSF显著促进MGC-803细胞的细胞成球能力,而过表达CTSF显著抑制AGS细胞的细胞成球能力(P < 0.05)。Western blotting检测干细胞表面标志物OCT4、NANOG、SOX2的表达,结果(图 2E)显示,敲低CTSF显著促进MGC-803细胞中OCT4、NANOG、SOX2的表达,而过表达CTSF显著抑制AGS细胞中OCT4、NANOG、SOX2的表达。

|
| A, CTSF expression; B, cell viability; C, colony formation (×4);D, cell spheroidal ability (×40);E, OCT4, NANOG, and SOX2 expression. * P < 0.05 vs. sh-NC or oe-NC groups. 图 2 CTSF对胃癌细胞增殖和干性的影响 Fig.2 Effects of CTSF on gastric cancer cell proliferation and stemness |
2.3 CTSF调控谷氨酰胺代谢对胃癌细胞增殖和干性的影响
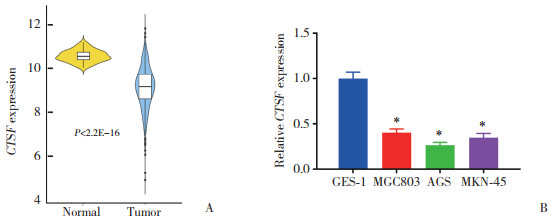
GSEA富集分析(图 3A)发现,CTSF富集在谷氨酰胺代谢途径。由此推测,CTSF可能通过调控谷氨酰胺代谢影响胃癌细胞增殖和干性。为了探讨CTSF是否通过调控谷氨酰胺代谢影响胃癌细胞增殖和干性,将AGS细胞分为sh-NC+DMSO组、sh-CTSF+DMSO组、sh-CTSF+GPNA组(GPNA为谷氨酰胺代谢抑制剂)。CCK-8和平板克隆形成实验结果(图 3B、3C,表 1)显示,敲低CTSF显著促进AGS细胞的细胞活力和增殖,GPNA处理后可部分减弱这种促进作用(P < 0.05)。此外,敲低CTSF显著提高了AGS细胞的细胞成球能力和干细胞表面标志物OCT4、NANOG、SOX2的表达水平,而GPNA处理后部分抵消了这种促进作用(P < 0.05,图 3D、3E,表 1)。敲低CTSF显著提高AGS细胞中谷氨酰胺、谷氨酸和α-KG含量、NADPH/NADP+比值、GSH/GSSG比值以及Asp和OAA的水平,而GPNA处理后逆转了这种促进作用(P < 0.05,表 1)。Western blotting检测谷氨酰胺转运蛋白SLC1A5的表达,结果(图 3F)发现,敲低CTSF显著提高AGS细胞中SLC1A5的表达水平,而GPNA处理后抑制了敲低CTSF对SLC1A5蛋白表达水平的促进作用。上述结果表明,CTSF通过调控谷氨酰胺代谢,抑制胃癌细胞增殖和干性。
|
| A, CTSF enrichment pathway analysis; B, cell viability; C, colony formation (×4);D, cell spheroidal ability (×40);E, OCT4, NANOG, and SOX2 expression; F, SLC1A5 expression. * P < 0.05 vs. sh-NC+DMSO group; # P < 0.05 vs. sh-CTSF+DMSO group. 图 3 CTSF调控谷氨酰胺代谢对胃癌细胞增殖和干性的影响 Fig.3 Effect of CTSF-regulated glutamine metabolism on gastric cancer cell proliferation and stemness |
| Item | sh-NC+DMSO group(n = 3) | sh-CTSF+DMSO group(n = 3) | sh-CTSF+GPNA group(n = 3) |
| Number of colonies | 221.78±20.02 | 368.61±32.421) | 240.94±20.962) |
| Sphere number | 43.22±3.54 | 75.61±6.121) | 47.50±3.422) |
| Relative glutamine level | 1.00±0.06 | 1.61±0.091) | 0.98±0.042) |
| Relative glutamic acid level | 1.00±0.05 | 2.48±0.101) | 0.90±0.062) |
| Relative α-KG level | 1.00±0.05 | 2.01±0.081) | 0.97±0.022) |
| Relative NADPH/NADP+ level | 1.00±0.02 | 2.59±0.191) | 1.25±0.012) |
| Relative GSH/GSSG level | 1.00±0.09 | 2.27±0.191) | 1.18±0.092) |
| Relative Asp level | 1.00±0.09 | 1.86±0.111) | 1.09±0.082) |
| Relative OAA level | 1.00±0.06 | 1.48±0.091) | 1.02±0.072) |
| 1)P < 0.05 vs. sh-NC+DMSO group;2)P < 0.05 vs. sh-CTSF+DMSO group. | |||
2.4 MYB是调控CTSF基因的转录因子
将预测的上游转录因子与上调的mRNA取交集,得到12个潜在的转录因子(图 4A),发现CTSF与MYB呈负相关(图 4B)。对MYB进行Wilcoxon秩和检验,发现MYB在胃癌组织中显著高表达(图 4C)。实时荧光定量PCR结果(图 4D)发现,MYB在胃癌细胞中的表达显著上调。MYB引物序列:正向5’-ACAGATGGGCAGAAATCGCA-3’,反向5’-GCTGGCTGGCTTTTGAAGAC-3’。利用JASPAR数据库对结合位点进行预测,发现转录因子MYB与CTSF转录本上游2 000 bp位置存在潜在的结合位点(图 4E)。双荧光素酶实验结果(图 4F)显示,转染oe-MYB能够显著降低CTSF-WT的荧光酶活性,而对CTSF-MUT没有影响。ChIP结果(图 4G)显示,与IgG相比,MYB抗体显著提高了CTSF的富集。ChIP-qPCR引物序列:正向5’-GCATCTGTGCATGCTTTCCC-3’,反向5’-ACAGGGTTGAGACTGTCCCT-3’。以上结果提示,MYB是CTSF基因的上游转录因子。

|
| A, upset plot of potential CTSF transcription factors versus upregulated mRNA; B, Pearson's correlation plot between CTSF and MYB; C, MYB expression in gastric cancer tissues; D, MYB expression in gastric cancer cells; E, potential MYB transcription factor binding site on CTSF; F, luciferase activity in 293T cells; G, CTSF enrichment for ChIP in AGS cells. * P < 0.05 vs. GES-1 cells or the oe-NC group; # P < 0.05 vs. IgG group. 图 4 MYB是调控CTSF基因的转录因子 Fig.4 MYB is the transcription factor of the CTSF gene |
2.5 MYB/CTSF通过谷氨酰胺代谢影响胃癌细胞增殖和干性
为了进一步研究MYB/CTSF轴是否通过调控谷氨酰胺代谢影响胃癌细胞增殖和干性,将AGS细胞分为oe-NC+oe-NC组、oe-MYB+oe-NC组、oe-MYB+oe-CTSF组。实时荧光定量PCR结果(表 2)显示,与对照组相比,过表达MYB能够抑制AGS细胞中CTSF的表达,而MYB和CTSF同时过表达能够减弱过表达MYB对AGS细胞中CTSF表达的影响(P < 0.05)。细胞功能检测结果(图 5A~5C,表 2)显示,与对照组相比,过表达MYB可以促进AGS细胞的细胞活力、细胞克隆数和细胞成球能力,而MYB和CTSF同时过表达减弱了过表达MYB对AGS细胞表型的影响(P < 0.05)。Western blotting结果(图 5D)显示,过表达MYB提高了AGS细胞中OCT4、NANOG、SOX2的表达,而MYB和CTSF同时过表达使AGS细胞中OCT4、NANOG、SOX2的表达回复到对照组水平(P < 0.05)。此外,过表达MYB显著提高AGS细胞中谷氨酰胺、谷氨酸和α-KG含量、NADPH/NADP+比值、GSH/GSSG比值以及Asp和OAA的水平,而MYB和CTSF同时过表达逆转了过表达MYB的促进作用(P < 0.05,表 2)。Western blotting结果(图 5E)显示,过表达MYB促进了SLC1A5蛋白表达,而MYB和CTSF同时过表达减弱了过表达MYB对SLC1A5蛋白表达的促进作用。
| Item | oe-NC+oe-NC group(n = 3) | oe-MYB+oe-NC group(n = 3) | oe-MYB+oe-CTSF group(n = 3) |
| Relative CTSF expression | 1.00±0.12 | 0.43±0.051) | 0.94±0.102) |
| Number of colonies | 200.00±15.19 | 342.39±25.761) | 212.89±19.002) |
| Sphere number | 42.22±4.80 | 80.44±5.411) | 47.44±4.052) |
| Relative glutamine level | 1.00±0.11 | 2.25±0.201) | 1.10±0.122) |
| Relative glutamic acid level | 1.00±0.10 | 2.37±0.201) | 1.16±0.102) |
| Relative α-KG level | 1.00±0.10 | 2.15±0.211) | 1.23±0.112) |
| Relative NADPH/NADP+ level | 1.00±0.09 | 2.32±0.341) | 1.12±0.012) |
| Relative GSH/GSSG level | 1.00±0.09 | 2.31±0.291) | 1.20±0.222) |
| Relative Asp level | 1.00±0.11 | 1.89±0.311) | 1.13±0.212) |
| Relative OAA level | 1.00±0.18 | 1.78±0.411) | 1.12±0.272) |
| 1)P < 0.05 vs. oe-NC+oe-NC group;2)P < 0.05 vs. oe-MYB+oe-NC group. | |||

|
| A, cell viability; B, colony formation (×4);C, cell spheroidal ability (×40);D, OCT4, NANOG, and SOX2 expression; E, SLC1A5 expression. * P < 0.05 vs. oe-NC+oe-NC group; # P < 0.05 vs. oe-MYB+oe-NC group. 图 5 MYB/CTSF通过谷氨酰胺代谢影响胃癌细胞增殖和干性 Fig.5 MYB/CTSF affects the proliferation and stemness of gastric cancer cells through glutamine metabolism |
3 讨论
胃癌是一种常见的消化道肿瘤,尽管目前的治疗手段不断改进,但晚期胃癌患者的5年生存率约为20%[6]。胃癌的发生和发展是一个多因素、多阶段的过程。因此,进一步了解致癌过程中基因表达的变化,特别是识别用于癌症诊断的新的生物标志物和新的治疗靶点,将改善胃癌的诊断、治疗和预防。
研究[7]报道,CTSF在某些恶性肿瘤中差异表达,表明该基因在人类恶性肿瘤中发挥独特的作用。本研究发现,胃癌组织和细胞中CTSF显著下调。SONG等[8]发现,与正常组织相比,CTSF在非小细胞肺癌患者的肿瘤组织中下调,高表达CTSF与非小细胞肺癌患者的良好预后相关。此外,ZHENG等[9]发现,CTSF在胃癌细胞中表达下调,lncRNA LINC00982通过与转录因子HEY1结合,上调表达,从而抑制胃癌细胞的增殖、迁移和侵袭。本研究结果与此一致,本研究发现,敲低CTSF可以促进胃癌细胞增殖和干性,而过表达CTSF可以抑制胃癌细胞增殖和干性。这些结果表明,CTSF在肿瘤进展中发挥肿瘤抑制因子的作用,提示CTSF可能是胃癌治疗的有效靶点。
本研究还发现,CTSF参与调控谷氨酰胺代谢。许多研究表明,癌细胞代谢与正常细胞不同,癌细胞重新编程了新陈代谢,以满足其快速增殖对物质和能量的大量需求。许多代谢途径在癌症中出现重编程,包括糖酵解、谷氨酰胺代谢、三羧酸循环、电子转运链和磷酸戊糖途径。自从发现Warburg效应以来,越来越多的研究证明癌细胞的代谢在肿瘤的存活和生长中起至关重要的作用,而谷氨酰胺代谢在肿瘤代谢中的作用也被广泛研究。研究[10]报道,SNAT2/SLC38A2通过调节谷氨酰胺水平,增强GS细胞的干细胞特性。在肝细胞癌中,抑制谷氨酰胺酶1通过增加活性氧积累和抑制Wnt/β-catenin通路来减弱肝细胞癌的干细胞特性[11]。本研究发现,敲低CTSF可以促进胃癌细胞中谷氨酰胺、谷氨酸和α-KG含量增加。本研究还通过谷氨酰胺代谢抑制剂GPNA证实了敲低CTSF可以抑制谷氨酰胺代谢途径,进而促进胃癌细胞增殖和干性。以上结果表明,靶向谷氨酰胺代谢可能是肿瘤治疗的一种有效策略。
本研究发现,MYB是CTSF的上游转录因子。在人类中,MYB基因家族由3个成员(MYB、MYBL1和MYBL2)组成,分别编码转录因子MYB、MYBL1和MYBL2[12]。MYB蛋白由c‐MYB编码,c‐MYB是v‐MYB禽成髓细胞瘤病毒致癌基因的同源物,不仅与造血系统恶性肿瘤有关,还与一些人类实体肿瘤的发生和维持有关。如c-Myb是Wnt/β-catenin信号传导的激活剂,它通过Wnt/β-catenin/Axin2途径增强乳腺癌的侵袭和转移[13]。c-Myb通过c-FOS诱导上皮-间质转化,促进结直肠癌的生长和转移[14]。此外,MYB与癌细胞耐药密切相关。c-MYB在乳腺癌他莫昔芬耐药细胞中上调,过表达c-MYB促进上皮-间质转化,并显著增加对他莫昔芬的耐药性[15]。本研究结果证实,MYB在胃癌组织和细胞中高表达,发挥促癌作用;过表达MYB可以促进胃癌细胞增殖和细胞干性;过表达MYB可以提高胃癌细胞内谷氨酰胺、谷氨酸和α-KG含量;MYB通过激活CTSF转录,促进胃癌细胞中谷氨酰胺代谢途径,进而促进胃癌细胞的增殖和干性。本研究结果提示,MYB/CTSF轴可能作为胃癌治疗的潜在治疗靶点。
综上所述,本研究首次阐明了MYB激活CTSF促进胃癌细胞增殖和干性的分子机制。本研究证实了MYB/CTSF轴通过激活谷氨酰胺代谢途径,在胃癌细胞增殖和干性中发挥促进作用。但本研究未通过动物体内实验验证MYB/CTSF轴对胃癌生长的影响,未来的研究将对此进行充分验证。此外,后续研究将收集胃癌相关的临床样本,从临床水平进行深入的探讨。
| [1] |
TIAN S, PENG P, LI J, et al. SERPINH1 regulates EMT and gastric cancer metastasis via the Wnt/β-catenin signaling pathway[J]. Aging(Albany NY), 2020, 12(4): 3574-3593. DOI:10.18632/aging.102831 |
| [2] |
KIM J, PARK C, KIM KH, et al. Single-cell analysis of gastric pre-cancerous and cancer lesions reveals cell lineage diversity and intratumoral heterogeneity[J]. NPJ Precis Oncol, 2022, 6(1): 9. DOI:10.1038/s41698-022-00251-1 |
| [3] |
WANG W, PAN H, REN F, et al. Targeting ASCT2-mediated glutamine metabolism inhibits proliferation and promotes apoptosis of pancreatic cancer cells[J]. Biosci Rep, 2022, 42(3): BBSR20212171. DOI:10.1042/BSR20212171 |
| [4] |
HE Z, GAO Y, LI T, et al. HepaCAM-PIK3CA axis regulates the reprogramming of glutamine metabolism to inhibit prostate cancer cell proliferation[J]. Int J Oncol, 2022, 60(4): 37. DOI:10.3892/ijo.2022.5327 |
| [5] |
JI C, ZHAO Y, KOU YW, et al. Cathepsin F knockdown induces proliferation and inhibits apoptosis in gastric cancer cells[J]. Oncol Res, 2018, 26(1): 83-93. DOI:10.3727/096504017X14928634401204 |
| [6] |
QI W, YANG Z, FENG Y, et al. Gli1 regulates stemness characteri-stics in gastric adenocarcinoma[J]. Diagn Pathol, 2020, 15(1): 60. DOI:10.1186/s13000-020-00949-5 |
| [7] |
DI ROSA M, SANFILIPPO C, LIBRA M, et al. Different pediatric brain tumors are associated with different gene expression profiling[J]. Acta Histochem, 2015, 117(4/5): 477-485. DOI:10.1016/j.acthis.2015.02.010 |
| [8] |
SONG L, WANG X, CHENG W, et al. Expression signature, prognosis value and immune characteristics of cathepsin F in non-small cell lung cancer identified by bioinformatics assessment[J]. BMC Pulm Med, 2021, 21(1): 420. DOI:10.1186/s12890-021-01796-w |
| [9] |
ZHENG L, CAO J, LIU L, et al. Long noncoding RNA LINC00982 upregulates CTSF expression to inhibit gastric cancer progression via the transcription factor HEY1[J]. Am J Physiol Gastrointest Liver Physiol, 2021, 320(5): G816-G828. DOI:10.1152/ajpgi.00209.2020 |
| [10] |
NIE K, CAI M. SNAT2/SLC38A2 confers the stemness of gastric cancer cells via regulating glutamine level[J]. Dig Dis Sci, 2022, 67(7): 2948-2956. DOI:10.1007/s10620-021-07110-2 |
| [11] |
LI B, CAO Y, MENG G, et al. Targeting glutaminase 1 attenuates stemness properties in hepatocellular carcinoma by increasing reactive oxygen species and suppressing Wnt/beta-catenin pathway[J]. EBioMedicine, 2019, 39: 239-254. DOI:10.1016/j.ebiom.2018.11.063 |
| [12] |
CICIRÒ Y, SALA A. MYB oncoproteins: emerging players and potential therapeutic targets in human cancer[J]. Oncogenesis, 2021, 10(2): 19. DOI:10.1038/s41389-021-00309-y |
| [13] |
LI Y, JIN K, VAN PELT GW, et al. C-Myb enhances breast cancer invasion and metastasis through the Wnt/β-catenin/Axin2 pathway[J]. Cancer Res, 2016, 76(11): 3364-3375. DOI:10.1158/0008-5472.CAN-15-2302 |
| [14] |
QU X, YAN X, KONG C, et al. C-Myb promotes growth and metastasis of colorectal cancer through c-fos-induced epithelial-mesenchymal transition[J]. Cancer Sci, 2019, 110(10): 3183-3196. DOI:10.1111/cas.14141 |
| [15] |
GAO Y, ZHANG W, LIU C, et al. miR-200 affects tamoxifen resis-tance in breast cancer cells through regulation of MYB[J]. Sci Rep, 2019, 9(1): 18844. DOI:10.1038/s41598-019-54289-6 |
 2024, Vol. 53
2024, Vol. 53