文章信息
- 丁园艺, 魏鑫, 富威, 王萍萍, 张贺洋, 王玥
- 慢性髓细胞白血病伴BCR: : ABL1 e6a2转录本1例并文献复习
- Chronic myeloid leukemia with BCR: : ABL1 e6a2 fusion transcript: a case report and literature review
- 中国医科大学学报, 2024, 53(4): 367-369
- Journal of China Medical University, 2024, 53(4): 367-369
-
文章历史
- 收稿日期:2023-12-12
- 网络出版时间:2024-04-11 08:59:15
慢性髓细胞白血病(chronic myeloid leukemia,CML)是一种骨髓增殖性肿瘤,表现为成熟和未成熟的粒细胞生成和增殖失控,细胞分化大体正常。CML在我国的发病率为0.36/10万~0.55/10万,几乎所有CML都存在BCR: : ABL1,而CML伴BCR: : ABL1非典型转录本在临床发病率不到2%[1]。本文报道我科门诊诊治的1例CML伴BCR: : ABL1 e6a2转录本患者的临床特征、实验室检查和诊治经过,并进行相关文献复习。患者知情同意并签署同意书。
1 临床资料 1.1 一般情况患者,女,53岁,以“白细胞升高20 d”为主诉,于2023年8月8日就诊于中国医科大学附属第一医院血液科门诊。20 d前体检时发现白细胞升高,复查血常规提示:白细胞19.32×109/L,血红蛋白137 g/L,血小板448×109/L,嗜碱性粒细胞1.26×109/L。外周血分类计数:嗜碱性粒细胞8.4%。全腹CT检查提示:轻度脂肪肝,肝脏形态大小未见明显异常,脾不大。患者无乏力,无头晕头痛,无恶心呕吐,无腹痛腹胀及食欲不振等消化道症状,无发热及盗汗,近期无明显体重下降。既往病史:诊断间质性肺炎5年,无长期口服药物,否认高血压、冠状动脉粥样硬化性心脏病等遗传病史。2021年10月26日因间质性肺炎就诊,血常规提示:白细胞15.3×109/L,血红蛋白136 g/L,血小板424×109/L,嗜碱性粒细胞0.73×109/L,未行进一步诊治。
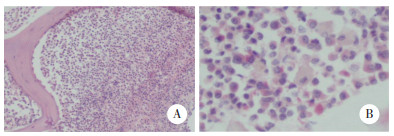
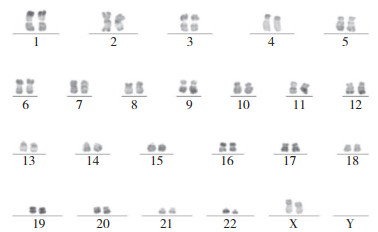
1.2 临床检查和诊断体格检查:无贫血貌,无黄疸,未触及肝脾大及浅表淋巴结大。辅助检查:骨髓活检(图 1)提示,骨髓增生极度活跃(> 90%),粒红比例明显增大,粒系各阶段细胞可见,以中幼及以下阶段细胞为主;少量红系以中晚幼红细胞为主;巨核细胞不少,大部分为胞体小、分叶少巨核细胞;淋巴细胞散在分布,形态成熟。网状纤维染色MF-0。形态学考虑CML。染色体检查(图 2)提示:46,XX,t(9,22)(q34;q11)[20]。骨髓增殖性疾病基因检测提示:JAK2 V617F,JAK2外显子12,MPL外显子10及CALR外显子9均为野生型。白血病融合基因检测提示:BCR: : ABL1 p210,p230阴性,p190 1.05%。进一步完善罕见型BCR: : ABL1筛查提示:BCR: : ABL1 e6a2 25.64阳性。综合该患者体征及实验室检查,诊断为CML慢性期伴BCR: : ABL1 e6a2(p195),ELTS评分低危。
|
| A,×100;B,×400. 图 1 骨髓活检HE染色结果 |
|
| 图 2 染色体检查结果 |
1.3 治疗
建议患者口服氟马替尼(600 mg/d)。2023年11月14日复查血常规提示:白细胞4.39×109/L,血红蛋白124 g/L,血小板92×109/L,嗜碱性粒细胞0.03×109/L。外周血分类计数:嗜碱性粒细胞3.0%。目前治疗效果良好,达到完全血液学反应,继续监测细胞遗传学及分子学反应。
2 讨论CML的特征是费城染色体(Ph染色体)与BCR: : ABL1形成。Ph染色体是9号染色体和22号染色体长臂各有一段发生断裂和易位,即t(9;22)(q34;q11),形成BCR: : ABL1[2]。其编码的BCR: : ABL1蛋白与细胞质的底物相互作用,激活异常通路,从而导致蛋白激酶活性增强、细胞凋亡减少及恶性转化[3]。
根据BCR基因断裂位点不同,分为主要断裂点簇集区(major BCR,M-BCR)、次要断裂点簇集区(minor BCR,m-BCR)、微小断裂点簇集区(micro BCR,μ-BCR)。90%CML的BCR基因断裂发生在M-BCR,与ABL基因断点外显子2融合,形成e13a2或e14a2,编码p210融合蛋白[2],为典型转录本。非典型转录本占比少,e1a2、e19a2、e13a3和e14a3相对常见,而e8a2,e6a2更加少见,称为罕见转录本[4]。也有病例报道同时存在两个或多个BCR: : ABL1转录本,推测是选择性剪接或表型变异的结果[5-6]。
CML伴BCR: : ABL1非典型转录本特别是罕见转录本发病率低,关于其临床特征、治疗与预后的研究少,需进一步扩大样本研究[7-9]。本例患者初诊时无发热、盗汗及体重下降,亦无肝脾及淋巴结肿大,并非CML的典型表现。提示临床高度怀疑CML的病例,即使常规BCR: : ABL1筛查阴性,仍有必要行罕见BCR: : ABL1筛查,常规BCR: : ABL1筛查无法检测到上述簇集区之外的非典型断点[10-13]。由于整个外显子间的剪接、小序列插入或外显子内基因断点,产生具有致癌潜力的蛋白质。本例患者从发现血常规异常到CML确诊病程长达3年,病情进展缓慢,与文献[14]报道的e6a2与疾病侵袭性相关的结论并不相符。
二代酪氨酸激酶抑制剂是CML伴e13a2、e1a2与e19a2转录本患者的首选一线治疗方案。而CML伴BCR: : ABL1 e6a2转录本病例的治疗尚无定论,MANZELLA等[14]报道1例CML伴BCR: : ABL1 e6a2患者使用二代酪氨酸激酶抑制剂尼罗替尼治疗效果良好。本文报道的患者应用氟马替尼治疗,获得完全血液学反应,与既往报道[14]一致,但患者治疗时间短,需持续监测后续治疗效果。有研究[7]显示患者在治疗过程中转录本发生改变,但两种不同的BCR: : ABL1转录本是否由同一克隆表达(通过替代剪接机制)或代表存在两种不同细胞尚不明确。因此,诊断初期明确转录本类型,有助于监测治疗效果,及时发现疾病转化。目前,针对CML伴BCR: : ABL1 e6a2转录本病例的诊治局限于个案报道,有待于丰富样本,以验证该转录本与疾病侵袭的真正相关性。
关于CML伴BCR: : ABL1 e6a2转录本预后不良的机制尚不明确,SCHULTHEIS等[15]发现其产生一种罕见的185×103融合蛋白,推测该融合蛋白中缺乏重要的调节性BCR序列,导致该类型CML预后差,并且发生早期转化。另外,研究[15]发现BCR: : ABL1 e6a2转录本通常发生在鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factor,GEF)/DBL样结构域中,GEF结构域与鸟嘌呤核苷酸结合蛋白相互作用,参与细胞生长和信号传导。它的截断可能具有转化作用,增强BCR: : ABL1的致癌潜力。ZHANG等[16]通过全外显子测序发现TP53BP2和CDH10基因突变与CML伴BCR: : ABL1 e8a2的相关性,并推断Src激活是BCR: : ABL1驱动信号传导的关键点,而TP53BP2或CDH10位于Src激酶下游。提示对于CML伴BCR: : ABL1 e6a2转录本病例,在给予药物治疗前应尽可能完善髓系白血病相关基因全外显子检测,有助于发现未知的BCR: : ABL1驱动突变,提高对CML伴BCR: : ABL1罕见转录本这类疾病机制的认知。
综上所述,CML伴BCR: : ABL1 e6a2初诊患者的症状及体征可能不典型,需与BCR: : ABL1阴性骨髓增殖性肿瘤(myeloproliferative neoplasms,MPN)进行鉴别。临床高度怀疑CML,行罕见BCR: : ABL1筛查是必要的。并且CML伴BCR: : ABL1非典型转录本病例初诊时需要明确转录本类型,以协助诊断、指导药物选择与治疗效果监测。治疗前尽可能完善髓系白血病相关基因的全外显子检测,探索CML伴BCR: : ABL1非典型转录本这类病例的未知驱动突变。未来将丰富CML伴BCR: : ABL1 e6a2病例,进行深入探索。
| [1] |
BURMEISTER T, BULLINGER L, LE COUTRE P. The recurrent atypical e8a2 BCR: abl1 transcript with insertion of an inverted 55 base pair ABL1 intron 1b sequence: a detailed molecular analysis[J]. Acta Haematol, 2023, 146(5): 413-418. DOI:10.1159/000531128 |
| [2] |
ZENEBE B, NIGUSSIE H, BELAY G, et al. A review on characterization of BCR-ABL transcript variants for molecular monitoring of chronic myeloid leukemia phenotypes[J]. Hematology, 2023, 28(1): 2284038. DOI:10.1080/16078454.2023.2284038 |
| [3] |
BAVARO L, MARTELLI M, CAVO M, et al. Mechanisms of disease progression and resistance to tyrosine kinase inhibitor therapy in chronic myeloid leukemia: an update[J]. Int J Mol Sci, 2019, 20(24): 6141. DOI:10.3390/ijms20246141 |
| [4] |
BACCARANI M, CASTAGNETTI F, GUGLIOTTA G, et al. The proportion of different BCR-ABL1 transcript types in chronic myeloid leukemia. An international overview[J]. Leukemia, 2019, 33(5): 1173-1183. DOI:10.1038/s41375-018-0341-4 |
| [5] |
AGIRRE X, ROMÁN-GÓMEZ J, VÁZQUEZ I, et al. Coexistence of different clonal populations harboring the b3a2 (p210) and e1a2 (p190) BCR-ABL1 fusion transcripts in chronic myelogenous leukemia resistant to imatinib[J]. Cancer Genet Cytogenet, 2005, 160(1): 22-26. DOI:10.1016/j.cancergencyto.2004.11.010 |
| [6] |
STELLA S, MASSIMINO M, TIRRÒ E, et al. B-ALL relapses after autologous stem cell transplantation associated with a shift from e1a2 to e14a2 BCR-ABL transcripts: a case report[J]. Anticancer Res, 2019, 39(1): 431-435. DOI:10.21873/anticanres.13130 |
| [7] |
STELLA S, MASSIMINO M, TIRRò E, et al. Detection and clinical implications of a novel BCR-ABL1 E12A2 insertion/deletion in a CML patient expressing the E13A2 isoform[J]. Anticancer Res, 2019, 39(12): 6965-6971. DOI:10.21873/anticanres.13918 |
| [8] |
LANGABEER SE. Is the BCR-ABL1 transcript type in chronic mye-loid leukaemia relevant?[J]. Med Oncol, 2013, 30(2): 508. DOI:10.1007/s12032-013-0508-9 |
| [9] |
刘贞佑, 史玉叶, 王春玲. 不同BCR-ABL融合基因转录本慢性髓细胞白血病患者的临床特征及预后研究进展[J]. 国际输血及血液学杂志, 2020, 43(2): 165-169. DOI:10.3760/cma.j.cn511693-20190909-00138 |
| [10] |
JINAWATH N, NORRIS-KIRBY A, SMITH BD, et al. A rare e14a3 (b3a3) BCR-ABL fusion transcript in chronic myeloid leukemia: diagnostic challenges in clinical laboratory practice[J]. J Mol Diagn, 2009, 11(4): 359-363. DOI:10.2353/jmoldx.2009.090008 |
| [11] |
MASSIMINO M, STELLA S, TIRRò E, et al. Efficacy of dasatinib in a very elderly CML patient expressing a rare E13a3 Bcr-Abl1 fusion transcript: a case report[J]. Anticancer Res, 2019, 39(7): 3949-3954. DOI:10.21873/anticanres.13548 |
| [12] |
TONG YQ, ZHAO ZJ, LIU B, et al. New rapid method to detect BCR-ABL fusion genes with multiplex RT-qPCR in one-tube at a time[J]. Leuk Res, 2018, 69: 47-53. DOI:10.1016/j.leukres.2018.04.001 |
| [13] |
QIN YZ, JIANG Q, JIANG H, et al. Prevalence and outcomes of uncommon BCR-ABL1 fusion transcripts in patients with chronic mye-loid leukaemia: data from a single centre[J]. Br J Haematol, 2018, 182(5): 693-700. DOI:10.1111/bjh.15453 |
| [14] |
MANZELLA L, TIRRÒ E, VITALE SR, et al. Optimal response in a patient with CML expressing BCR-ABL1 E6A2 fusion transcript with nilotinib therapy: a case report[J]. In Vivo, 2020, 34(3): 1481-1486. DOI:10.21873/invivo.11933 |
| [15] |
SCHULTHEIS B, WANG L, CLARK RE, et al. BCR-ABL with an e6a2 fusion in a CML patient diagnosed in blast crisis[J]. Leukemia, 2003, 17(10): 2054-2055. DOI:10.1038/sj.leu.2403079 |
| [16] |
ZHANG Y, CHENG Z, YAN WZ, et al. Molecular characterization and therapeutic reaction to dasatinib in a CML patient harboring a novel e8a2 BCR-ABL1 transcript with a somatic mutation in TP53BP2 and cadherin-10 genes[J]. Leuk Lymphoma, 2018, 59(1): 233-236. DOI:10.1080/10428194.2017.1323269 |
 2024, Vol. 53
2024, Vol. 53