文章信息
- 唐国强, 胡惠, 曾涌
- TANG Guoqiang, HU Hui, ZENG Yong
- 血清Toll样受体9与创伤致脓毒症患者预后的关系
- Relationship between serum toll-like receptor 9 level and prognosis of patients with sepsis caused by trauma
- 中国医科大学学报, 2024, 53(4): 337-341
- Journal of China Medical University, 2024, 53(4): 337-341
-
文章历史
- 收稿日期:2022-12-06
- 网络出版时间:2024-04-10 20:58:01
2. 重庆大学附属中心医院,重庆市急救医疗中心创伤科,重庆 400014
2. Department of Trauma, Chongqing Emergency Medical Center, Chongqing University Central Hospital, Chongqing 400014, China
创伤是全球范围内引起青壮年死亡的主要原因,住院创伤患者多死于脓毒症或多器官衰竭 [1]。早期预测临床结局有助于后续干预和治疗,降低患者病死率,但是目前对创伤所致脓毒症的研究较少,缺乏可靠的生物标志物[2]。脓毒症是宿主对感染免疫失调引发的不可控制的全身炎症反应综合征[3],Toll样受体9(Toll-like receptor 9,TLR9)是先天免疫系统的组成部分,可识别多种病原体并通过产生肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1、IL-6等促炎性细胞因子来激活宿主免疫反应[4]。本研究拟探讨创伤所致脓毒症患者血清TLR9水平与预后的关系,旨在为临床预后评估提供参考。
1 材料与方法 1.1 临床资料选取2020年8月至2022年8月重庆市急救医疗中心收治的261例创伤患者(创伤组)。其中,颅脑损伤68例,胸腹部损伤80例,骨折101例,多发伤12例。纳入标准:(1)有明确外伤史;(2)由急诊120救治入院;(3)年龄 > 18周岁。排除标准:(1)心肺复苏术后;(2)合并严重感染、中毒、烧伤等;(3)既往脓毒症病史;(4)患有自身免疫疾病、血液系统疾病或近期服用免疫抑制剂;(5)妊娠或哺乳期女性;(6)严重肝肾功能损伤。创伤组中,53例患者入院后发生脓毒症(脓毒症组)。208例未发生脓毒症(无脓毒症组)。脓毒症参考《中国脓毒症/脓毒性休克急诊治疗指南(2018)》诊断标准[5]。另选择同期我院门诊的63例体检志愿者作为对照组。受试者均知情同意并签署同意书,本研究获得重庆市急救医疗中心伦理委员会批准。
1.2 实验室检查 1.2.1 仪器与试剂ST-360化学发光免疫分析仪(上海科华公司),DxC 800全自动生化仪系统(美国贝克曼库尔特公司),ABBOTT CELL-DYN Ruby五分类全自动血细胞分析仪(美国雅培公司),DxFlEX流式细胞仪,TLR9试剂盒(上海酶联生物有限公司)。
1.2.2 实验室检查创伤组患者入院1 h(T0)、3 h(T1)、6 h(T2)、12 h(T3)、24 h(T4)、48 h(T5)、72 h(T6)(对照组体检当日)采集静脉血3 mL,运用化学发光法酶联免疫吸附试验测定血清TLR9水平。速率散射免疫比浊法检测血清C反应蛋白(C-reactive protein,CRP)、总胆红素、白蛋白、前白蛋白、尿素氮、血肌酐水平,全自动血细胞分析仪检测白细胞计数。流式法检测CD3+细胞、CD4+细胞和CD8+细胞占比。
1.3 院内结局与临床资料收集记录脓毒症组患者院内生存情况,并将其再分为生存组和死亡组。收集年龄、性别、体重指数、是否发生脓毒症休克、基线中心静脉压(central venous pressure,CVP)、基线平均动脉压(mean arterial pressure,MAP)、合并急性肾损伤、机械通气、肾脏替代治疗、急性生理与慢性健康评估Ⅱ(acute physiological and chronic health evaluation,APACHEⅡ)评分[6]、序贯器官衰竭评估(sequential organ failure assessment,SOFA)评分[7]、损伤严重程度评分(injury severity score,ISS)[8]以及实验室指标。
1.4 统计学分析采用SPSS 23.0软件进行统计分析。正态计量资料以x±s表示,组间比较采用t检验,不同时间点比较采用重复测量分析。计数资料以率(%)表示,采用χ2检验。采用非条件logistic回归进行多因素分析。采用受试者操作特征(receiver operation characteristic,ROC)曲线分析TLR9对创伤所致脓毒症患者院内死亡的预测价值。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料比较创伤组和对照组在年龄、性别、体重指数、吸烟史、饮酒史等方面,均无统计学差异(P > 0.05),见表 1。
| Item | Control group(n = 63) | Trauma group(n = 261) | χ2/t | P |
| Sex(male/female) | 27/36 | 109/152 | 0.025 | 0.874 |
| Age(year) | 35.11±3.02 | 35.24±3.85 | 0.290 | 0.773 |
| Body mass index(kg/m2) | 24.09±1.29 | 24.35±1.02 | 1.491 | 0.140 |
| Smoking history [n(%)] | 21(33.33) | 66(25.29) | 1.673 | 0.196 |
| Drinking history [n(%)] | 23(36.51) | 75(28.74) | 1.453 | 0.228 |
2.2 3组血清TLR9水平比较
脓毒症组和无脓毒症组T0时血清TLR9水平均高于对照组(P < 0.05),脓毒症组和无脓毒症组T0时血清TLR9水平差异无统计学意义(P > 0.05)。脓毒症组和无脓毒症组入院后血清TLR9水平升高,差异有统计学意义(P < 0.05),脓毒症组血清TLR9水平呈持续增高趋势,无脓毒症组T1~T4时增高,于T5~T6时降低(P < 0.05)。脓毒症组T1~T6血清TLR9水平均高于无脓毒症组(P < 0.05),见表 2。
| Time | Control group(n = 63) | No sepsis group(n = 208) | Sepsis group(n = 53) |
| T0 | 0.65±0.09 | 0.86±0.121) | 0.90±0.261) |
| T1 | - | 0.90±0.162) | 1.35±0.292),3) |
| T2 | - | 0.96±0.182) | 1.65±0.392),3) |
| T3 | - | 1.02±0.362) | 2.05±0.492),3) |
| T4 | - | 1.32±0.392) | 2.53±0.572),3) |
| T5 | - | 1.20±0.262) | 2.81±0.692),3) |
| T6 | - | 1.15±0.202) | 3.02±0.232),3) |
| 1)compared with control group,P < 0.05;2)compared with T0 time point in each group,P < 0.05;3)compared with no sepsis group,P < 0.05. | |||
2.3 死亡组和生存组血清TLR9水平比较
脓毒症组患者死亡20例,2组血清TLR9水平呈持续增高趋势,生存组于T4~T6时增长变慢(P < 0.05)。2组间存在交互效应(P < 0.05),死亡组T4~T6血清TLR9水平均高于生存组(P < 0.05),见表 3。
| Time | Survival group(n = 33) | Death group(n = 20) |
| T0 | 0.89±0.16 | 0.92±0.12 |
| T1 | 1.35±0.271) | 1.37±0.231) |
| T2 | 1.63±0.371) | 1.69±0.301) |
| T3 | 2.02±0.421) | 2.10±0.401) |
| T4 | 2.46±0.231) | 2.65±0.261),2) |
| T5 | 2.63±0.361) | 3.13±0.301),2) |
| T6 | 2.69±0.211) | 3.56±0.281),2) |
| 1)compared with T0 time point in each group,P < 0.05;2)compared with survival group,P < 0.05. | ||
2.4 创伤所致脓毒症患者院内死亡的因素分析
死亡组基线SOFA评分、基线ISS评分、基线APACHE Ⅱ评分、肾脏替代治疗比例、血肌酐、CRP高于生存组(P < 0.05),CD3+细胞占比、CD4+细胞占比低于生存组(P < 0.05),其他指标差异无统计学意义(P > 0.05),见表 4。构建logistic回归模型,结果显示,基线SOFA评分≥17分、T6时TLR9≥3 pg/mL是创伤所致脓毒症患者院内死亡的危险因素(P < 0.05),见表 5。
| Item | Death group(n = 20) | Survival group(n = 33) | t/χ2 | P |
| Age(year) | 35.24±6.85 | 34.19±6.73 | 0.547 | 0.587 |
| Sex [n(%)] | ||||
| Male | 15(75.00) | 24(72.73) | 0.033 | 0.856 |
| Female | 5(25.00) | 9(27.27) | ||
| Body mass index(kg/m2) | 24.35±3.02 | 24.11±3.17 | 0.272 | 0.787 |
| Trauma type [n(%)] | 0.029 | 0.999 | ||
| Craniocerebral injury | 5(25.00) | 8(24.24) | ||
| Chest and venter injuries | 6(30.00) | 10(30.30) | ||
| Fracture | 8(40.00) | 13(39.39) | ||
| Multiple injury | 1(5.00) | 2(6.06) | ||
| Baseline ISS score | 16.35±3.09 | 10.05±2.47 | 8.181 | < 0.001 |
| Baseline APACHE Ⅱ score | 24.15±5.24 | 19.02±3.74 | 4.152 | < 0.001 |
| Baseline SOFA Score | 19.21±2.09 | 15.01±1.81 | 7.723 | < 0.001 |
| Baseline CVP(cmH2O) | 10.05±2.03 | 9.42±2.11 | 1.069 | 0.290 |
| Baseline MVP(mmHg) | 72.13±6.59 | 73.09±6.81 | 0.503 | 0.617 |
| Septic shock | 6(30.00) | 15(45.45) | 1.243 | 0.265 |
| Acute kidney injury | 5(25.00) | 10(30.30) | 0.173 | 0.678 |
| Mechanical ventilation | 8(40.00) | 17(51.52) | 0.663 | 0.416 |
| Renal replacement therapy | 4(20.00) | 1(3.03) | 4.197 | 0.040 |
| White blood cell count(×109/L) | 11.53±2.03 | 10.92±2.41 | 0.956 | 0.349 |
| Total bilirubin(μmol/L) | 22.26±5.98 | 21.81±4.27 | 0.319 | 0.751 |
| Albumin(g/L) | 35.35±3.26 | 36.05±5.59 | 0.509 | 0.613 |
| Urea nitrogen(mmol/L) | 14.47±3.26 | 13.15±3.17 | 1.454 | 0.152 |
| Serum creatinine(μmol/L) | 101.26±15.26 | 92.35±10.08 | 2.563 | 0.013 |
| CRP(mg/L) | 24.35±2.03 | 19.65±2.71 | 6.692 | < 0.001 |
| CD3+ cell proportion(%) | 55.32±6.02 | 59.32±7.12 | 2.097 | 0.041 |
| CD4+ cell proportion(%) | 25.02±3.12 | 27.12±3.95 | 2.023 | 0.048 |
| CD8+ cell proportion(%) | 26.15±2.35 | 26.21±2.43 | 0.088 | 0.930 |
| Factor | β | SE | Wald χ2 | OR(95%CI) | P |
| Constant | 0.219 | 0.109 | 4.014 | - | 0.045 |
| Baseline SOFA score | 0.719 | 0.202 | 12.672 | 2.052(1.371-3.073) | < 0.001 |
| TLR9(T6) | 0.432 | 0.161 | 7.233 | 1.540(1.124-2.109) | < 0.001 |
2.5 血清TLR9预测创伤所致脓毒症患者院内死亡的价值分析
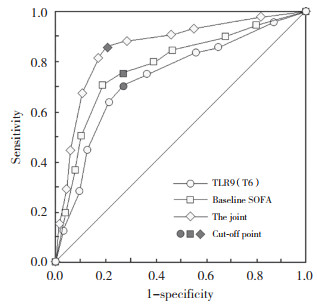
基线SOFA评分、T6时TLR9预测创伤所致脓毒症患者院内死亡的阈值分别为17分、3 pg/mL,灵敏度分别为75.00%、70.00%,特异度分别为72.70%、72.70%,曲线下面积分别为0.754、0.719。基于上述logistic回归结果,建立回归预测模型,联合基线SOFA评分、T6时TLR9预测创伤所致脓毒症患者院内死亡的曲线下面积为0.824,灵敏度、特异度分别为85.00%、78.80%,高于单独预测(Z = 3.125、2.956,P < 0.05),见图 1。
|
| 图 1 血清TLR9预测创伤所致脓毒症患者院内死亡的ROC图 Fig.1 ROC of serum TLR9 in predicting hospital death in patients with trauma-induced sepsis |
3 讨论
脓毒症是院内创伤患者死亡的主要原因,尽管早期液体复苏、敏感新型抗生素应用、器官支持等治疗手段不断改进,但是患者死亡率一直居高不下[9-10]。TLR9是病原体相关的模式识别受体,活化TLR9激活核因子-κB信号转导,参与免疫稳态维持,TLR9信号转导通路异常可导致自身免疫疾病和炎症疾病的发生[11]。研究[12]显示TLR9与线粒体DNA相互作用可激活NF-κB信号,上调TNF-α、IL-6、IL-1β等促炎性细胞因子表达,加剧炎症反应,TLR9还可通过激活NF-κB、信号转导子与转录激活子3和p38通路促使弥漫性大B细胞淋巴瘤进展[13],在缺血性急性肾损伤,肾近端小管TLR9通过激活核因子-κB和半胱天冬酶激活促进肾小管炎症、细胞凋亡和坏死[14],但是在急性心肌梗死中,TLR9可通过与其内源性配体-高迁移率族蛋白框1结合相互作用,促使心肌梗死后新生血管形成和心肌细胞存活,发挥保护心肌的作用[15]。
在细菌感染所致脓毒症小鼠模型中,中性粒细胞内TLR9与小窝蛋白-1快速结合激活髓样分化蛋白88 /肿瘤坏死因子受体相关因子-3/干扰素调节因子3信号通路,参与炎症预处理过程,在脓毒症中发挥保护作用[16]。TLR9在红细胞表达能结合来自细菌病原体DNA的CpG,促进炎症反应,激活先天免疫系统,抑制肺中性粒细胞浸润,减轻脓毒症和创伤引起的肺损伤。本研究结果发现脓毒症组血清TLR9水平明显高于无脓毒症组和对照组,脓毒症组入院后血清TLR9水平处于持续上升状态,而无脓毒症组血清TLR9水平在小幅上升后于T5~T6下降,说明创伤及其所致脓毒症均可引起外周血TLR9浓度增加,TLR9水平持续增加似乎诱导和加剧了创伤后脓毒症的发生和进展,但本研究结果与既往研究[16]结论相反。HU等[17]研究显示敲除TLR9表达可减弱p38活化以及蛋白激酶B磷酸化,降低炎性细胞因子水平和脓毒症小鼠死亡率,提示TLR9可能在脓毒症发病机制中发挥致病作用机制,支持本研究结论。生存分析发现死亡组入院后T4~T6血清TLR9水平高于生存组,回归分析显示T6 TLR9与创伤所致脓毒症患者院内死亡有关,T6 TLR9预测创伤所致脓毒症患者预后的价值与基线SOFA评分相近,提示入院72 h血清TLR9水平具有较高的预测创伤所致脓毒症患者预后的价值。
综上所述,创伤所致脓毒症患者血清TLR9水平显著增高,高水平TLR9与患者院内结局有关,检测入院72 h血清TLR9水平有助于评估患者预后。
| [1] |
LEE KW, CHOI SH, YOON YH, et al. Significance of biomarkers as a predictive factor for post-traumatic sepsis[J]. J Trauma Inj, 2018, 31(3): 166-173. DOI:10.20408/jti.2018.027 |
| [2] |
孙家莉, 邓志红, 杨传俊, 等. 创伤后脓毒症早期预测诊断的研究进展[J]. 实用医学杂志, 2019, 35(19): 3104-3108. DOI:10.3969/j.issn.1006-5725.2019.19.027 |
| [3] |
NAPOLITANO LM. Sepsis 2018: definitions and guideline changes[J]. Surg Infect, 2018, 19(2): 117-125. DOI:10.1089/sur.2017.278 |
| [4] |
MURAKAMI Y, ISHII T, NUNOKAWA H, et al. TLR9-IL-2 axis exacerbates allergic asthma by preventing IL-17A hyperproduction[J]. Sci Rep, 2020, 10(1): 18110. DOI:10.1038/s41598-020-75153-y |
| [5] |
中国医师协会急诊医师分会, 中国研究型医院学会休克与脓毒症专业委员会. 中国脓毒症/脓毒性休克急诊治疗指南(2018)[J]. 中国急救医学, 2018, 38(9): 741-756. DOI:10.3969/j.issn.1002-1949.2018.09.001 |
| [6] |
KNAUS WA, DRAPER EA, WAGNER DP, et al. APACHE Ⅱ: a severity of disease classification system[J]. Crit Care Med, 1985, 13(10): 818-829. |
| [7] |
FERREIRA FL, BOTA DP, BROSS A, et al. Serial evaluation of the SOFA score to predict outcome in critically ill patients[J]. JAMA, 2001, 286(14): 1754-1758. DOI:10.1001/jama.286.14.1754 |
| [8] |
朱国雄, 杨春济. 现代国际创伤评分分类法[J]. 实用医药杂志, 2003, 20(11): 869-871. DOI:10.3969/j.issn.1671-4008.2003.11.063 |
| [9] |
WILLIAMS AM, DENNAHY IS, BHATTI UF, et al. Histone deacetylase inhibitors: a novel strategy in trauma and sepsis[J]. Shock, 2019, 52(3): 300-306. DOI:10.1097/SHK.0000000000001308 |
| [10] |
向桂霖, 伍秋菊, 张安强. 创伤脓毒症早期预警诊断生物标志物的研究进展[J]. 创伤外科杂志, 2019, 21(1): 74-78. DOI:10.3969/j.issn.1009-4237.2019.01.021 |
| [11] |
NIE L, CAI SY, SHAO JZ, et al. Toll-like receptors, associated biological roles, and signaling networks in non-mammals[J]. Front Immunol, 2018, 9: 1523. DOI:10.3389/fimmu.2018.01523 |
| [12] |
RODRÍGUEZ-NUEVO A, DíAZ-RAMOS A, NOGUERA E, et al. Mitochondrial DNA and TLR9 drive muscle inflammation upon Opa1 deficiency[J]. EMBO J, 2018, 37(10): e96553. DOI:10.15252/embj.201796553 |
| [13] |
NIE M, YANG LB, BI XW, et al. Neutrophil extracellular traps induced by IL8 promote diffuse large B-cell lymphoma progression via the TLR9 signaling[J]. Clin Cancer Res, 2019, 25(6): 1867-1879. DOI:10.1158/1078-0432.CCR-18-1226 |
| [14] |
HAN SJ, LI HM, KIM M, et al. Kidney proximal tubular TLR9 exacerbates ischemic acute kidney injury[J]. J Immunol, 2018, 201(3): 1073-1085. DOI:10.4049/jimmunol.1800211 |
| [15] |
LIU FY, FAN D, YANG Z, et al. TLR9 is essential for HMGB1-mediated post-myocardial infarction tissue repair through affecting apoptosis, cardiac healing, and angiogenesis[J]. Cell Death Dis, 2019, 10(7): 480. DOI:10.1038/s41419-019-1718-7 |
| [16] |
YANG ZG, WANG LW, YU HM, et al. Membrane TLR9 positive neutrophil mediated MPLA protects against fatal bacterial sepsis[J]. Theranostics, 2019, 9(21): 6269-6283. DOI:10.7150/thno.37139 |
| [17] |
HU D, YANG XH, XIANG YX, et al. Inhibition of Toll-like receptor 9 attenuates sepsis-induced mortality through suppressing excessive inflammatory response[J]. Cell Immunol, 2015, 295(2): 92-98. DOI:10.1016/j.cellimm.2015.03.009 |
 2024, Vol. 53
2024, Vol. 53