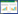文章信息
- 唐明政, 徐京灏, 李晓凤, 荣耀, 于博, 蔡辉
- TANG Mingzheng, XU Jinghao, LI Xiaofeng, RONG Yao, YU Bo, CAI Hui
- 基于失巢凋亡相关基因的乳腺癌预后模型构建与验证
- Construction and validation of breast cancer prognosis model based on anoikis-related genes
- 中国医科大学学报, 2024, 53(4): 315-323
- Journal of China Medical University, 2024, 53(4): 315-323
-
文章历史
- 收稿日期:2023-06-13
- 网络出版时间:2024-04-10 18:48:46
2. 甘肃省人民医院普外科临床医学中心,兰州 730000;
3. 甘肃省人民医院甘肃省外科肿瘤分子诊断与精准医学重点实验室,兰州 730000
2. Clinical Medical Center for General Surgery, Gansu Provincial Hospital, Lanzhou 730000, China;
3. Key Laboratory of Molecular Diagnostics and Precision Medicine for Surgical Oncology in Gansu Province, Gansu Provincial Hospital, Lanzhou 730000, China
乳腺癌(breast cancer,BC)是女性最常见的癌症之一[1]。近年来,BC的发病率不断上升。2020全球癌症统计数据显示,BC已经超过肺癌成为全球诊断最多的癌症[2]。尽管BC的治疗技术已取得一定的进步,但仍有30%~40%患者会出现复发和转移[3],且远处转移的患者预后较差。因此,寻找能够准确预测BC早期诊断和预后的生物标志有重要意义。
失巢凋亡是细胞程序性死亡的一种形式。当细胞与邻近的细胞外基质缺乏相互作用或黏附到不适当的位置时,细胞会发生失巢凋亡[4]。这一过程最初是在表皮和内皮细胞中发现,并被认为是与发育和稳态有关的一种生理过程。然而,越来越多的研究[5]表明,癌细胞以多种方式抵抗失巢凋亡。因此,失巢凋亡是生物体的一个重要防御机制,通过防止脱落细胞重新黏附到错误的位置来阻止错误的生长[4,6-7]。目前鲜有研究阐述失巢凋亡与BC之间的关系,尚无基于失巢凋亡的BC风险预测模型,无法全方位的反映失巢凋亡相关基因(anoikis-related genes,ARGs)对BC患者预后的影响。因此,本研究旨在通过ARGs开发一个预后评分模型,进一步探讨ARGs与免疫微环境、肿瘤微环境以及免疫应答的关系,并通过实验验证与预后相关的ARGs在BC细胞中的表达情况。评估ARGs在BC患者预后方面的价值,为新的潜在治疗策略、临床用药和抗肿瘤靶点提供依据,从而有助于临床治疗选择。
1 材料与方法 1.1 数据采集和ARGs基因的获取BC患者的转录组数据和临床组数据从癌症基因组图谱(https://portal.gdc.cancer.gov)下载。BC患者信息从基因表达综合数据库(https://www.ncbi.nlm.nih.gov/geo/)以“breast cancer survival”为关键字下载。ARGs基因数据从GeneCard数据库(https://www.gene-cards.org)和Harmonomeportals数据库(https://maayan-lab.cloud/Hharmonome/)下载,筛选标准:相关性 > 0.4,|log2FC| > 1,错误发现率 < 0.05和P < 0.05。使用R语言“limma”和“sva”软件包处理这4个数据库中转录组基质的批量效应。
1.2 GSVA分析下载“c2.cp.kegg.symbols.gmt”,随后用“GSVA”R语言软件包进行GSVA富集分析。通过R软件中的“clusterProfiler”包进行京都基因和基因组数据库(kyoto encyclopedia of genes and genomes,KEGG)分析。
1.3 共识聚类为了识别ARGs的不同模式,使用“consensusClusterPlus”算法进行聚类分析。根据K=2的最优分类,将BC患者分为2个不同的分子亚型进行进一步分析。随后用R包“ggplot2”验证聚类的可靠性。
1.4 风险评分预后模型的构建与验证采用随机森林和SVM-RFE算法来筛选特征基因,并通过十倍交叉验证确定惩罚正则化参数λ,确定相对重要性 > 0.25的基因为新的特征基因。然后使用LASSO回归分析选择P < 0.01的基因;接着通过LASSO回归的基因进行多因素Cox回归分析。最终基于最佳λ值和对应系数,选择10个ARGs构建风险评分。将所有样本随机划分为训练组和验证组,并使用ARGs风险评分中位数作为临界值将所有BC患者分为高、低风险组。使用R语言包“surviminer”和“ggrisk”生成受试者操作特征(receiver operating characteristic,ROC)曲线、ROC曲线下面积和Kaplan-Meier(K-M)生存曲线,以验证该模型的准确性和预测价值。
1.5 肿瘤免疫微环境分析采用R语言“CIBERSORT”和“ssGSEA”软件包测量高、低风险组中浸润免疫细胞的相对比例,并评估高、低风险组中各种免疫细胞类型的比例。同时,应用Spearman秩相关分析来探究风险评分与免疫浸润细胞之间的关系。
1.6 构建BC患者的预后列线图采用风险评分和临床信息(年龄、性别、分期等)构建列线图。采用决策曲线评价列线图的准确性。此外,使用R软件(4.2.1)“timeROC”包评估风险评级在预测BC患者1年、3年和5年总生存期(overall survival,OS)的准确性。
1.7 实时PCR人正常乳腺细胞MCF-10A和BC细胞MDA-MB-231由甘肃省人民医院外科肿瘤分子诊断与精准医学重点实验室提供与保存。用含有10%胎牛血清、100 μg/mL青霉素和100 μg/mL链霉素的RPMI-1640培养基,于37℃ 5%CO2培养箱中培养细胞。采用TRIzol法从细胞中分别提取总RNA,用反转录试剂盒将纯化的RNA反转录成cDNA模板,然后对目标基因进行实时PCR,最后用2-ΔΔCt法计算基因的相对表达量,并以GAPDH为内参。基因引物序列如表 1所示。所有引物均由生物工程(上海)有限公司设计和合成。
| Gene | 5’to 3’(F) | 5’to 3’(R) |
| PHLDA2 | GTTGGAGAAGCGCAGCGACAG | TCCACGCAGTCCACCTTGAGG |
| PIK3R1 | ACTGAAGCAGATGTTGAACAAC | CATCGATCATTTCCAAGTCCAC |
| SLC2A1 | TGTCTGGCATCAACGCTGTCTTC | CCTGCTCGCTCCACCACAAAC |
| BAK1 | AGAGATGGTCACCTTACCTCT | GGTCTGGAACTCTGAGTCATAG |
| EDA2R | CATCAATCGTGTTCAGAAGGTC | CTCCACTAAGCTCAACTGGAAG |
| YAP1 | GAACAATGACGACCAATAGCTC | TAGTCCACTGTCTGTACTCTCA |
| CD24 | AATCCAACTAATGCCACCACCAAGG | AGAGAGAGTGAGACCACGAAGAGAC |
| CDC25C | GACAGGTCTCTGAACCAGTATC | TCTGGAAAGAAGTCTCTGTAGC |
| SLC39A6 | CAGGAGTGTTTCAATGCATCAA | GCTGGACAGAGATAGTTGAACT |
| LAMB3 | GAGCCTGTGACTGTGATTTCC | GGTAGCGATTACAGTAGCCTC |
| GAPDH | GGAAGCTTGTCATCAATGGAAATC | TGATGACCCTTGGCTCCC |
1.8 统计学分析
所有基因数据均经过对数转换以实现归一化处理。采用随机森林、SVM-RFE算法和多因素Cox回归分析来筛选特征基因,采用Spearman相关分析探讨风险评分与免疫浸润细胞之间的关系,采用2-ΔΔCt法计算实时PCR的基因相对表达量。R语言包数据均使用R软件(版本4.2.1,www.R-project.org)进行可视化。P < 0.05为差异有统计学意义。
2 结果 2.1 ARGs的获取共获得640个ARGs,其中135个ARGs是差异基因(图 1A)。单因素Cox回归分析结果显示,135个差异表达基因(differential expression genes,DEGs)中有42个基因与预后相关(图 1B)。
|
| A, volcano plot of 135 DEGs; B, DEGs related to prognosis. 图 1 BC中ARGs的特征 Fig.1 Characteristics of ARGs in BC |
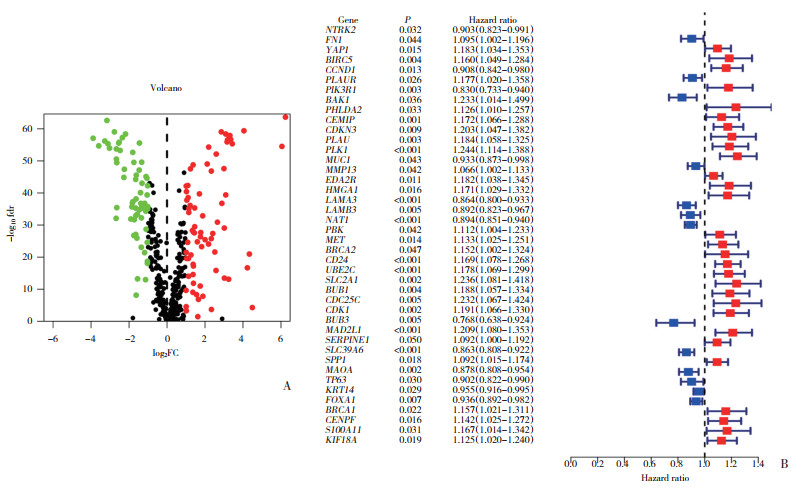
2.2 BC中42个ARGs的一致聚类(图 2)
|
| A, clustering of subtypes; B, prognosis based on classification. 图 2 与42个ARGs相关的BC亚型 Fig.2 BC subtypes associated with the 42 ARGs |
采用单因素Cox分析对42个ARGs进行共识聚类,当K=2时得到A、B 2个有效分型。这两个分型之间的预后存在统计学差异。
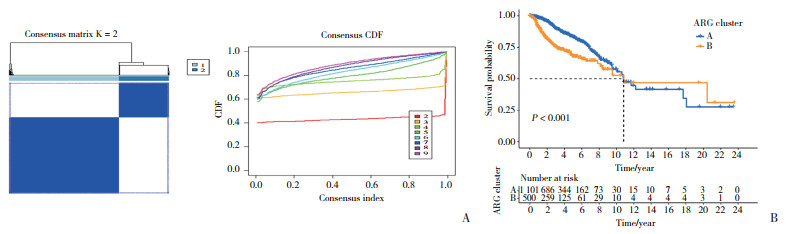
2.3 A、B分型中的免疫细胞浸润和差异基因表达免疫细胞浸润分析结果显示,2种分型的免疫细胞浸润水平的存在统计学差异。其中,肥大细胞、中性粒细胞和嗜酸性粒细胞在A分型中上调;而活化CD4的T细胞、活化CD8的T细胞在B分型中上调(图 3A)。BUB3、CCND1和SLC39A6等基因在A分型中上调;CD24、CDC25C和MAD2L1等基因在B分型中上调(图 3B)。且这些差异基因与通道抑制剂活性、细胞周期和移植与宿主疾病相关(图 3C)。
|
| A,expression of immune cells in both subtypes;B,expression of the 42 ARGs in clinicopathological features and subtypes;C,KEGG enrichment analysis. 图 3 A、B分型的特征 Fig.3 Characteristics of types A and B |
2.4 构建风险评分预后模型
采用42个ARGs进行Lasso回归得出10个独立的预后相关基因,其中CD24、PHLDA2、SLC2A1、YAP1、CDC25C和EDA2R为高风险基因,而SLC39A6、LAMB3、BAK1和PIK3R1为低风险基因(图 4A)。随后用这10个ARGs构建风险评分预后模型。将所有样本随机划分为训练组和验证组;风险评分中位值划分为高、低风险组。K-M生存曲线结果显示,在验证组中,高风险组患者的预后较差(图 4B)。桑基图显示了分型、风险值和生存状态之间的关系(图 4C)。
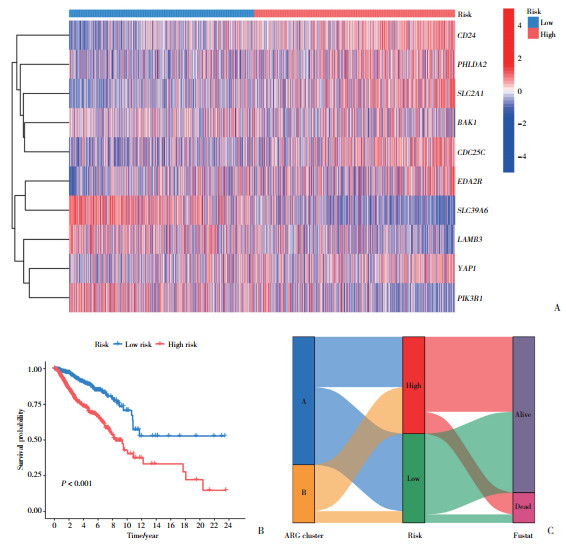
|
| A, risk heatmap of ten prognostic genes; B, prognosis of high-and low-risk groups; C, sang product plot. 图 4 识别ARGs相关的预后特征 Fig.4 Identifying prognostic features associated with ARGs |
2.5 基于风险评分的免疫分析
随着风险评分的增加,肥大细胞、NK细胞和巨噬细胞等浸润比例逐渐增加(图 5A)。用于构建风险评分的10个基因与许多免疫细胞存在紧密联系,尤其是SLC39A6和PIK3R1与肥大细胞的浸润高度密切相关(图 5B)。巨噬细胞在高风险组中表达较多(图 5C)。高风险组的患者免疫评分高于低风险组的患者(图 5D)。
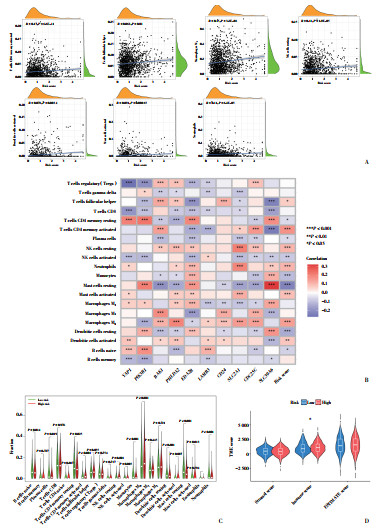
|
| A, correlation analysis between risk score and the proportion of individual immune cells; B, correlation of immune cells with the ten prognostic ARGs; C, differential expression of immune cells between high-risk and low-risk populations; D, matrix, immune, and ESTIMATE scores. 图 5 具有不同风险评分的BC组织的免疫微环境 Fig.5 Immune microenvironment of BC tissues with various risk scores |
2.6 BC患者的预后列线图
经过多因素Cox回归分析,确定了性别、年龄、T1、T2、N1、N2和风险评分为BC的独立预后因素,随后采用这些独立预后因素构建列线图(图 6A)。校准曲线表明,列线图预测OS与实际OS一致(图 6B)。ROC诊断曲线表明,列线图对BC患者的1年、3年、5年肿瘤预后有较好的预测能力(图 6C)。
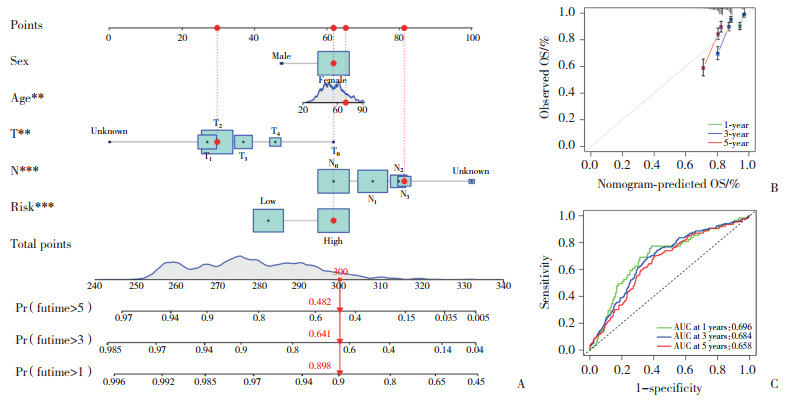
|
| A, nomogram; B, calibration curve; C, ROC curve. **P < 0.01, ***P < 0.001. 图 6 BC患者风险评分的预后价值 Fig.6 Prognostic value of risk score in patients with BC |
2.7 预后相关ARGs的验证
实时PCR验证预后相关ARGs的表达水平。结果显示,8个ARGs(YAP1、PIK3R1、BAK1、PHLDA2、EDA2R、CD24、SLC2A1和CDC25C)在BC细胞中为高表达;2个ARGs(SLC39A6和LAMB)在BC细胞中为低表达(图 7)。提示这些基因可能是与BC预后相关的重要生物标志物。
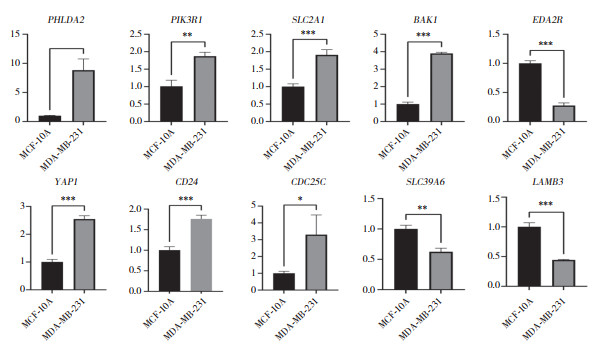
|
| MCF-10A, normal cell line; MDA-MB-231, breast cancer cell line. *P < 0.05, **P < 0.01, ***P < 0.001. 图 7 预后相关ARGs的实时PCR分析 Fig.7 Real time PCR analysis of prognosis-related ARGs |
3 讨论
在女性患者中,BC不仅是最常见的恶性肿瘤,还是癌症死亡的第二大原因[8]。尽管在手术、放化疗和其他治疗方面取得了突破,但BC患者的早期诊断率并没有显著提高。由于BC的异质性和缺乏持续反应的特点,BC患者的靶向治疗效果较差。识别和验证更为准确的生物标志物具有重大意义[9]。
当细胞没有细胞外基质附着时,整合素的附着就会破坏,细胞会发生失巢凋亡[10-11]。失巢凋亡可防止分离的上皮细胞沉淀到其他地方,对维持组织稳态和发育至关重要[10]。这种凋亡执行的失调正在成为癌细胞的标志,并导致其向远处器官转移[12]。
本研究基于公共数据库确认了BC中的特定ARGs。通过单因素、多因素Cox回归和LASSO回归分析,得到10个与预后相关的ARGs,并构建了预测性风险评分模型。并将年龄、分级和风险评分等临床病理因素构建列线图。校准图表明该模型对预测预后有很好的契合度。实时PCR验证结果显示,10个ARGs中YAP1、PIK3R1、BAK1、PHLDA2、EDA2R、CD24、SLC2A1、CDC25C和SLC39A6在BC细胞中高表达,SLC39A6和LAMB呈低表达。
为了评估ARGs与预后的关系,本研究构建了风险评分模型。在训练和验证队列中,ARGs准确地预测了BC的预后。具有高风险评分的临床变量往往也是预后高危险因素,风险评分可以作为独立预后指标。与先前研究[13-14]一致,同时存在风险评分的患者往往具有更高的肿瘤分级,更有可能存在高风险的不良预后。
为了研究ANGs相关的预后机制并提供预测免疫细胞浸润的线索,本研究比较了高风险组和低风险组在22个免疫细胞比例的差异。随着风险评分的增加,肥大细胞、NK细胞和巨噬细胞等浸润比例逐渐增加。先前研究[15]表明高表达的肥大细胞是独立的预后因素,尤其是在浸润性BC的管腔分子亚型中,提示肥大细胞在BC发展中发挥关键作用。在10个风险基因中,SLC39A6与肥大细胞的相关系数最高,因此SLC39A6可能与炎症过程或过敏反应有关。此外,本研究结果显示巨噬细胞在高风险组中表达较多,说明BC患者中免疫系统的活跃或炎症反应的增加。先前研究[16]也证实这一结果,在BC骨转移时,BMP信号通路能够激活独特的巨噬细胞表型。
本研究存在一定局限性:(1)当前研究中分析的所有BC病例的临床数据从公共数据库获得;(2)虽然这项研究表明ARGs与免疫之间存在联系,但详细的机制尚不清楚;(3)构建的模型是否有效,仍需大的临床样本量来验证。
综上所述,本研究发现与预后相关的10个ARGs可以很好地预测BC患者的生存率,为临床医生制定各种诊疗计划提供更扎实的理论依据。列线图可以帮助医生为BC患者提供个性化治疗,为精准医学提供新的方向。
| [1] |
SUNG H, FERLAY J, SIEGEL RL, et al. Global cancer statistics 2020: globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
SANTILLÁN-BENÍTEZ JG, MENDIETA-ZERÓN H, GÓMEZ-OLIVÁN LM, et al. JAK2, STAT3 and SOCS3 gene expression in women with and without breast cancer[J]. Gene, 2014, 547(1): 70-76. DOI:10.1016/j.gene.2014.06.025 |
| [3] |
GHISLAIN I, ZIKOS E, COENS C, et al. Health-related quality of life in locally advanced and metastatic breast cancer: methodological and clinical issues in randomised controlled trials[J]. Lancet Oncol, 2016, 17(7): e294-e304. DOI:10.1016/S1470-2045(16)30099-7 |
| [4] |
CHIARUGI P, GIANNONI E. Anoikis: a necessary death program for anchorage-dependent cells[J]. Biochem Pharmacol, 2008, 76(11): 1352-1364. DOI:10.1016/j.bcp.2008.07.023 |
| [5] |
KAKAVANDI E, SHAHBAHRAMI R, GOUDARZI H, et al. Anoikis resistance and oncoviruses[J]. J Cell Biochem, 2018, 119(3): 2484-2491. DOI:10.1002/jcb.26363 |
| [6] |
BOUDREAU NJ, JONES PL. Extracellular matrix and integrin signalling: the shape of things to come[J]. Biochem J, 1999, 339(Pt 3): 481-488. |
| [7] |
FRISCH SM, RUOSLAHTI E. Integrins and anoikis[J]. Curr Opin Cell Biol, 1997, 9(5): 701-706. DOI:10.1016/s0955-0674(97)80124-x |
| [8] |
RAJENDRAM P, SINGH P, HAN KT, et al. Barriers to breast cancer screening in Singapore: a literature review[J]. Ann Acad Med Singap, 2022, 51(8): 493-501. DOI:10.47102/annals-acadmedsg.2021329 |
| [9] |
KWON MJ. Predictive biomarkers for molecularly targeted therapies and immunotherapies in breast cancer[J]. Arch Pharm Res, 2022, 45(9): 597-617. DOI:10.1007/s12272-022-01402-5 |
| [10] |
BAKIR B, CHIARELLA AM, PITARRESI JR, et al. EMT, MET, plasticity, and tumor metastasis[J]. Trends Cell Biol, 2020, 30(10): 764-776. DOI:10.1016/j.tcb.2020.07.003 |
| [11] |
NIRMALA JG, LOPUS M. Cell death mechanisms in eukaryotes[J]. Cell Biol Toxicol, 2020, 36(2): 145-164. DOI:10.1007/s10565-019-09496-2 |
| [12] |
TADDEI ML, GIANNONI E, FIASCHI T, et al. Anoikis: an emerging hallmark in health and diseases[J]. J Pathol, 2012, 226(2): 380-393. DOI:10.1002/path.3000 |
| [13] |
CHIOCCA EA, YU JS, LUKAS RV, et al. Regulatable interleukin-12 gene therapy in patients with recurrent high-grade glioma: results of a phase 1 trial[J]. Sci Transl Med, 2019, 11(505): eaaw5680. DOI:10.1126/scitranslmed.aaw5680 |
| [14] |
BANGALORE YOGANANDA CG, SHAH BR, VEJDANI-JAHROMI M, et al. A novel fully automated MRI-based deep-learning method for classification of IDH mutation status in brain gliomas[J]. Neuro-oncology, 2020, 22(3): 402-411. DOI:10.1093/neuonc/noz199 |
| [15] |
OKCU O, ÖZTÜRK Ç, ŞEN B, et al. The prognostic significance of non-lymphoid immune cells of the tumor microenvironment, including neutrophils, eosinophils, and mast cells in breast carcinomas[J]. Ann Diagn Pathol, 2023, 65: 152151. DOI:10.1016/j.anndiagpath.2023.152151 |
| [16] |
IHLE CL, STRAIGN DM, CANARI JA, et al. Unique macrophage phenotypes activated by BMP signaling in breast cancer bone metastases[J]. JCI Insight, 2024, 9(1): e168517. DOI:10.1172/jci.insight.168517 |
 2024, Vol. 53
2024, Vol. 53