文章信息
- 李帅, 鲍龙, 郭闻师, 孙平
- LI Shuai, BAO Long, GUO Wenshi, SUN Ping
- 脑死亡供者外周血IL-6和IL-10对移植肾功能延迟恢复的预测作用
- Predictive values of IL-6 and IL-10 in the peripheral blood of donor of brain death for delayed graft function
- 中国医科大学学报, 2024, 53(2): 149-152
- Journal of China Medical University, 2024, 53(2): 149-152
-
文章历史
- 收稿日期:2023-06-13
- 网络出版时间:2024-01-10 16:25:04
2. 中国医科大学附属第一医院器官移植/肝胆外科, 沈阳 110001
2. Department of Organ Transplantation and Hepatobiliary Surgery, The First Hospital of China Medical University, Shenyang 110001, China
肾移植是终末期肾病的有效治疗方法之一,缺少肾源仍是限制肾移植开展的主要原因,因此目前临床上使用尸体供肾的比例明显上升[1]。但是尸体供肾对肾移植患者预后存在诸多不利的影响,其中较为常见的是移植肾功能延迟恢复(delayed graft function,DGF),DGF会影响受者的生存质量和生存时间[2]。影响DGF的因素较多,如供肾的冷缺血时间以及供者的血肌酐水平、体质量指数、年龄等,尤其是在尸体供者或者边缘供肾中,诸多影响因素导致DGF发病率较高,约为20%~50% [3-4]。除上述因素外,脑死亡供者还存在其他影响DGF的因素。脑死亡后,由于外周器官的循环减慢,白细胞堆积,细胞附着在血管内皮上并渗透在组织中,最终导致随着主要组织相容性抗原、黏附分子、细胞因子和其他急性时相蛋白大量增加,外周器官中的炎症介质迅速上调[5],从而影响肾移植后受者的早期和长期排斥反应。与活体供者相比,脑死亡供者的器官被移植到同种异体受者体内后,其功能丧失更快,从而更易出现DGF和急性排斥反应等不良预后[6]。已有研究[7]报道,白细胞介素(interleukin,IL)-6在肾移植术后急性排斥反应中具有诊断价值,并在排斥反应相关信号通路中起到重要作用。IL-10也是公认的炎症和免疫抑制因子[8],但是鲜有研究报道IL-10对肾移植术后DGF具有预测作用,并且目前研究尚未完全阐明脑死亡供者的免疫记忆会触发宿主免疫反应以及对移植肾功能恢复有延迟作用。因此,本研究通过回顾性分析接受脑死亡供者的肾脏后受者DGF的发生情况,探究脑死亡供者外周血IL-6和IL-10对受者发生DGF的预测价值。
1 材料与方法 1.1 研究对象收集2021年11月至2022年12月中国医科大学附属第一医院器官移植中心收治的21例脑死亡供者和42例肾移植受者的临床资料和血液样本。所有器官捐献者完全符合中国公民逝世后器官捐献标准;所有捐献工作均在辽宁省红十字会、中国医科大学附属第一医院积极配合下完成。本研究获得中国医科大学附属第一医院伦理委员会批准。
脑死亡标准为深度昏迷、脑干反射消失和无自主呼吸,并且满足以下任意2条标准:(1)脑电图显示电静息;(2)正中神经的短潜伏期体感诱发电位显示双侧N9和(或)N13存在,P14、N18和N20消失;(3)经颅多普勒超声显示颅内前循环和后循环血流呈振荡波、尖小收缩波或血流信号消失。
受者纳入标准:(1)终末期肾病且首次接受肾移植;(2)无自身免疫性疾病,未接受过免疫抑制治疗。受者排除标准:(1)移植过肾脏以外其他器官或非首次肾移植手术;(2)术后生存期 < 7 d。
1.2 样本采集和研究终点当供者被宣布脑死亡时,使用肝素采血管收集供者的外周动脉血样本。受者进行免疫抑制诱导前,使用肝素采血管收集肾移植受者的外周动脉血样本。使用ELISA试剂盒(南京建城生物工程研究所)检测人血清IL-6和IL-10。DGF定义为移植术后第1周需要进行透析治疗。
1.3 手术方法和免疫方案 1.3.1 手术方法首次同种异体肾移植均将移植肾置于右侧髂窝,血管吻合方式均采用将供肾动、静脉分别与受者髂外动、静脉端侧吻合的方式;输尿管膀胱吻合均采用隧道包埋吻合的方式;所有肾移植受者术中均留置输尿管支架管。
1.3.2 免疫方案肾移植受者手术当天免疫诱导方案为舒莱20 mg静脉注射或兔抗人胸腺免疫球蛋白50 mg静脉滴注,其中舒莱免疫诱导21例,兔抗人胸腺免疫球蛋白免疫诱导21例。术中均应用1 000 mg甲强龙静脉滴注,分别于兔抗人胸腺免疫球蛋白应用前和移植肾通血开放后静脉滴注甲强龙500 mg。42例受者均采用三联免疫抑制方案,即他克莫司+麦考酚钠+激素。
1.4 观察指标记录供者的临床资料,包括年龄、性别、身高、体质量、IL-6、IL-10、血肌酐、白细胞、高血压和糖尿病患病情况;记录受者的临床资料,包括血型、透析方式、人类白细胞抗原配型情况、群体反应性抗体、血肌酐、供肾的冷缺血时间和DGF发生情况。将受者是否发生DGF作为因变量,分析IL-6和IL-10对DGF的预测价值。
1.5 统计学分析采用SPSS 20.0软件处理数据。计数资料用率表示,采用χ2检验进行比较。计量资料符合正态分布用x±s表示,采用独立样本t检验进行比较,不符合正态分布用M(P25~P75)表示,采用秩和检验进行比较。根据受者是否发生DGF分组后,进行单因素分析,按照P < 0.1的标准筛选变量,将筛选出的变量作为IL-6和IL-10预测受体发生DGF的受试者操作特征(receiver operating characteristic,ROC)曲线的校正因素。采用R语言(4.3.1)pROC包绘制单个指标的ROC曲线,并计算灵敏度、特异度、阳性预测值、阴性预测值及曲线下面积(area under the curve,AUC),采用RISCA包绘制校正协变量后的ROC曲线。采用Delong检验对IL-6和IL-10对应的AUC进行比较[9]。
2 结果 2.1 研究对象的一般资料本研究共纳入21例脑死亡供者,其肾脏被成功移植到42例受者中。供者平均年龄为(51.62±9.74)岁;男性所占比例较大(86.4%);10例受者在肾移植后发生了DGF(23.81%)。将受者按照是否发生DGF进行分组。单因素分析结果显示,DGF组和非DGF组比较,供者IL-6水平和血肌酐水平以及供肾的冷缺血时间有统计学差异(P < 0.1)。因此,将供者血肌酐和供肾的冷缺血时间作为后续IL-6和IL-10预测DGF的调整因素。见表 1。
| Item | DGF group(n = 10) | Non-DGF group(n = 32) | t/Z/χ2 | P |
| Donor information | ||||
| Age(year) | 48.80±6.97 | 52.50±10.25 | -1.06 | 0.29 |
| Male [n(%)] | 4(80.00) | 15(93.75) | 0.70 | 0.24 |
| BMI(kg/m2) | 26.80±6.05 | 23.81±4.43 | 1.70 | 0.10 |
| Hypertension [n(%)] | 6(60.00) | 24(75.00) | 0.84 | 0.36 |
| Diabetes [n(%)] | 0(0) | 4(12.50) | 1.20 | 0.56 |
| Serum creatinine(μmol/L) | 152.60±38.38 | 108.30±56.13 | 2.32 | 0.03 |
| White cells(×109/L) | 17.00(11.25-18.75) | 16.00(11.75-17.50) | 0.65 | 0.78 |
| IL-6(pg/mL) | 324.00(242.00-2 006.00) | 72.50(10.25-130.25) | -2.97 | 0.003 |
| IL-10(pg/mL) | 12.00(8.00-382.00) | 7.00(4.00-17.50) | -0.89 | 0.37 |
| Recipient information | ||||
| Blood type [n(%)] | 1.50 | 0.29 | ||
| A | 2(20.00) | 6(18.80) | ||
| B | 4(40.00) | 8(25.00) | ||
| AB | 2(20.00) | 2(6.20) | ||
| O | 2(20.00) | 16(50.00) | ||
| Mode of dialysis [n(%)] | 2.30 | 0.66 | ||
| Hemodialysis | 7(70.00) | 25(78.10) | ||
| Peritoneal dialysis | 2(20.00) | 6(18.80) | ||
| Hemodialysis + peritoneal dialysis | 1(10.00) | 1(3.10) | ||
| Number of HLA mismatches | 4.90±1.12 | 4.66±1.13 | 0.59 | 0.56 |
| PRA antibody positive [n(%)] | 3(30.00) | 3(9.40) | 0.07 | 0.14 |
| Preoperative serum creatinine(μmol/L) | 1 115.10±278.91 | 1 025.75±274.49 | 0.89 | 0.38 |
| Cold ischemia time(h) | 9.10±4.98 | 6.38±3.75 | 1.85 | 0.07 |
2.2 IL-6和IL-10对肾移植受者发生DGF的预测价值
分别将IL-6和IL-10作为自变量,对肾移植受者的DGF发生情况进行预测。结果显示,IL-6的AUC为0.82(95%CI:0.64~0.99),IL-10的AUC为0.73(95%CI:0.51~0.95)。使用Delong法对IL-6和IL-10的AUC进行比较,无统计学差异(P = 0.54)。IL-6的灵敏度和特异度均 > 0.80,说明预测价值较好,而IL-10灵敏度最高,达到了0.83(95%CI:0.54~1.00),但是特异度较低,仅为0.54(95%CI:0.34~0.74)。见表 2。
| Item | Cut-off(pg/mL) | Sensitivity(95%CI) | Specificity(95%CI) | Positive predictive value(95%CI) | Negative predictive value(95%CI) | AUC(95%CI) |
| IL-6 | 180.00 | 0.80(0.55-1.00) | 0.81(0.68-0.95) | 0.57(0.31-0.81) | 0.93(0.83-1.02) | 0.82(0.64-0.99) |
| IL-10 | 7.50 | 0.83(0.54-1.00) | 0.54(0.34-0.74) | 0.31(0.09-0.54) | 0.93(0.79-0.16) | 0.73(0.51-0.95) |
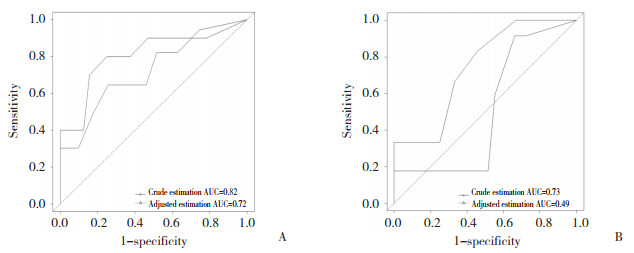
根据单因素分析筛选出的结果,以供血者肌酐和供肾的冷缺血时间为协变量,对IL-6和IL-10预测DGF发生情况进行调整。校正后的ROC曲线显示(图 1),IL-6预测肾移植后受者发生DGF的AUC为0.72,IL-10为0.49,较校正前的AUC有所下降。
|
| A, IL-6; B, IL-10. 图 1 IL-6和IL-10预测DGF发生的AUC及校正后的AUC Fig.1 AUC of IL-6 and IL-10 for predicting DGF and adjusted AUC |
3 讨论
目前,国内外关于尸体供者中DGF发生影响因素的研究较多,并建立了一些DGF预测模型和评分系统[10],如尸体供肾肾移植术后肾功能延迟恢复风险的供者评价系统的多中心研究。而关于脑死亡供者的炎症反应状态对受者发生DGF影响的研究很少。研究[11]已经发现,供者脑死亡后会激发IL-1β、IL-6、TNF-α、CXCL1、CCL2、CCL5调节的免疫反应,从而影响移植效果。本研究发现,供者IL-6对DGF的发生有一定预测价值,但是并未发现IL-10具有预测价值。
与传统尸体供肾相比,脑死亡供者供肾的热缺血时间较长、质量较差、急性肾衰竭发生率较高[12]。但是即使供者发生了急性肾衰竭,也可以达到良好的肾移植效果。FARNEY等[12]发现,脑死亡合并急性肾衰竭供者与正常供者的肾移植相比,5年存活率和移植肾功能相似,即使将急性肾衰竭供者按照不同内生肌酐清除率进行分组后,也未发现其相应的受者在存活率和移植肾功能方面存在明显差异。此外,与国际标准化心脏死亡供者相比,接受脑死亡供者肾脏的受者长期肾功能和生存率无统计学差异[13]。本研究中,接受脑死亡供者肾脏的受者DGF的发生率为23.81%,与以往的报道相似。
DGF可以增加肾移植术后早期的移植物失功、移植物功能障碍和排斥反应的相关风险[14-15]。近年来,通过从供者或受者的生物样本中获得的生物标志物对肾移植后发生DGF进行预测,已经取得了一定的进展,并且生物学标志物作为DGF的预测指标,具有安全、可靠、快速、创伤小等特点。2021年的一项前瞻性、随访时间接近5年的研究[16]表明,脑死亡后供者血清中的CXCL10和IL-6水平均会升高,并且可以作为移植肾即时功能恢复的独立预测指标。IL-6对于未分化的B细胞转化为浆母细胞和成熟浆母细胞以及T细胞的进展都至关重要,并且负责激活IL-17的信号传导,抑制调节性T细胞功能[17]。本研究也发现,供者IL-6能够作为受者发生DGF的独立预测因素,表明减少供者的炎症反应可能影响DGF的发生。
本研究有一定局限性。首先,样本量有限,限制结论的推广;其次,本研究主要关注了移植肾的DGF,没有对移植肾的远期排斥反应和受者的生存情况进行分析;最后,由于资料的限制,调整的因素有限,可能仍会存在混杂偏倚。
综上所述,本研究发现,脑死亡供者的IL-6水平对受者发生DGF具有一定的预测作用,这可能为减少DGF的发生提供新的治疗方法。
| [1] |
KANDASWAMY R, STOCK PG, MILLER J, et al. OPTN/SRTR 2019 annual data report: pancreas[J]. Am J Transplant, 2021, 21(Suppl 2): 138-172. DOI:10.1111/ajt.16496 |
| [2] |
YARLAGADDA SG, COCA SG, FORMICA RN, et al. Association between delayed graft function and allograft and patient survival: a systematic review and meta-analysis[J]. Nephrol Dial Transplant, 2009, 24(3): 1039-1047. DOI:10.1093/ndt/gfn667 |
| [3] |
CHEN Y, SHI J, XIA TC, et al. Preservation solutions for kidney transplantation: history, advances and mechanisms[J]. Cell Transplant, 2019, 28(12): 1472-1489. DOI:10.1177/0963689719872699 |
| [4] |
NYBERG SL, MATAS AJ, ROGERS M, et al. Donor scoring system for cadaveric renal transplantation[J]. Am J Transplant, 2001, 1(2): 162-170. DOI:10.1034/j.1600-6143.2001.001002162.x |
| [5] |
MURUGAN R, VENKATARAMAN R, WAHED AS, et al. Increased plasma interleukin-6 in donors is associated with lower recipient hospital-free survival after cadaveric organ transplantation[J]. Crit Care Med, 2008, 36(6): 1810-1816. DOI:10.1097/ccm.0b013e318174d89f |
| [6] |
POLLARA J, EDWARDS RW, LIN L, et al. Circulating mitochondria in deceased organ donors are associated with immune activation and early allograft dysfunction[J]. JCI Insight, 2018, 3(15): e121622. DOI:10.1172/jci.insight.121622 |
| [7] |
HANLEY JA, MCNEIL BJ. A method of comparing the areas under receiver operating characteristic curves derived from the same cases[J]. Radiology, 1983, 148(3): 839-843. DOI:10.1148/radiology.148.3.6878708 |
| [8] |
SARAIVA M, O'GARRA A. The regulation of IL-10 production by immune cells[J]. Nat Rev Immunol, 2010, 10(3): 170-181. DOI:10.1038/nri2711 |
| [9] |
DELONG ER, DELONG DM, CLARKE-PEARSON DL. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach[J]. Biometrics, 1988, 44(3): 837. DOI:10.2307/2531595 |
| [10] |
RAO PS, SCHAUBEL DE, GUIDINGER MK, et al. A comprehensive risk quantification score for deceased donor kidneys: the kidney donor risk index[J]. Transplantation, 2009, 88(2): 231-236. DOI:10.1097/tp.0b013e3181ac620b |
| [11] |
FLOERCHINGER B, OBERHUBER R, TULLIUS SG. Effects of brain death on organ quality and transplant outcome[J]. Transplant Rev (Orlando), 2012, 26(2): 54-59. DOI:10.1016/j.trre.2011.10.001 |
| [12] |
FARNEY AC, ROGERS J, ORLANDO G, et al. Evolving experience using kidneys from deceased donors with terminal acute kidney injury[J]. J Am Coll Surg, 2013, 216(4): 645-655. DOI:10.1016/j.jamcollsurg.2012.12.020 |
| [13] |
TAMINATO M, FRAM D, GROTHE C, et al. Prevalence of infection in kidney transplantation from living versus deceased donor: systematic review and meta-analysis[J]. Rev Esc Enferm USP, 2015, 49(3): 509-514. DOI:10.1590/s0080-623420150000300020 |
| [14] |
CHEN R, WANG H, SONG L, et al. Predictors and one-year outcomes of patients with delayed graft function after deceased donor kidney transplantation[J]. BMC Nephrol, 2020, 21(1): 526. DOI:10.1186/s12882-020-02181-1 |
| [15] |
WALLS DO, LEE-RIDDLE GS, BOVER MANDERSKI M, et al. Kidney transplant outcomes from donation after circulatory death donors of advanced age[J]. Clin Transplant, 2020, 34(7): e13881. DOI:10.1111/ctr.13881 |
| [16] |
PIEMONTI L, SORDI V, PELLEGRINI S, et al. Circulating CXCL10 and IL-6 in solid organ donors after brain death predict graft outcomes[J]. Sci Rep, 2021, 11(1): 6624. DOI:10.1038/s41598-021-86085-6 |
| [17] |
SZCZEPANIK A, IASELLA CJ, MCDYER JF, et al. Cytokine-targeted therapy for the management of solid organ transplant recipients[J]. Hum Immunol, 2019, 80(3): 184-190. DOI:10.1016/j.humimm.2018.12.006 |
 2024, Vol. 53
2024, Vol. 53