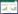文章信息
- 张苗苗, 刘雨佳, 张甦, 焦光宇
- ZHANG Miaomiao, LIU Yujia, ZHANG Su, JIAO Guangyu
- 左西孟旦通过PTEN/Akt通路抑制脂多糖引起的C2C12细胞凋亡
- Levosimendan inhibits lipopolysaccharide-induced C2C12 cell apoptosis via the PTEN/Akt pathway
- 中国医科大学学报, 2024, 53(2): 121-126
- Journal of China Medical University, 2024, 53(2): 121-126
-
文章历史
- 收稿日期:2023-05-16
- 网络出版时间:2024-01-10 16:01:48
2. 辽宁中医药大学中医学院, 沈阳 110032
2. Department of Chinese Traditional Medicine, Liaoning University of Traditional Chinese Medicine, Shenyang 110032, China
脓毒症是一种以全身炎症反应和组织损伤为特征的临床综合征,可导致机体循环衰竭、多器官功能障碍甚至死亡,是全球危重患者死亡的主要原因之一[1]。脓毒症涉及心脏、肺脏、肾脏、肌肉等全身器官组织。骨骼肌萎缩是脓毒症严重的并发症之一,膈肌损伤严重者可发展为脓毒症相关膈肌功能障碍(sepsis-induced diaphragm dysfunction,SIDD),进而危及患者生命[2]。目前,脓毒症患者膈肌损伤仍然缺乏有效的指南性用药[3]。
脂多糖(lipopolysaccharide,LPS) 可促进炎性凋亡因子的产生并抑制抗氧化活性,是导致脓毒症的主要原因之一。过度凋亡引起的损伤在脓毒症损伤中起关键作用。研究[4]报道,左西孟旦可抑制LPS诱导的脓毒症大鼠炎症和细胞凋亡。然而,左西孟旦对LPS诱导的C2C12细胞凋亡损伤的调控机制尚不清楚。有研究[5]证实,左西孟旦可能通过调节第10号染色体磷酸酶和张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome ten,PTEN) /蛋白激酶B (protein kinase B,Akt) 信号通路来预防阿霉素引起的心脏毒性,PTEN/Akt信号通路是重要的细胞抗凋亡应激防御机制之一[6]。本研究旨在探讨左西孟旦对LPS诱导的C2C12细胞凋亡的作用机制。
1 材料与方法 1.1 材料C2C12小鼠成肌细胞(中国科学院),DMEM高糖培养基(中国普诺赛生命科技有限公司),胰蛋白酶消化液(中国碧云天生物技术有限公司),青霉素-链霉素溶液(中国碧云天生物技术有限公司),胎牛血清(美国Gibco公司),CCK-8 (中国APEBIO公司),左西孟旦(中国齐鲁制药有限公司),hoechst33342活细胞染色液(中国碧云天生物技术有限公司),LPS (中国索莱宝生物科技有限公司),PTEN抗体(英国Biorbyt公司),p-Akt抗体(中国Abmart公司),AKT抗体(中国万类生物科技有限公司),BAX抗体(中国Abmart公司),Bcl-2抗体(中国Abmart公司),caspase-3抗体(中国万类生物科技有限公司),α-Tubulin抗体(武汉三鹰生物技术有限公司),山羊抗兔抗体(武汉三鹰生物技术有限公司),siRNA-PTEN试剂盒(中国北京合生生物科技有限公司),二氧化碳培养箱(中国博科生物科技有限公司),离心机(美国赛默飞科技有限公司),酶标仪(美国赛默飞科技有限公司),倒置显微镜(日本尼康公司),荧光倒置显微镜(日本尼康公司)。
1.2 C2C12细胞的培养与分组胎牛血清配置10%高糖培养液培养C2C12细胞,待细胞生长至70%~80%传代,于80%给予2%马血清诱导细胞分化。将C2C12细胞依次分为空白对照组(CON组)、左西孟旦预处理后的对照组(CON+L组)、LPS处理组(LPS组) 和左西孟旦预处理后的LPS处理组(LPS+L组)。CON组C2C12细胞用无血清培养液培养;CON+L组C2C12细胞用左西孟旦预处理24 h;LPS组C2C12细胞用无血清培养液处理24 h,再使用LPS (10 μg/mL) 处理48 h;LPS+L组细胞用左西孟旦预处理24 h,LPS (10 μg/mL) 处理48 h。
1.3 CCK-8法测定C2C12细胞存活率将C2C12细胞接种在96孔板中,待细胞生长至70%~80%。CCK-8法选择合适的起保护作用的左西孟旦浓度,分别使用不同浓度的左西孟旦(0、1、10、20、50、100 μmoL/L) 孵育C2C12细胞24 h。CCK-8法检测左西孟旦对LPS诱发的C2C12细胞存活率的作用,实验分组同1.2。待给药结束,弃去旧的培养液,加入富含10% CCK-8的无血清培养液100 μL,摇晃混匀,在二氧化碳孵箱中培养1~2 h,于酶标仪450 nm处检测细胞吸光度(optical density,OD) 并记录。细胞存活率=处理组OD/未处理组OD×100%。
1.4 hoechst33342检测各组C2C12细胞凋亡情况将C2C12细胞接种至12孔板,待细胞生长至70%~80%,分组给药,结束后弃去上清液,PBS洗净,分别加入1 mL培养液,每孔给予10 μL hoechst33342活细胞染色液混匀,于37 ℃ 5%CO2培养箱中培养10 min,弃含有染料的培养液,用PBS洗涤3次,倒置荧光显微镜下观察。
1.5 实时PCR检测PTEN/Akt通路mRNA表达水平用Trizol提取RNA并进行逆转录,之后在荧光定量PCR仪器上进行扩增,引物序列PTEN-F,5’-AAGACCATAACCCACCACAGC-3’,PTEN-R,5’-ACCAGTTCGTCCCTTTCCAG-3’;Bax-F,5’-GGCGAATTGGAGATGAACTG-3’,Bax-R,5’-AAAGTAGAAGAGGGCAACCA-3’;Bcl-2-F,5’-AGGATTGTGGCCTTCTTTGA-3’,Bcl-2-R,5’-ACCTACCCAGCCTCCGTTAT-3’;caspase-3-F,5’-ACGGTCCTCCTGGTCTTTG-3’,caspase-3-R,5’-TGGCTGGCTGCATTGC-3’;β-actin-F,5’-TGGGAATGGGTCAGAAGGA-3’,β-actin-R,5’-ATTGAGAAAGGGCGTGGC-3’,以β-actin为内参。10 µL反应体系包括2×Taq Pro Universal SYBR q PCR Master Mix 5 µL,上、下游引物(10 µmol/L) 各0.2 µL,cDNA (50 µg/L) 1.0 µL,灭菌水3.6 µL。引物由北京生物科技有限公司合成。PCR扩增条件为95 ℃预变性5 min,95 ℃ 10 s,55 ℃ 30 s,72 ℃ 30 s共40个循环。每组设3个复孔,采用2-ΔΔCt法计算各基因mRNA相对表达量。
1.6 Western blotting检测PTEN/Akt相关通路蛋白表达水平使用含有PMSF的RIPA缓冲液提取各组C2C12细胞的总蛋白。等量的蛋白经过12.5%胶分离并转到PVDF膜上,在无蛋白封闭液中封闭10 min。然
后将膜与PTEN、p-Akt、Akt、Bax、Bcl-2、caspase-3和α-Tubulin一抗(稀释比例1∶1 000) 4 ℃孵育过夜。将与一抗反应过的膜与HRP标记的二抗(稀释比例1∶6 000) 在室温下孵育1 h。使用增强型ECL检测免疫复合物。蛋白质的灰度值使用Image J定量分析。
1.7 siRNA-PTEN敲除PTEN基因,检测C2C12细胞中PTEN/Akt通路蛋白表达情况培养C2C12细胞,待细胞生长至70%~80%,随机分为CON组、LPS组、LPS+siRNA-NC组和LPS+siRNA-PTEN组,CON组不做处理,LPS组用10 μg/mL LPS处理48 h,siRNA-NC与siRNA-PTEN转染至C2C12细胞,6 h换液,24 h后给予10 μg/mL LPS。48 h后收集细胞并提取蛋白。
1.8 统计学分析采用GraphPad Prism 6.0软件进行统计分析,分析数据以x±s表示,采用单因素方差分析和Tukey’s多重比较方法,P < 0.05为差异有统计学意义。
2 结果 2.1 不同浓度左西孟旦对C2C12细胞存活率的影响分别用0、1、10、20、50、100 μmoL/L的左西孟旦处理C2C12细胞,发现10 μmoL/L左西孟旦对C2C12细胞存活率无明显影响(P > 0.05),1 μmoL/L左西孟旦可提高细胞存活率(P < 0.05),而20、50、100 μmoL/L左西孟旦可降低细胞存活率(P < 0.05)。本研究选择1 μmoL/L左西孟旦作为最适的保护用药浓度进行后续实验,见图 1。
|
| 图 1 不同浓度左西孟旦对C2C12细胞存活率的影响 Fig.1 Effect of levosimendan concentration on the survival rate of C2C12 cells |
2.2 左西孟旦对LPS诱导的C2C12细胞存活率的影响
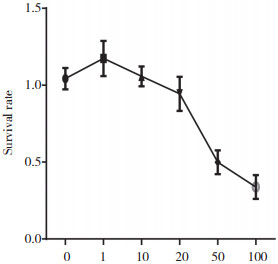
CCK-8法检测细胞存活率,与CON组和CON+L组比较,LPS组细胞的存活率下降为74.41%;与LPS组比较,LPS+L组细胞存活率上升为92.65%,差异有统计学意义(P = 0.01),见图 2。
|
| *P < 0.01, compared with control group; #P < 0.05, compared with LPS group. CON, control; LPS, lipopolysaccharide; L, levosimendan. 图 2 左西孟旦对LPS诱导的细胞存活率的影响 Fig.2 Effect of levosimendan on the survival rate of LPS-treated cells |
2.3 左西孟旦可减轻LPS诱导的C2C12细胞凋亡
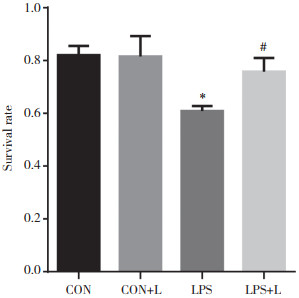
Hoechst 33342染色结果显示,CON和CON+L组细胞呈暗蓝色,说明细胞状态良好;LPS组部分细胞呈亮蓝色,可看到细胞核凝结与核碎裂,表明细胞发生凋亡;LPS+L组亮蓝色细胞减少,提示发生凋亡的细胞减少,见图 3。
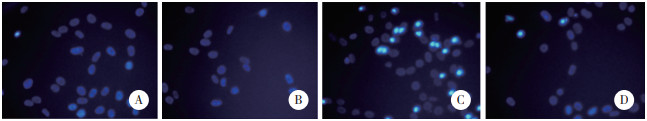
|
| A,CON group;B,CON+L group;C,LPS group;D,LPS+L group. 图 3 左西孟旦对C2C12细胞凋亡的影响×200 Fig.3 Effect of levosimendan on the apoptosis of C2C12 cells ×200 |
2.4 左西孟旦对PTEN/Akt信号通路mRNA的影响
与CON组和CON+L相比,LPS组PTEN、Bax与caspase-3 mRNA表达量分别较前升高77.07%、261.63%、
47.31% (P < 0.05);与LPS组比较,LPS+L组Bax与caspase-3 mRNA表达水平较前降低68.65%、52.36%,Bcl-2 mRNA表达水平升高117.83% (P < 0.05),见图 4。
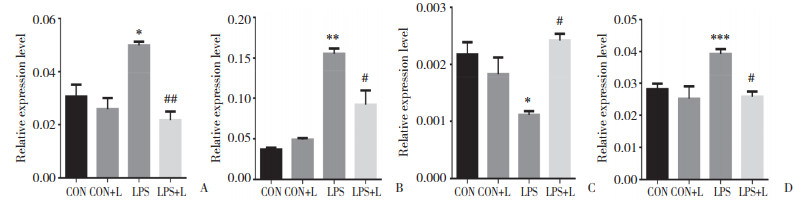
|
| A, PTEN mRNA; B, Bax mRNA; C, Bcl-2 mRNA; D, caspase-3 mRNA. *P < 0.05, **P < 0.01, ***P < 0.001, compared with control group; #P < 0.05, compared with LPS group. 图 4 左西孟旦对PTEN/Akt信号通路mRNA的影响 Fig.4 Effect of levosimendan on the mRNA levels of genes associated with the PTEN/Akt signaling pathway |
2.5 左西孟旦对LPS诱导的PTEN/Akt信号通路蛋白的影响
与CON组和CON+L组相比,LPS组PTEN、Bax、caspase-3蛋白表达水平升高,p-Akt与Bcl-2蛋白表达降低(P < 0.05);与LPS组比较,LPS+L组PTEN、Bax、caspase-3蛋白表达水平降低,p-Akt与Bcl-2蛋白表达水平升高(P < 0.05),见图 5。
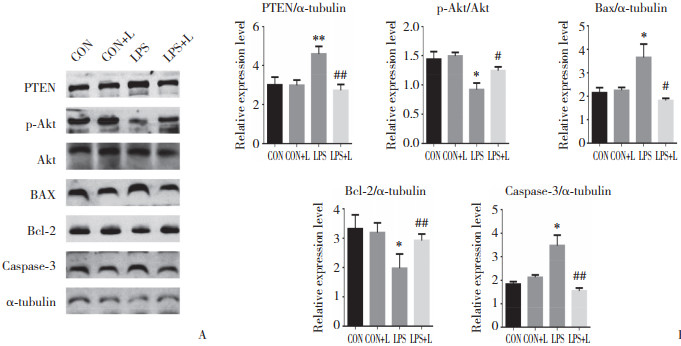
|
| A, protein expression in different groups; B, differences in protein expression of different groups. *P < 0.05, **P < 0.01, compared with control group; #P < 0.05, ##P < 0.01, compared with LPS group. 图 5 左西孟旦对LPS诱导的C2C12 PTEN/Akt信号通路蛋白的影响 Fig.5 Effect of levosimendan on the expression of PTEN/Akt signaling pathway proteins in LPS-treated C2C12 cells |
2.6 siRNA-PTEN敲除PTEN基因对PTEN/Akt通路蛋白表达的影响
与CON组相比,LPS组与LPS+siRNA-NC组PTEN、Bax、caspase-3蛋白表达水平升高,p-Akt与Bcl-2蛋白表达降低(P < 0.05);与LPS组和LPS+siRNA-NC组比较,LPS+siRNA-PTEN组PTEN、Bax、caspase-3蛋白表达水平降低,p-Akt与Bcl-2蛋白表达水平升高(P < 0.05),见图 6。
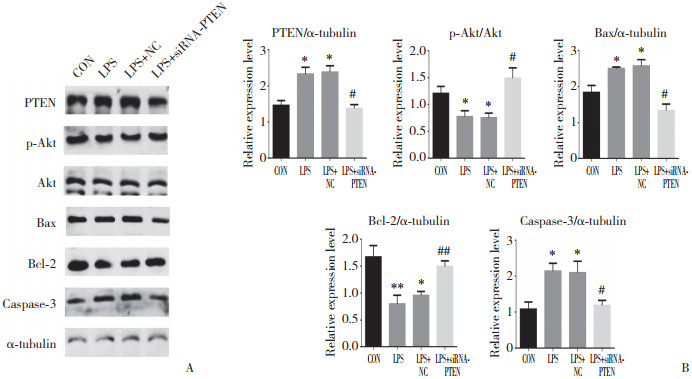
|
| A, protein expression in the different groups; B, differences in protein expression in each group. *P < 0.05, **P < 0.01, compared with control group, #P < 0.05, ##P < 0.01, compared with LPS group. 图 6 siRNA-PTEN敲除PTEN基因对PTEN/Akt通路蛋白表达的影响 Fig.6 Effect of siRNA-PTEN knockdown on the expression of PTEN/Akt pathway proteins |
3 讨论
脓毒症可诱发膈肌发生凋亡,然而其通路和机制尚未完全明确。本研究结果显示,在体外左西孟旦可靶向PTEN抑制LPS诱导的C2C12细胞凋亡。
脓毒症被定义为机体因感染而失控的宿主反应所致的危及生命的器官功能障碍。治疗手段主要包括抗感染、血流动力学管理与机械通气等[7],然而临床上并没有治疗膈肌的指南性药物[8-9]。左西孟旦是一种钙增敏剂,主要通过在肌肉激活过程中稳定钙和肌钙蛋白复合物之间的相互作用发挥增强肌力的作用。除此之外,左西孟旦还有抗氧化、调节免疫与抑制凋亡的作用。有研究[10]表明,左西孟旦预处理可提高部分肝切除术后脓毒症大鼠的存活率,这与其抑制肝细胞中诱导型一氧化氮合酶的生成相关。左西孟旦会影响通气的脓毒症小鼠膈肌的氧化和炎症通路[4],还可减轻脓毒症大鼠凝血功能障碍和器官功能障碍[11]。然而左西孟旦减轻膈肌细胞凋亡的具体信号通路尚未明确。研究[12-13]表明,左西孟旦可以通过清除自由基以及与线粒体相关的凋亡通路,保护心肌细胞免受高半胱氨酸诱导的氧化应激和细胞凋亡;左西孟旦可能通过调节PTEN/Akt信号通路来预防阿霉素引起的心肌凋亡。C2C12成肌细胞与心肌细胞同属肌肉细胞,因此预测左西孟旦也可通过PTEN/Akt通路起到抗C2C12细胞凋亡的作用。
PTEN是一种具有磷酸酶活性的肿瘤抑制分子,通过结合配体进一步激活胞内PI3K,PI3K/Akt是细胞中一条关键的信号通路,广泛参与细胞增殖、分化及凋亡的各个过程,是维持细胞生长、发育和凋亡的重要机制之一[14-17]。PTEN缺失可增加Akt的磷酸化并阻断Akt调控的下游信号事件,从而避免相关凋亡通路的激活,保护细胞免于凋亡。活化的Akt能够通过磷酸化抗凋亡蛋白(如Bcl-2)、抑制Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax) 与Bax形成异二聚体,进而抑制线粒体释放凋亡因子及细胞色素C,减少caspase家族活化,最终有效阻断细胞凋亡[18-19]。
本研究通过CCK-8、hoechst33342活细胞染色法、实时PCR与Western blotting分别检测了LPS诱导C2C12细胞损伤情况下细胞存活率、细胞凋亡率、凋亡相关指标的情况。结果显示,左西孟旦可以降低LPS诱导后C2C12细胞的凋亡率。siRNA-PTEN敲除PTEN基因,凋亡通路被抑制进而对C2C12细胞起到抗凋亡的作用。综上所述,左西孟旦可以通过PTEN/Akt通路抑制LPS引起的C2C12细胞凋亡,这为左西孟旦治疗脓毒症相关膈肌功能障碍提供了可能性。
| [1] |
THOMPSON K, VENKATESH B, FINFER S. Sepsis and septic shock: current approaches to management[J]. Intern Med J, 2019, 49(2): 160-170. DOI:10.1111/imj.14199 |
| [2] |
GOLIGHER EC, JONKMAN AH, DIANTI J, et al. Clinical strategies for implementing lung and diaphragm-protective ventilation: avoiding insufficient and excessive effort[J]. Intensive Care Med, 2020, 46(12): 2314-2326. DOI:10.1007/s00134-020-06288-9 |
| [3] |
PURCAREA A, SOVAILA S. Sepsis, a 2020 review for the internist[J]. Romanian J Intern Med, 2020, 58(3): 129-137. DOI:10.2478/rjim-2020-0012 |
| [4] |
SCHELLEKENS WJ M, VAN HEES HW, LINKELS M, et al. Levosimendan affects oxidative and inflammatory pathways in the diaphragm of ventilated endotoxemic mice[J]. Crit Care, 2015, 19(1): 1-9. DOI:10.1186/s13054-015-0798-8 |
| [5] |
LI LL, WEI L, ZHANG N, et al. Levosimendan protects against doxorubicin-induced cardiotoxicity by regulating the PTEN/Akt pathway[J]. Biomed Res Int, 2020, 2020: 8593617. DOI:10.1155/2020/8593617 |
| [6] |
WEN ZZ, MAI Z, ZHU XL, et al. Mesenchymal stem cell-derived exosomes ameliorate cardiomyocyte apoptosis in hypoxic conditions through microRNA144 by targeting the PTEN/AKT pathway[J]. Stem Cell Res Ther, 2020, 11(1): 1-17. DOI:10.1186/s13287-020-1563-8 |
| [7] |
GOTTS JE, MATTHAY MA. Sepsis: pathophysiology and clinical management[J]. BMJ, 2016, 353: i1585. DOI:10.1136/bmj.i1585 |
| [8] |
GOLIGHER EC, DRES M, PATEL BK, et al. Lung-and diaphragm-protective ventilation[J]. Am J Respir Crit Care Med, 2020, 202(7): 950-961. DOI:10.1164/rccm.202003-0655CP |
| [9] |
王帅, 柯旭, 杨晓纲, 等. 脓毒症相关膈肌功能障碍的发病机制[J]. 医学综述, 2020, 4(26): 733-737. DOI:10.3969/j.issn.1006-2084.2020.04.021 |
| [10] |
SAKAGUCHI T, HASHIMOTO Y, MATSUSHIMA H, et al. Levosimendan pretreatment improves survival of septic rats after partial hepatectomy and suppresses iNOS induction in cytokine-stimulated hepatocytes[J]. Sci Rep, 2019, 9: 13398. DOI:10.1038/s41598-019-48792-z |
| [11] |
HUANG HC, TSAI HJ, WANG CC, et al. Levosimendan mitigates coagulopathy and organ dysfunction in rats with endotoxemia[J]. J Chin Med Assoc, 2017, 80(7): 432-441. DOI:10.1016/j.jcma.2016.12.008 |
| [12] |
CHRISTOPH M, THOMAS E, NAZHA H, et al. Treatments targe-ting inotropy[J]. Eur Heart J, 2019, 40(44): 3626-3644. |
| [13] |
ZHAO L, TIAN L, WANG SW, et al. Levosimendan in rats decreases acute kidney injury after cardiopulmonary resuscitation by improving mitochondrial dysfunction[J]. Transl Androl Urol, 2021, 10(7): 3010-3020. DOI:10.21037/tau-21-443 |
| [14] |
XIE YB, SHI XF, SHENG K, et al. PI3K/Akt signaling transduction pathway, erythropoiesis and glycolysis in hypoxia (review)[J]. Mol Med Rep, 2019, 19(2): 783-791. DOI:10.3892/mmr.2018.9713 |
| [15] |
AOKI M, FUJISHITA T. Oncogenic roles of the PI3K/AKT/mTOR axis [M]//Current Topics in Microbiology and Immunology. Cham: Springer International Publishing, 2017: 153-189. DOI: 10.1007/82_2017_6.
|
| [16] |
NOOROLYAI S, SHAJARI N, BAGHBANI E, et al. The relation between PI3K/AKT signalling pathway and cancer[J]. Gene, 2019, 698: 120-128. DOI:10.1016/j.gene.2019.02.076 |
| [17] |
WEN XF. The PI3K AKT pathway in the pathogenesis of prostate cancer[J]. Front Biosci, 2016, 21(5): 1084-1091. DOI:10.2741/4443 |
| [18] |
LI YS, XIA JW, JIANG NX, et al. Corin protects H2O2-induced apoptosis through PI3K/AKT and NF-κB pathway in cardiomyocytes[J]. Biomed Pharmacother, 2018, 97: 594-599. DOI:10.1016/j.biopha.2017.10.090 |
| [19] |
WEI LJ, ZHOU QQ, TIAN H, et al. Integrin β3 promotes cardiomyocyte proliferation and attenuates hypoxia-induced apoptosis via regulating the PTEN/Akt/mTOR and ERK1/2 pathways[J]. Int J Biol Sci, 2020, 16(4): 644-654. DOI:10.7150/ijbs.39414 |
 2024, Vol. 53
2024, Vol. 53