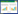文章信息
- 谢航, 李华, 李海涛, 石若玉, 陈乾, 臧宾宾
- XIE Hang, LI Hua, LI Haitao, SHI Ruoyu, CHEN Qian, ZANG Binbin
- 当归多糖调控AMPK/NLRP3通路介导的细胞焦亡对脓毒症大鼠肠道损伤的改善作用
- Effect of Angelica sinensis polysaccharides on intestinal injury in septic rats by regulating AMPK/NLRP3 pathway-mediated pyroptosis
- 中国医科大学学报, 2024, 53(12): 1057-1063, 1070
- Journal of China Medical University, 2024, 53(12): 1057-1063, 1070
-
文章历史
- 收稿日期:2024-01-23
- 网络出版时间:2024-12-09 12:22:11
2. 河南省中医院 (河南中医药大学第二附属医院) 急诊科, 郑州 450053;
3. 河南中医药大学第一附属医院心血管科, 郑州 450099;
4. 河南省中医院 (河南中医药大学第二附属医院) 肾病科, 郑州 450053
2. Department of Emergency, Henan Provincial Hospital of Traditional Chinese Medicine (The Second Affiliated Hospital of Henan University of Chinese Medicine), Zhengzhou 450053, China;
3. Department of Cardiology, The First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450099, China;
4. Department of Nephrology, Henan Provincial Hospital of Traditional Chinese Medicine (The Second Affiliated Hospital of Henan University of Chinese Medicine), Zhengzhou 450053, China
脓毒症是由感染引起的全身炎症反应综合征,其特征是炎症反应增强伴多器官功能障碍或衰竭,是重症监护室患者最常见的死亡原因[1]。脓毒症可引起肠上皮紊乱,如上皮细胞死亡增加、屏障功能障碍和细胞因子生成。细胞焦亡与脓毒症相关,由胱天蛋白酶-1(caspase-1)介导,是炎症反应中细胞死亡的重要因素[2]。因此,研究脓毒症与肠道的关系,并开发减轻肠道损伤的药物至关重要。当归通过调节巨噬细胞的炎症反应减轻耐甲氧西林金黄色葡萄球菌感染引起的脓毒症[3]。而当归多糖(Angelica sinensis polysaccharide,ASP)是当归的主要活性成分之一,有促进免疫、抗肿瘤、抗炎、抗氧化、抗衰老等多种药理活性[4]。ASP可减轻辐射诱导的大鼠肠道屏障损伤[5],但ASP对脓毒症大鼠肠道损伤的改善作用尚未见报道。
研究[6-7]发现,单磷酸腺苷活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)/Nod样受体蛋白3(Nod like receptor protein 3,NLRP3)通路在溃疡性结肠炎、结肠炎相关性结直肠癌等炎症性肠病的发生和进展中起重要作用。陈浩等[8]研究发现,抑制NLRP3炎症小体激活,可减轻脓毒症大鼠肠道损伤。LIU等[9]发现,激活AMPK抑制NLRP3炎症小体,可缓解脓毒症诱导的急性肺损伤。此外,ASP可通过抑制NLRP3炎症小体信号激活,减轻慢性肾衰竭大鼠肾组织炎症,改善肾功能[10]。ASP可能通过调控AMPK/NLRP3通路缓解脓毒症大鼠肠道损伤。本研究以盲肠结扎穿孔术复制脓毒症大鼠模型,用不同浓度的ASP干预脓毒症大鼠,探讨ASP对脓毒症大鼠肠道损伤的影响及作用机制。
1 材料与方法 1.1 实验动物雄性Sprague-Dawley大鼠(200~250 g)购自杭州环特生物科技股份有限公司,实验动物许可证号:SCXK(浙)2022-0003。所有大鼠饲养于23~27 ℃的环境中,12 h明暗周期,并在手术前禁食,只允许饮水。所有动物实验经河南省中医院动物实验伦理审查委员会审查通过。
1.2 主要试剂与仪器ASP(R134778)购自上海瑞楚生物科技有限公司;AMPK抑制剂Compound C(B3252)购自上海伟寰生物科技有限公司;HE染色液(BL1205)购自北京百奥莱博科技有限公司;蛋白提取试剂盒(TQ6120-100T)购自上海信帆生物科技有限公司;白细胞介素(interleukin,IL)-18、IL-1β ELISA检测试剂盒(E-EL-R0567c、E-EL-R0012c)购自北京百奥创新科技有限公司;D-氨基酸氧化酶(D-amino acid oxidase,DAO)、肠脂肪酸结合蛋白(intestinal fatty acid binding protein,iFABP)ELISA检测试剂盒(bll30013、bll30430)购自上海佰利莱生物科技有限公司;兔源一抗NLRP3(ab263899)、p-AMPK(ab32047)、AMPK(ab32047)、GAPDH(ab181602)、消皮素D(gasdermin D,GSDMD;ab239377)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC;ab309497)、剪切的胱天蛋白酶-1(cleaved caspase-1;ab2302)、辣根过氧化物酶(horse radish peroxidase,HRP)偶联的山羊抗兔IgG(ab205718)购自英国abcam公司;TUNEL凋亡试剂盒(T6068L)购自上海觅拓生物科技有限公司;离心机(0030001174)购自艾卡(广州)仪器设备有限公司;酶标仪(168-1130)购自伯乐生命医学产品(上海)有限公司;光学显微镜(Echo Revolve)购自美国ECHO公司。
1.3 实验方法 1.3.1 动物建模、分组和干预以盲肠结扎穿孔术复制脓毒症大鼠模型,方法参考文献[8]。大鼠经麻醉、备皮、消毒后,沿腹腔中线做1.5 cm切口,用1号缝线在盲肠和近端回盲瓣下方0.5 cm处结扎盲肠,用注射器针头在结扎中部位置进行穿孔,来回贯穿2次,并轻轻挤压,将内容物从穿孔部位挤出。术后缝合切口并镇痛。若大鼠出现精神萎靡、活动及进食少、呼吸急促、眼鼻分泌物增多等视为脓毒症模型构建成功。将成功造模的大鼠分为模型(Model)组、ASP低、中、高剂量(ASP-L、ASP-M、ASP-H)组、AMPK抑制剂(抑制剂)组、每组12只,同期选择12只未行盲肠结扎大鼠作为假手术(Sham)组。ASP-L、ASP-M、ASP-H组大鼠分别灌胃60、120、240 mg/kg ASP [5];抑制剂组大鼠腹腔注射Compound C(20 mg/kg),并灌胃ASP(240 mg/kg)[11];Model组、Sham组腹腔注射和灌胃等量的生理盐水,1次/12 h,连续3 d。
1.3.2 HE染色给药结束后,腹膜内注射200 mg/kg戊巴比妥钠处死大鼠,收集肠道组织。冲洗小肠组织,室温下4%多聚甲醛固定过夜,脱水后包埋于石蜡中,切片(厚5 μm)。然后将切片于室温下用苏木精溶液染色10 min,伊红溶液染色1 min。70%乙醇冲洗后,梯度乙醇脱水、二甲苯透明、中性胶密封切片。光学显微镜下观察小肠组织的病理变化并进行Chiu评分[12]。
1.3.3 TUNEL染色小肠组织石蜡切片用磷酸盐缓冲溶液洗涤3次。严格按照TUNEL试剂盒说明书加注反应液。二氨基联苯胺溶液染色后,苏木精复染,梯度乙醇脱水,二甲苯透明,中性胶密封。TUNEL阳性细胞在显微镜下呈绿色荧光,计算细胞焦亡率。
1.3.4 免疫组织化学染色将小肠组织切片浸入柠檬酸钠溶液中进行抗原修复,并用3%过氧化氢处理20 min。4 ℃下与1∶1 000稀释的NLRP3一抗孵育过夜,并与HRP偶联的抗山羊IgG二抗(1∶1 000)孵育60 min,DAB染色后,光学显微镜下观察并拍照。用Imagepro Plus 6.0分析阳性细胞率。
1.3.5 IL-18和IL-1β水平检测给药结束后,从大鼠腹主动脉中抽取2 mL血液,于离心管中静置1 h后,于4 ℃ 3 000 r/min离心10 min,获得血清并冻存于-80 ℃。采用ELISA试剂盒检测IL-18、IL-1β水平。酶标仪检测450 nm处的光密度(optical density,OD)值。根据OD值绘制标准曲线,并计算各样品中IL-18、IL-1β水平,取平均值。
1.3.6 肠功能指标DAO和iFABP活性的检测使用RIPA裂解缓冲液裂解小肠组织,按照试剂盒说明书检测小肠组织中DAO和iFABP的活性。
1.3.7 GSDMD、ASC、cleaved caspase-1及p-AMPK/AMPK蛋白表达检测小肠组织用RIPA裂解缓冲液在冰上裂解30 min。将样品离心15 min,并提取上清液。通过2,2-联喹啉-4,4-二甲酸二钠(bicinchoninic acid,BCA)测定后,将40 μg总蛋白与等体积的样品缓冲液混合,并在100 ℃煮沸3 min使其变性。将蛋白在6% SDS-聚丙烯酰胺凝胶上电泳,并常规转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上,该膜在室温下用含有5%牛血清白蛋白的TBST封闭2 h。用TBST洗涤PVDF膜3次,5 min/次。加入抗GSDMD(1∶1 000)、ASC1(1∶1 000)、cleaved caspase-1(1∶1 000)、p-AMPK(1∶1 000)、AMPK(1∶1 000)和GAPDH(1∶1 000)抗体,4 ℃孵育过夜。TBST充分洗涤后,室温下加入HRP偶联的山羊抗兔IgG抗体(1∶5 000)孵育PVDF膜2 h,洗涤3次,并用ECL发光试剂盒显影。用凝胶成像系统对膜进行拍照,并通过ImageJ软件分析灰度值。
1.4 统计学分析采用Graphpad Prism 9.0软件进行统计分析。符合正态分布的计量资料以x±s表示,多组间的比较采用单因素方差分析,SNK-q检验用于组间两两比较。P < 0.05为差异有统计学意义。
2 结果 2.1 ASP对大鼠小肠组织病理损伤的影响Sham组大鼠小肠组织细胞排列有序,可以观察到明显的肠绒毛,无明显病理损伤;相较于Sham组,Model组大鼠肠道组织的完整性和绒毛结构被破坏,细胞排列紊乱,并伴有炎症细胞浸润,小肠组织Chiu评分升高(P < 0.05);相较于Model组,ASP-L、ASP-M、ASP-H组肠道组织的完整性和绒毛结构逐渐恢复,炎症细胞浸润依次减轻,小肠组织细胞Chiu评分降低(P < 0.05),ASP-H组绒毛结构接近正常;相较于ASP-H组,抑制剂组大鼠小肠组织Chiu评分升高(P < 0.05)。见图 1、表 1。
|
| A, sham group; B, model group; C, ASP-L group; D, ASP-M group; E, ASP-H group; F, inhibitor group. 图 1 大鼠小肠组织病理损伤HE染色×200 Fig.1 Histopathological damage of rat small intestine HE staining ×200 |
| Group | Chiu score | Cell pyroptosis rate(%) | NLRP3 positivity rate(%) |
| Sham | 0.24±0.08 | 2.36±0.58 | 2.83±1.05 |
| Model | 4.59±0.191) | 35.47±2.691) | 32.97±2.541) |
| ASP-L | 3.64±0.172) | 29.81±2.452) | 25.86±2.312) |
| ASP-M | 2.48±0.162),3) | 21.75±1.962),3) | 18.49±1.252),3) |
| ASP-H | 1.52±0.142),3),4) | 13.52±1.182),3),4) | 10.83±1.192),3),4) |
| Inhibitor | 2.97±0.155) | 24.97±1.155) | 20.97±1.355) |
| 1)P < 0.05 vs. sham group;2)P < 0.05 vs. model group;3)P < 0.05 vs. ASP-L group;4)P < 0.05 vs. ASP-M group;5)P < 0.05 vs. ASP-H group. | |||
2.2 ASP对大鼠小肠组织细胞焦亡的影响
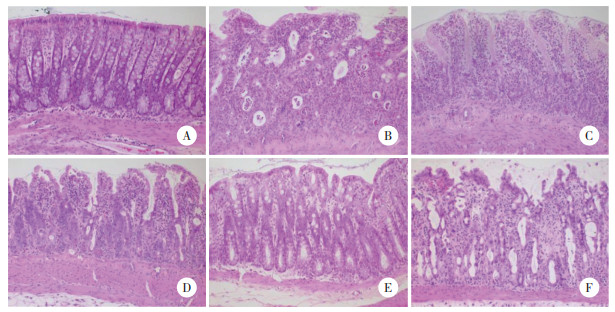
相较于Sham组,Model组大鼠小肠组织的细胞焦亡率升高(P < 0.05);相较于Model组,ASP-L、ASP-M、ASP-H组小肠组织细胞焦亡率降低(P < 0.05);相较于ASP-H组,抑制剂组大鼠小肠组织细胞焦亡率升高(P < 0.05)。见图 2、表 1。
|
| A, sham group; B, model group; C, ASP-L group; D, ASP-M group; E, ASP-H group; F, inhibitor group. 图 2 大鼠小肠组织细胞焦亡TUNEL染色×200 Fig.2 Pyroptosis of rat small intestine cells TUNEL staining ×200 |
2.3 ASP对大鼠小肠组织中NLRP3表达的影响
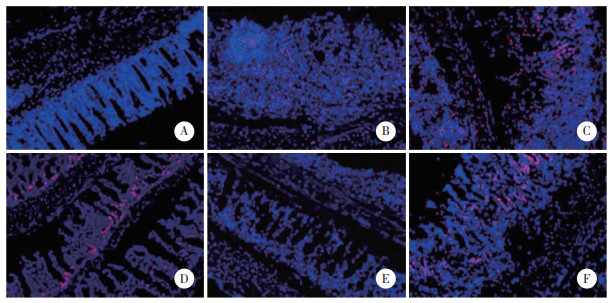
相较于Sham组,Model组大鼠小肠组织NLRP3表达升高(P < 0.05);相较于Model组,ASP-L、ASP-M、ASP-H组小肠组织NLRP3表达降低(P < 0.05);相较于ASP-H组,抑制剂组大鼠小肠组织NLRP3表达升高(P < 0.05)。见图 3、表 1。
|
| A, sham group; B, model group; C, ASP-L group; D, ASP-M group; E, ASP-H group; F, inhibitor group. 图 3 免疫组织化学检测小肠组织中NLRP3中表达×200 Fig.3 Expression of NLRP3 in small intestinal tissues detected by immunohistochemistry ×200 |
2.4 ASP对大鼠血清中IL-18、IL-1β水平的影响
相较于Sham组,Model组大鼠血清中IL-18、IL-1β水平升高(P < 0.05);相较于Model组,ASP-L、ASP-M、ASP-H组血清中IL-18、IL-1β水平降低(P < 0.05);相较于ASP-H组,抑制剂组大鼠血清中IL-18、IL-1β水平升高(P < 0.05)。见表 2。
| Group | n | IL-18(ng/L) | IL-1β(ng/L) |
| Sham | 12 | 45.37±4.18 | 24.76±2.09 |
| Model | 12 | 164.12±11.371) | 112.53±7.641) |
| ASP-L | 12 | 135.20±11.152) | 85.64±6.292) |
| ASP-M | 12 | 101.97±10.842),3) | 64.73±4.822),3) |
| ASP-H | 12 | 62.38±7.192),3),4) | 32.51±2.502),3),4) |
| Inhibitor | 12 | 124.65±12.185) | 74.39±8.055) |
| 1)P < 0.05 vs. sham group;2)P < 0.05 vs. model group;3)P < 0.05 vs. ASP-L group;4)P < 0.05 vs. ASP-M group;5)P < 0.05 vs. ASP-H group. | |||
2.5 ASP对大鼠小肠组织中DAO、iFABP的影响
相较于Sham组,Model组大鼠小肠组织中DAO、iFABP水平升高(P < 0.05);相较于Model组,ASP-L、ASP-M、ASP-H组大鼠小肠组织中DAO、iFABP水平降低(P < 0.05);相较于ASP-H组,抑制剂组大鼠小肠组织中DAO、iFABP水平升高(P < 0.05)。见表 3。
| Group | n | DAO(ng/mL) | iFABP(ng/mL) |
| Sham | 6 | 28.94±3.56 | 2.05±0.31 |
| Model | 6 | 167.31±11.481) | 15.78±2.041) |
| ASP-L | 6 | 125.82±10.642) | 12.35±1.762) |
| ASP-M | 6 | 89.45±6.732),3) | 8.41±1.202),3) |
| ASP-H | 6 | 42.59±5.282),3),4) | 3.79±1.122),3),4) |
| inhibitor | 6 | 117.41±9.505) | 10.64±1.355) |
| 1)P < 0.05 vs. sham group;2)P < 0.05 vs. model group;3)P < 0.05 vs. ASP-L group;4)P < 0.05 vs. ASP-M group;5)P < 0.05 vs. ASP-H group. | |||
2.6 ASP对大鼠小肠组织中焦亡相关蛋白、p-AMPK/AMPK蛋白表达的影响
相较于Sham组,Model组大鼠GSDMD、ASC、cleaved caspase-1表达升高,p-AMPK/AMPK表达降低(P < 0.05);相较于Model组,ASP-L、ASP-M、ASP-H组大鼠GSDMD、ASC、cleaved caspase-1表达降低,p-AMPK/AMPK表达升高(P < 0.05);相较于ASP-H组,抑制剂组大鼠GSDMD、ASC、cleaved caspase-1表达升高,p-AMPK/AMPK表达降低(P < 0.05)。见图 4、表 4。
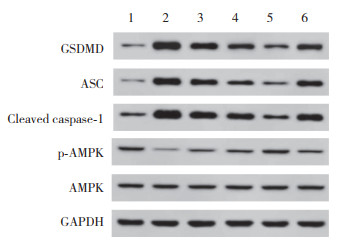
|
| 1,sham group;2,model group;3,ASP-L group;4,ASP-M group;5,ASP-H group;6,inhibitor group. 图 4 各组大鼠小肠组织中焦亡相关蛋白及p-AMPK/AMPK蛋白比较 Fig.4 Comparison of focal-death-related proteins and p-AMPK/AMPK proteins in rats small intestinal tissues of each group |
| Group | GSDMD/GAPDH | ASC/GAPDH | Cleaved caspase-1/GAPDH | p-AMPK/AMPK |
| Sham | 0.23±0.05 | 0.13±0.05 | 0.41±0.07 | 0.98±0.07 |
| Model | 1.78±0.141) | 1.54±0.121) | 1.89±0.151) | 0.10±0.021) |
| ASP-L | 1.46±0.132) | 1.19±0.112) | 1.42±0.132) | 0.35±0.052) |
| ASP-M | 0.98±0.112),3) | 0.78±0.092),3) | 1.06±0.112),3) | 0.59±0.072),3) |
| ASP-H | 0.57±0.082),3),4) | 0.32±0.062),3),4) | 0.59±0.072),3),4) | 0.96±0.082),3),4) |
| inhibitor | 1.23±0.125) | 0.96±0.105) | 1.34±0.125) | 0.41±0.065) |
| 1)P < 0.05 vs. sham group;2)P < 0.05 vs. model group;3)P < 0.05 vs. ASP-L group;4)P < 0.05 vs. ASP-M group;5)P < 0.05 vs. ASP-H group. | ||||
3 讨论
胃肠道在脓毒症疾病进展过程中最早受累,其损伤可加重患者病情,导致多脏器功能损害。尽管近年来在抗感染治疗和器官功能支持技术方面取得了重大进展,但脓毒症的致死率仍然很高[13]。因此,深入研究脓毒症诱导的肠道损伤机制有利于在临床上提高脓毒症患者的生存率。
ASP是当归的主要水溶性成分,由于其优良的药理作用和低毒性,在过去的几十年里得到广泛关注。研究[14]发现,ASP可通过降低IL-6、肿瘤坏死因子-α、IL-1β水平抑制炎症反应,从而显著改善葡聚糖硫酸钠诱导的实验性小鼠结肠炎。ASP可以减轻辐射诱导的大鼠肠绒毛糜烂、坏死甚至脱落,明显改善大鼠肠道屏障损伤[5]。ASP通过调节Cldn5的表达恢复类风湿性关节炎诱导的肠道功能障碍[15]。本研究结果显示,经ASP干预后脓毒症大鼠肠道组织的完整性和绒毛结构逐渐恢复,炎症细胞浸润依次减轻,血清炎性细胞因子IL-18、IL-1β水平、小肠组织细胞Chiu评分显著降低,提示ASP可能通过抑制炎症减轻脓毒症大鼠肠道损伤。脓毒症是感染后的全身性炎症反应,可累及肠道,从而影响肠黏膜的保护屏障功能。DAO是一种在小肠黏膜和纤毛上皮细胞中发现的细胞内酶,可促进细胞修复并保护肠黏膜,当小肠黏膜屏障受损时,其表达水平增加。因此,DAO的活性可能反映肠道损伤的程度[16]。iFABP特异性大量存在于小肠组织黏膜层的上皮细胞中,黏膜损伤后,iFABP迅速释放到循环中,可作为肠上皮细胞损伤的指标[16]。在本研究中,ASP可显著降低脓毒症大鼠小肠组织中DAO、iFABP水平,提示ASP可作为改善脓毒症肠道损伤的潜在治疗药物。
细胞焦亡激活的增加在脓毒症的发生和发展中发挥关键作用。NLRP3炎症小体是参与细胞焦亡的关键信号通路。焦亡过程中ASC将caspase-1前体募集到NLRP3炎症小体上,引起caspase-1活化,caspase-1的激活导致GSDMD裂解,形成膜孔后从胞质溶胶中释放炎性细胞因子,包括IL-1β和IL-18等[17]。研究[8, 18]发现,脓毒症期间通过减少细胞焦亡,可以保护肠细胞免受损伤。抑制NLRP3炎症小体可预防脓毒症诱发的心肌病[19]。研究[9, 20]显示,AMPK和NLRP3炎症小体信号之间似乎存在联系,激活AMPK可抑制NLRP3炎症小体,从而抑制炎症,减轻肺组织、心肌组织细胞凋亡,进而缓解脓毒症诱导的急性肺损伤。本研究结果显示,在脓毒症大鼠小肠组织中NLRP3、GSDMD、ASC、cleaved caspase-1表达升高,p-AMPK/AMPK表达降低。ASP可降低脓毒症大鼠小肠组织中焦亡相关蛋白表达,促进p-AMPK/AMPK表达。而AMPK抑制剂可减弱ASP对小肠组织细胞焦亡的抑制作用,加重肠道损伤。提示ASP可通过活化AMPK阻碍NLRP3炎症小体的激活,进而抑制caspase-1活化和GSDMD表达,导致促炎细胞因子释放减少,最终达到抑制焦亡,减轻脓毒症大鼠肠道损伤的目的。
综上所述,ASP可通过活化AMPK阻碍NLRP3炎症小体的激活,进而抑制焦亡,减轻脓毒症大鼠肠道损伤。然而,ASP对脓毒症大鼠肠道损伤的改善作用也可能涉及其他机制,需在未来的研究中进一步阐明。
| [1] |
ZAMPIERI FG, BAGSHAW SM, SEMLER MW. Fluid therapy for critically ill adults with sepsis: a review[J]. JAMA, 2023, 329(22): 1967-1980. DOI:10.1001/jama.2023.7560 |
| [2] |
ARORA J, MENDELSON AA, FOX-ROBICHAUD A. Sepsis: network pathophysiology and implications for early diagnosis[J]. Am J Physiol Regul Integr Comp Physiol, 2023, 324(5): R613-R624. DOI:10.1152/ajpregu.00003.2023 |
| [3] |
PAK S, THAPA B, LEE K. Decursinol angelate mitigates sepsis induced by methicillin-resistant Staphylococcus aureus infection by modulating the inflammatory responses of macrophages[J]. Int J Mol Sci, 2021, 22(20): 10950. DOI:10.3390/ijms222010950 |
| [4] |
NAI JJ, ZHANG C, SHAO HL, et al. Extraction, structure, pharmacological activities and drug carrier applications of Angelica sinensis polysaccharide[J]. Int J Biol Macromol, 2021, 183: 2337-2353. DOI:10.1016/j.ijbiomac.2021.05.213 |
| [5] |
张利英, 卢志伟, 许小敏, 等. 当归多糖对辐射诱发SD大鼠肠道屏障损伤的防护作用研究[J]. 时珍国医国药, 2020, 31(12): 2847-2850. DOI:10.3969/j.issn.1008-0805.2020.12.008 |
| [6] |
WANG Z, LI CH, HE X, et al. Platycodon grandiflorum root fermentation broth reduces inflammation in a mouse IBD model through the AMPK/NF-κB/NLRP3 pathway[J]. Food Funct, 2022, 13(7): 3946-3956. DOI:10.1039/D1FO03969E |
| [7] |
SINGLA S, JENA G. Studies on the mechanism of local and extra- intestinal tissue manifestations in AOM-DSS-induced carcinogenesis in BALB/c mice: role of PARP-1, NLRP3, and autophagy[J]. Naunyn Schmiedebergs Arch Pharmacol, 2024, 397(6): 4321-4337. DOI:10.1007/s00210-023-02878-8 |
| [8] |
陈浩, 李慧利, 杜亮, 等. 右美托咪定通过Akt/mTOR自噬通路介导NLRP3炎症小体失活而减轻脓毒症大鼠肠损伤[J]. 中国病理生理杂志, 2021, 37(9): 1582-1588. DOI:10.3969/j.issn.1000-4718.2021.09.006 |
| [9] |
LIU BH, WANG Z, HE RY, et al. Buformin alleviates sepsis-induced acute lung injury via inhibiting NLRP3-mediated pyroptosis through an AMPK-dependent pathway[J]. Clin Sci, 2022, 136(4): 273-289. DOI:10.1042/CS20211156 |
| [10] |
万红波, 郑永丽, 梁燕, 等. 当归多糖对慢性肾功能衰竭大鼠肾组织NLRP3炎症体信号通路的影响[J]. 河南医学研究, 2023, 32(6): 1000-1005. DOI:10.3969/j.issn.1004-437X.2023.06.010 |
| [11] |
邓宏哲, 陈昆, 李鹏, 等. 人参皂苷Rg1通过调控AMPK/NLRP3通路介导的细胞焦亡抑制大鼠肺纤维化研究[J]. 中草药, 2023, 54(3): 841-848. DOI:10.7501/j.issn.0253-2670.2023.03.018 |
| [12] |
楼屹, 朱之青, 谢莉莉, 等. 电针"足三里" 对脓毒症大鼠肠黏膜免疫屏障的影响及机制研究[J]. 针刺研究, 2022, 47(5): 386-392. DOI:10.13702/j.1000-0607.20210580 |
| [13] |
LIU D, HUANG SY, SUN JH, et al. Sepsis-induced immunosuppression: mechanisms, diagnosis and current treatment options[J]. Mil Med Res, 2022, 9(1): 56. DOI:10.1186/s40779-022-00422-y |
| [14] |
CHENG F, ZHANG Y, LI Q, et al. Inhibition of dextran sodium sulfate-induced experimental colitis in mice by Angelica sinensis polysaccharide[J]. J Med Food, 2020, 23(6): 584-592. DOI:10.1089/jmf.2019.4607 |
| [15] |
HU Q, WU CY, YU JT, et al. Angelica sinensis polysaccharide improves rheumatoid arthritis by modifying the expression of intestinal Cldn5, Slit3 and Rgs18 through gut microbiota[J]. Int J Biol Macromol, 2022, 209(Pt A): 153-161. DOI:10.1016/j.ijbiomac.2022.03.090 |
| [16] |
HUANG N, WEI Y, LIU M, et al. Dachaihu decoction ameliorates septic intestinal injury via modulating the gut microbiota and glutathione metabolism as revealed by multi-omics[J]. J Ethnopharmacol, 2023, 312: 116505. DOI:10.1016/j.jep.2023.116505 |
| [17] |
ZHANG SY, GUAN XM, LIU W, et al. YTHDF1 alleviates sepsis by upregulating WWP1 to induce NLRP3 ubiquitination and inhibit caspase-1-dependent pyroptosis[J]. Cell Death Discov, 2022, 8(1): 244. DOI:10.1038/s41420-022-00872-2 |
| [18] |
WANG HZ, ZHANG SW, ZHAO HJ, et al. Carbon monoxide inhibits the expression of proteins associated with intestinal mucosal pyroptosis in a rat model of sepsis induced by cecal ligation and puncture[J]. Med Sci Monit, 2020, 26: e920668. DOI:10.12659/MSM.920668 |
| [19] |
BUSCH K, KNY M, HUANG N, et al. Inhibition of the NLRP3/IL-1β axis protects against sepsis-induced cardiomyopathy[J]. J Cachexia Sarcopenia Muscle, 2021, 12(6): 1653-1668. DOI:10.1002/jcsm.12763 |
| [20] |
LUO MH, PENG YC, LV DY, et al. LncRNA GAS5 downregulates NLRP3 inflammasome activation-mediated pyroptosis in sepsis-induced myocardial injury by targeting SIRT3/AMPKα[J]. Heliyon, 2023, 9(12): e22939. DOI:10.1016/j.heliyon.2023.e22939 |
 2024, Vol. 53
2024, Vol. 53