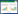文章信息
- 修银玲, 于月新, 孙凯旋, 周静, 赵盼盼, 徐金龙
- XIU Yinling, YU Yuexin, SUN Kaixuan, ZHOU Jing, ZHAO Panpan, XU Jinlong
- 白藜芦醇通过miR-23a靶向XIAP-caspase-3信号通路影响小鼠卵巢功能
- miR-23a targets the XIAP-caspase-3 signaling pathway to contribute to the effects of resveratrol on ovarian function in mice
- 中国医科大学学报, 2024, 53(11): 1031-1035
- Journal of China Medical University, 2024, 53(11): 1031-1035
-
文章历史
- 收稿日期:2024-03-03
- 网络出版时间:2024-11-21 10:41:36
2. 中国人民解放军联勤保障部队第九六九医院药剂科, 呼和浩特 010051
2. Pharmacy Department, The 969th Hospital of PLA Joint Logistic Support Force, Hohhot 010051, China
卵巢早衰(premature ovarian failure,POF)指卵巢功能衰竭导致的40岁前闭经的现象。POF的特征是卵母细胞的数量和质量下降,女性不孕症可由POF引起,POF作为一种严重的内分泌紊乱,如不治疗,对患者的身心健康影响较大[1]。目前,POF的分子机制和防治方法尚不明确。白藜芦醇(resveratrol,RES)是一种存在于多种天然食用植物中的非黄酮类多酚化合物,在花生、浆果、虎杖等植物中含量丰富。已有研究[2]表明,RES具有广泛的药理活性,如抗肿瘤、抗炎、抗氧化、免疫调节、细胞保护、抗凋亡等。研究[3]报道,RES可以通过降低黄体生成素(luteinizing hormone,LH)、LH/卵泡刺激素(follicle-stimulating hormone,FSH)比值和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平来改善卵泡发育。全面了解这些因素及其作用机制,对延长生殖寿命和改善女性健康至关重要。
卵巢颗粒细胞的DNA损伤增加和修复减少与原发性卵巢功能不全密切相关。DNA受损的卵母细胞耗竭是通过不同的细胞死亡机制发生的,如卵母细胞中异常染色质结构和DNA甲基化增加、自噬抑制和焦亡的激活等[4]。微RNA(microRNA,miRNA)是生物医学研究的热点,miRNA降解减少和稳定性增加可能导致细胞毒性和卵泡闭锁。多项研究[5]指出,miR-22-3p参与调节FSH的合成和分泌,与FSH表达水平呈负相关,miR-22-3p表达减少或突变可诱发POF。对miRNA进行研究,将有助于发现新的POF致病原因或信号通路[6]。因此,本研究通过检测miR-23a和X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)-caspase-3信号通路,分析RES对小鼠卵巢功能的影响,探讨RES在POF发生和发展中的作用机制。
1 材料与方法 1.1 实验动物和分组SPF级8周龄雌性C57/BL6小鼠30只,体重(20±0.5)g,由辽宁长生生物技术股份有限公司提供[SCXK(辽)2021-001]。将小鼠分为对照组、模型组(POF组)和干预组(RES组),每组10只。POF组和RES组小鼠经腹腔注射环磷酰胺(120 mg/kg)和丁磺芬(30 mg/kg),建立POF模型。RES组小鼠在造模的同时,将RES(20 mg/kg)溶解于生理盐水,灌胃给药28 d。对照组小鼠不做处理。
4周后,脱颈椎处死小鼠,测量并记录小鼠的体重和卵巢重量。计算卵巢指数,卵巢指数=卵巢重量/小鼠体重。
本研究经中国人民解放军北部战区总医院动物医学研究伦理委员会批准。
1.2 HE染色观察卵巢组织取小鼠卵巢组织,福尔马林固定48 h后,脱水、石蜡包埋、制成5 μm切片,进行HE染色,观察卵巢组织的形态特征。
1.3 实时定量PCR检测miR-23a、XIAP和caspase-3 mRNA表达采用TRIzol试剂提取卵巢总RNA,采用Prime Script RT Reagent Kit(日本TaKaRa公司),通过逆转录获得cDNA,采用TB Green® Premix Ex TaqTM Ⅱ(日本TaKaRa公司)进行实时定量PCR。引物序列:miR-23a,正向5’-GGCATCACATTGCCAGGG-3’,反向5’-AGTGCAGGGTCCGAGGTATT-3’;XIAP,正向5’-GGAGGGCTCACGGATTGG-3’,反向5’-TCAGCAGTTCTTCCCAAAGAT-3’;caspase-3,正向5’-AGAGACATTCATGGGCCTGAAATAC-3’,反向5’-CACCATGGCTTAGAATCACACACAC-3’;GAPDH,正向5’-GTCCCTAGACAAAACGAGCGT-3’,反向5’-TGTCTCCACTCATAGGTTGTTG-3’。
1.4 Western blotting检测XIAP和caspase-3蛋白表达取各组小鼠卵巢组织50 μg,RIPA裂解液提取总蛋白,BCA蛋白定量试剂盒(新赛美生物科技有限公司)检测总蛋白浓度。SDS-PAGE后转移到PVDF膜上,5%脱脂奶粉封闭1 h后加入一抗,4 ℃孵育过夜,将膜清洗3次,二抗室温孵育2 h。采用凝胶图像分析成像系统进行扫描分析,结果以目的蛋白相对表达量表示,目的蛋白相对表达量=目的蛋白灰度值/GAPDH灰度值。
1.5 统计学分析采用SPSS 22.0软件进行数据分析,数据用x±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 小鼠体重、卵巢重量和卵巢指数的比较与对照组比较,POF组小鼠体重明显增加,卵巢质量和卵巢指数明显下降(P < 0.05);RES组与POF组比较,小鼠体重无统计学差异(P > 0.05),RES组小鼠卵巢质量和卵巢指数明显高于POF组(P < 0.05)。见表 1。
| Group | n | Body weight(g) | Ovarian mass(g) | Ovarian index |
| Control | 10 | 25.13±0.96 | 0.028±0.002 | 0.000 8±0.000 05 |
| POF | 10 | 25.42±0.661) | 0.006±0.0011) | 0.000 2±0.000 041) |
| RES | 10 | 24.99±0.78 | 0.023±0.0022) | 0.000 9±0.000 072) |
| 1)P < 0.05 vs. control group;2)P < 0.05 vs. POF group. | ||||
2.2 小鼠卵巢组织的病理变化
HE染色结果显示,与对照组比较,POF组小鼠原始卵泡数量减少;与POF组比较,RES组小鼠原始卵泡数量增加。见图 1。
|
| A, control group; B, POF group; C, RES group. Arrows indicate ovarian follicles. 图 1 RES对小鼠卵巢组织的影响 HE×20 Fig.1 Effect of resveratrol on mouse ovarian tissue HE×200 |
2.3 卵巢组织中miR-23a、XIAP和caspase-3 mRNA表达的比较
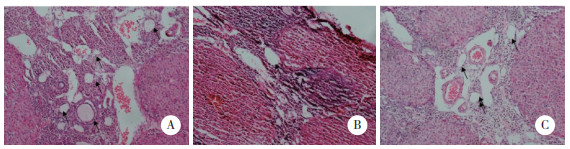
与对照组比较,POF组小鼠卵巢组织中miR-23a和caspase-3 mRNA表达水平明显升高(P < 0.05),XIAP mRNA表达水平明显降低(P < 0.05);与POF组比较,RES组小鼠卵巢组织中miR-23a和caspase-3 mRNA表达水平明显降低(P < 0.05),XIAP mRNA表达水平明显升高(P < 0.05)。见图 2。
|
| A, miR-23a mRNA; B, XIAP mRNA; C, caspase-3 mRNA. * P < 0.05 vs. control group; # P < 0.05 vs. POF group. 图 2 小鼠卵巢组织中miR-23a、XIAP和caspase-3 mRNA的相对表达水平 Fig.2 Relative expression levels of miR-23a, XIAP, and caspase-3 mRNA in mouse ovarian tissue |
2.4 卵巢组织中XIAP和caspase-3蛋白表达的比较
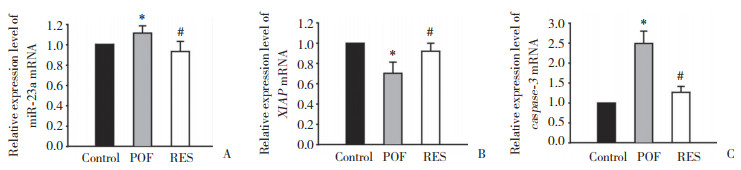
与对照组比较,POF组小鼠卵巢组织中XIAP蛋白表达水平明显降低(P < 0.05),caspase-3蛋白表达水平明显升高(P < 0.05);与POF组比较,RES组小鼠卵巢组织中XIAP蛋白表达水平明显升高(P < 0.05),caspase-3蛋白表达水平明显降低(P < 0.05)。见图 3。
|
| A, representative Western blotting; B, relative gray values for XIAP and caspase-3. 1, control group; 2, POF group; 3, RES group.* P < 0.05 vs. control group; # P < 0.05 vs. POF group. 图 3 RES对小鼠卵巢组织中XIAP和caspase-3蛋白表达水平的影响 Fig.3 Effect of resveratrol on the expression of XIAP and caspase-3 proteins in mouse ovarian tissue |
3 讨论
卵巢衰老指卵巢中剩余的卵母细胞发生数量和质量的退化,表现为月经周期紊乱甚至闭经,生育力逐渐下降至彻底丧失,并伴有全身各系统相关疾病的发生和发展,最终进展为绝经。卵巢衰老根据病因可分为生理性和病理性2种类型。生理性卵巢衰老是女性的一种正常生理过程,即卵巢功能随着年龄增长出现的渐进性衰退。病理性卵巢衰老即POF,是在遗传、环境、免疫、氧化应激或某些外伤的影响下出现的卵巢功能异常减退,可发生在 < 40岁的女性中,其发病率占成年女性的1%~3%[7]。与平均年龄为51岁的自然绝经期女性相比,POF患者出现心血管、骨骼、认知和生殖健康长期恶化的风险明显更高,且生育率降低。因此,探究POF的病因及发病机制至关重要,能够为POF患者提供新的潜在治疗选择,延长其生殖寿命,提高生育能力。
本研究选用8周龄雌性C57/BL6小鼠,通过腹腔注射环磷酰胺和丁磺芬的方法建立POF模型。第4周末时,POF组小鼠卵巢出现损伤,卵巢重量和卵巢指数均低于对照组;HE染色结果显示,与对照组比较,POF组小鼠原始卵泡数量减少。这些结果证明小鼠出现明显的卵巢功能受损,提示POF模型制备成功。
本研究中,与POF组比较,RES组小鼠卵巢组织中miR-23a、caspase-3 mRNA表达水平明显降低,XIAP mRNA表达水平明显升高;XIAP蛋白表达水平明显升高,caspase-3蛋白表达水平明显降低。已有研究[8-9]报道,RES可能恢复卵巢功能,但其具体机制尚不明确。RES可能会影响与细胞死亡相关的各种信号通路,它可以诱导死亡信号,并下调抗凋亡基因的表达[10]。本研究证实了RES在POF中的有益作用。本研究结果显示,20 mg/kg RES干预后,小鼠卵巢重量、卵巢指数和原始卵泡数量均明显增加,提示RES可以缓解POF小鼠的卵巢功能异常。
POF患者差异表达的miRNA可能通过影响不同的信号通路,调控颗粒细胞的增殖和凋亡。研究[11]表明,miR-23a可能通过降低人卵巢颗粒细胞中XIAP的表达,从而调节细胞凋亡,在POF中发挥重要作用。XIAP是新发现的一个凋亡抑制蛋白家族中的主要成员,作为凋亡信号传导最后步骤的抑制物和调节物,可在半胱氨酸蛋白酶的激活水平起作用,也可直接抑制caspase,通过多种途径参与调节细胞凋亡。动物实验发现,XIAP是miR-23a的靶基因,且在缺血的脑细胞中,miR-23a通过结合XIAP的3’非翻译区来抑制其表达。细胞转染实验发现,miR-23a表达降低可促进XIAP的表达,两者呈显著负相关,提示miR-23a可能负向调控XIAP蛋白的表达[12-13]。XIAP对caspase活性具有重要的保守抑制作用。目前,已对其广泛的细胞途径和机制进行了大量的实验研究,结果表明,XIAP作为细胞死亡的关键分子,不仅可以抑制caspase和凋亡,还可以调节炎症信号、促分裂激酶信号、细胞增殖以及细胞侵袭和转移。XIAP由一种罕见的帽非依赖性机制翻译,该机制由被称为内部核糖体进入位点的特定序列介导,该序列存在于XIAP的5’非翻译区中。因此,XIAP蛋白参与细胞凋亡,抑制caspase-3表达[14-15]。本研究通过实时定量PCR检测miR-23a、XIAP和caspase-3 mRNA表达,结果显示,与对照组比较,POF组小鼠卵巢组织中miR-23a和caspase-3 mRNA表达水平明显升高,XIAP mRNA表达水平明显降低,提示POF可能诱发了卵巢颗粒细胞的凋亡。为了进一步观察POF小鼠卵巢组织中的凋亡现象,本研究检测了卵巢组织中XIAP和caspase-3蛋白的表达。结果显示,与对照组比较,POF组小鼠卵巢组织中XIAP蛋白表达水平明显降低,caspase-3蛋白表达水平明显升高,提示POF导致卵巢组织出现明显的凋亡现象。本研究结果还显示,在20 mg/kg RES腹腔注射干预后,上述凋亡相关蛋白的表达可被明显逆转。
综上所述,RES对POF小鼠具有保护作用,其机制可能与调控miR-23a靶向XIAP-caspase-3信号通路、抑制卵巢细胞凋亡、促进卵巢功能恢复有关。
| [1] |
赵达, 包利利, 王晓黎, 等. 脂肪间充质干细胞对卵巢早衰小鼠卵巢内分泌功能及颗粒细胞凋亡的影响[J]. 医学研究杂志, 2023, 52(8): 173-177. DOI:10.11969/j.issn.1673-548X.2023.08.034 |
| [2] |
LI T, CHEN LL, YU YY, et al. Resveratrol alleviates hypoxia/reoxygenation injury-induced mitochondrial oxidative stress in cardiomyo-cytes[J]. Mol Med Rep, 2019, 19(4): 2774-2780. DOI:10.3892/mmr.2019.9943 |
| [3] |
ASHKAR F, EFTEKHARI MH, TANIDEH N, et al. Effect of hydroalcoholic extract of Berberis integerrima and resveratrol on ovarian morphology and biochemical parameters in Letrozole-induced polycystic ovary syndrome rat model: an experimental study[J]. Int J Reprod Biomed, 2020, 18(8): 637-650. DOI:10.18502/ijrm.v13i8.7505 |
| [4] |
TAKAHASHI A, YOUSIF A, HONG L, et al. Premature ovarian insufficiency: pathogenesis and therapeutic potential of mesenchymal stem cell[J]. J Mol Med (Berl), 2021, 99(5): 637-650. DOI:10.1007/s00109-021-02055-5 |
| [5] |
DANG Y, ZHAO S, QIN Y, et al. MicroRNA-22-3p is down-regulated in the plasma of Han Chinese patients with premature ovarian failure[J]. Fertil Steril, 2015, 103(3): 802-807.e1. DOI:10.1016/j.fertnstert.2014.12.106 |
| [6] |
HASSAN MQ, GORDON JA, BELOTI MM, et al. A network connecting Runx2, SATB2, and the miR-23a~27a~24-2 cluster regulates the osteoblast differentiation program[J]. Proc Natl Acad Sci U S A, 2010, 107(46): 19879-19884. DOI:10.1073/pnas.1007698107 |
| [7] |
闫丽, 王恺悦, 王喜良, 等. 戊酸雌二醇片/雌二醇环丙孕酮片对卵巢早衰小鼠激素水平和肠道菌群的调节作用[J]. 中国医科大学学报, 2023, 52(10): 898-903. DOI:10.12007/j.issn.0258-4646.2023.10.006 |
| [8] |
宋亭嶙, 方兰兰. 白藜芦醇调控卵巢功能作用的研究进展[J]. 生殖医学杂志, 2023, 32(7): 1127-1131. DOI:10.3969/j.issn.1004-3845.2023.07.025 |
| [9] |
BRENJIAN S, MOINI A, YAMINI N, et al. Resveratrol treatment in patients with polycystic ovary syndrome decreased pro-inflammatory and endoplasmic reticulum stress markers[J]. Am J Reprod Immunol, 2020, 83(1): e13186. DOI:10.1111/aji.13186 |
| [10] |
FU X, LI M, TANG C, et al. Targeting of cancer cell death mechanisms by resveratrol: a review[J]. Apoptosis, 2021, 26(11/12): 561-573. DOI:10.1007/s10495-021-01689-7 |
| [11] |
YANG X, ZHOU Y, PENG S, et al. Differentially expressed plasma microRNAs in premature ovarian failure patients and the potential regulatory function of mir-23a in granulosa cell apoptosis[J]. Reproduction, 2012, 144(2): 235-244. DOI:10.1530/REP-11-0371 |
| [12] |
SIEGEL C, LI J, LIU F, et al. miR-23a regulation of X-linked inhibitor of apoptosis (XIAP) contributes to sex differences in the response to cerebral ischemia[J]. Proc Natl Acad Sci U S A, 2011, 108(28): 11662-11667. DOI:10.1073/pnas.1102635108 |
| [13] |
HUANG X, WU Z, MEI Y, et al. XIAP inhibits autophagy via XIAP-Mdm2-p53 signalling[J]. EMBO J, 2013, 32(16): 2204-2216. DOI:10.1038/emboj.2013.133 |
| [14] |
朱阳萍, 俞沁玮, 张陆勇, 等. X连锁凋亡抑制蛋白在肝细胞癌中的研究进展[J]. 临床合理用药, 2023, 16(31): 178-181. DOI:10.15887/j.cnki.13-1389/r.2023.31.052 |
| [15] |
肖贵华, 彭星辰. 缺氧诱导因子-1α与X染色体连锁凋亡抑制蛋白在人卵巢癌中的表达及意义[J]. 实用医院临床杂志, 2023, 20(6): 104-108. DOI:10.3969/j.issn.1672-6170.2023.06.025 |
 2024, Vol. 53
2024, Vol. 53