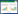文章信息
- 杨微微, 苏玉铭, 吴彬, 孙溶励, 李男
- YANG Weiwei, SU Yuming, WU Bin, SUN Rongli, LI Nan
- 苏木酮A通过铁死亡对高脂饮食诱导的大鼠心肌脂毒性的保护作用
- Protective effect of sappanone A on high-fat diet-induced myocardial lipotoxicity through ferroptosis in rats
- 中国医科大学学报, 2024, 53(11): 1017-1024
- Journal of China Medical University, 2024, 53(11): 1017-1024
-
文章历史
- 收稿日期:2024-06-12
- 网络出版时间:2024-11-21 10:39:17
2. 锦州医科大学附属第一医院临床生物样本中心,辽宁 锦州 121001;
3. 锦州医科大学附属第一医院重症医学科,辽宁 锦州 121001
2. Clinical Biological Sample Center, The First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121001, China;
3. Department of Critical Care Medicine, The First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121001, China
脂肪酸氧化是心肌组织的重要能源供给来源,在肥胖症和糖尿病患者的外周血中,游离脂肪酸的含量明显增加,其代谢紊乱会引起心肌细胞中大量脂质及其氧化的中间产物聚集,从而引起心肌细胞脂肪变性[1]。心肌细胞脂肪变性可进一步造成心脏功能障碍,最终导致心力衰竭,这一病理生理过程被称为心肌脂毒性[2]。目前,尚无明确药物治疗心肌脂毒性。因此,明确心肌脂毒性的作用机制并寻找有效的治疗药物,是目前主要的研究方向。
苏木酮A(sappanone A,SA)是从我国传统中药材干苏木中提取的一种新型异黄酮化合物,是苏木抗氧化、抗炎的主要有效成分之一[3]。最近的研究[4]发现,SA对心肌缺血再灌注损伤显示出良好的疗效。SA对高脂饮食导致的心肌脂毒性是否同样具有保护作用值得关注。多项研究[5]结果证实,铁死亡与心血管疾病的发生密切相关,铁死亡改变了心肌的结构和功能,有望成为心肌脂毒性的干预靶点。本研究通过动物实验探讨了SA能否通过铁死亡参与心肌脂毒性,以期为治疗心肌脂毒性提供新的实验证据和手段。
1 材料与方法 1.1 实验动物56只雄性、健康、清洁级的Wistar大鼠,体重150~170 g,购于北京维通利华实验动物技术有限公司。高脂饲料和普通维持饲料,购于北京科澳协力饲料有限公司。日常更换的大鼠垫料,由锦州医科大学实验动物中心提供。本研究的实验动物方案通过锦州医科大学实验动物伦理委员会的审核批准(编号:20220301001)。
1.2 实验方法 1.2.1 心肌脂毒性大鼠模型的建立将16只健康雄性大鼠分为正常饮食组(NCD组)和模型组,每组8只。NCD组使用普通维持饲料连续喂养大鼠20周,保证12 h光照/12 h黑暗的昼夜节律,动物室温度控制在22~24 ℃,大鼠自由摄取清洁饮用水,每隔2 d更换1次垫料。模型组使用高脂饲料连续喂养大鼠20周,其他条件与NCD组一致。通过超声心动图、HE染色、Masson染色、天狼星红染色和TUNEL染色,验证心肌损伤。
1.2.2 SA对心肌脂毒性大鼠心肌的作用为了明确SA在心肌脂毒性中的保护作用,按照上述条件再次构建心肌脂毒性大鼠模型。将40只健康雄性大鼠分为高脂饮食组(HFD组)、高脂饮食+生理盐水组(HFD+saline组)、高脂饮食+低剂量SA组(HFD+10 mg/kg SA组)、高脂饮食+中剂量SA组(HFD+20 mg/kg SA组)、高脂饮食+高剂量SA组(HFD+40 mg/kg SA组)。HFD组使用高脂饲料连续喂养大鼠20周;HFD+saline组使用高脂饲料连续喂养大鼠12周后,于第13周起用生理盐水灌胃,1次/d,1 mL/次,持续8周,在此期间继续使用高脂饲料喂养大鼠直至20周结束;HFD+10 mg/kg SA组、HFD+20 mg/kg SA组、HFD+40 mg/kg SA组使用高脂饲料连续喂养大鼠12周后,于第13周起分别用含10、20、40 mg/kg SA的生理盐水灌胃,1次/d,1 mL/次,持续8周,在此期间继续使用高脂饲料喂养大鼠直至20周结束。
1.2.3 心脏收缩功能的检测连续喂养大鼠20周后,在1%异氟烷吸入麻醉后将大鼠四肢固定,脱毛膏备皮完毕后使用彩色超声诊断仪(UMT-500,深圳迈瑞生物医疗电子股份有限公司)进行经胸超声心动图检查。测量左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左心室收缩末期内径(left ventricular end-systolic diameter,LVESD)、心室壁厚度(wall thickness,WT),计算短轴缩短率(fractional shortening,FS),FS(%)=(LVEDD-LVESD)/LVEDD×100。
1.2.4 心肌组织染色 1.2.4.1 心脏样本采集喂养20周后将大鼠处死,分离出左心室,留存备用。将大小约0.5 cm3的左心室心肌组织浸没于4%多聚甲醛溶液中固定,石蜡包埋盒固定并标记,脱水透明后包埋于石蜡中,并制成厚4 μm的石蜡切片备用。
1.2.4.2 染色按照试剂说明书进行HE、Masson、天狼星红以及TUNEL染色。HE染色后,计算心肌细胞横截面积,横截面积(μm2)=细胞(> 100个)的总面积/细胞数量。Masson染色后,计算心肌细胞纤维化百分率,纤维化百分率(%)=心肌细胞纤维化面积/心肌细胞总面积×100。天狼星红染色后,计算心肌细胞胶原纤维百分率,胶原纤维百分率(%)=心肌细胞胶原面积/心肌细胞总面积×100。TUNEL染色显示的正常细胞核呈蓝色,凋亡细胞核(TUNEL阳性)呈绿色。TUNEL染色后,计算心肌细胞凋亡率,凋亡率(%)=TUNEL阳性细胞数/细胞总数×100。
1.3 转录组测序对构建的心肌脂毒性大鼠模型的心脏组织进行转录组测序,比较HFD+20 mg/kg SA组和HFD组大鼠心肌中差异基因表达的情况,并通过京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析SA作用的信号通路。
1.4 统计学分析采用SPSS 25.0软件进行统计分析。计量资料用x±s表示,2组间比较采用Student t检验,多组间比较采用单因素方差分析,进一步组间两两比较采用LSD法。P < 0.05为差异有统计学意义。
2 结果 2.1 高脂饮食诱导的大鼠心肌损伤 2.1.1 高脂饮食对大鼠心脏收缩功能的影响经胸超声心动图检查结果显示,与NCD组相比,模型组大鼠的WT显著增加(P < 0.05),FS显著降低(P < 0.05),而LVESD、LVEDD的差异均无统计学意义(P > 0.05)。见表 1、图 1。
| Group | n | LVEDD(mm) | LVESD(mm) | WT(mm) | FS(%) |
| Model | 8 | 4.69±0.21 | 7.26±0.10 | 1.90±0.041) | 32.79±1.151) |
| NCD | 8 | 4.55±0.20 | 7.16±0.19 | 1.61±0.06 | 37.82±1.14 |
| LVEDD,left ventricular end-diastolic diameter;LVESD,left ventricular end-systolic diameter;WT,wall thickness;FS,fractional shortening. 1) P < 0.05 vs. NCD group. | |||||
|
| A, NCD group; B, model group. 图 1 超声心动图检测NCD组和模型组大鼠LVESD Fig.1 LVESD detected by echocardiography in rats of the NCD and model groups |
2.1.2 高脂饮食对大鼠心肌组织的影响
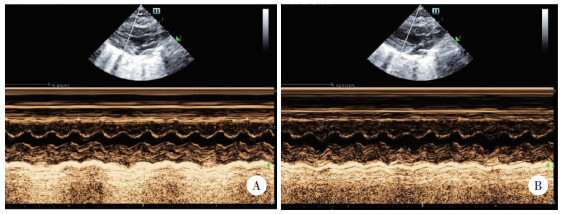
HE染色结果显示,模型组大鼠心肌细胞横截面积较NCD组显著增加(P < 0.05);Masson染色结果显示,模型组大鼠心肌细胞纤维化百分率较NCD组显著升高(P < 0.05);天狼星红染色结果显示,模型组大鼠心肌细胞胶原纤维百分率较NCD组显著升高(P < 0.05);TUNEL染色结果显示,模型组大鼠的心肌细胞凋亡率较NCD组显著升高(P < 0.05)。以上结果提示,高脂饮食对大鼠心肌组织损伤明确。见图 2。
|
| A, HE staining(×100);B, Masson staining(×200);C, Sirius red staining(×200);D, TUNEL staining(×200). * P < 0.05 vs. NCD group. 图 2 NCD组和模型组大鼠心肌细胞染色 Fig.2 Staining of rat myocardial cells in the NCD and model groups |
2.2 SA对高脂饮食诱导的心肌损伤的保护作用 2.2.1 SA对大鼠心脏收缩功能的影响
经胸超声心动图检查结果显示,与HFD组相比,HFD+10、20、40 mg/kg SA组WT出现不同程度的降低(P < 0.05);与HFD组相比,HFD+20、40 mg/kg SA组FS显著升高(P < 0.05),但LVESD、LVEDD的差异无统计学意义(P > 0.05)。
与HFD+10 mg/kg SA组相比,HFD+20、40 mg/kg SA组WT显著降低、FS显著升高(P < 0.05),提示心功能显著改善;而HFD+40 mg/kg SA组与HFD+20 mg/kg SA组比较,WT、FS的差异无统计学意义(P > 0.05),提示高剂量SA与中剂量SA对心功能的改善作用无明显差异。见表 2。
| Group | n | LVEDD(mm) | LVESD(mm) | WT(mm) | FS(%) |
| HFD group | 8 | 7.27±0.08 | 4.72±0.11 | 2.00±0.13 | 34.48±0.79 |
| HFD+saline group | 8 | 7.35±0.10 | 4.79±0.11 | 2.02±0.10 | 33.87±0.76 |
| HFD+10 mg/kg SA group | 8 | 7.36±0.18 | 4.76±0.20 | 1.82±0.061) | 34.07±0.54 |
| HFD+20 mg/kg SA group | 8 | 7.20±0.12 | 4.64±0.17 | 1.63±0.051),2) | 38.47±0.541),2) |
| HFD+40 mg/kg SA group | 8 | 7.24±0.14 | 4.59±0.13 | 1.65±0.061),2) | 38.45±0.611),2) |
| 1) P < 0.05 vs. HFD group;2) P < 0.05 vs. HFD+10 mg/kg SA group. | |||||
2.2.2 SA对大鼠心肌组织的影响
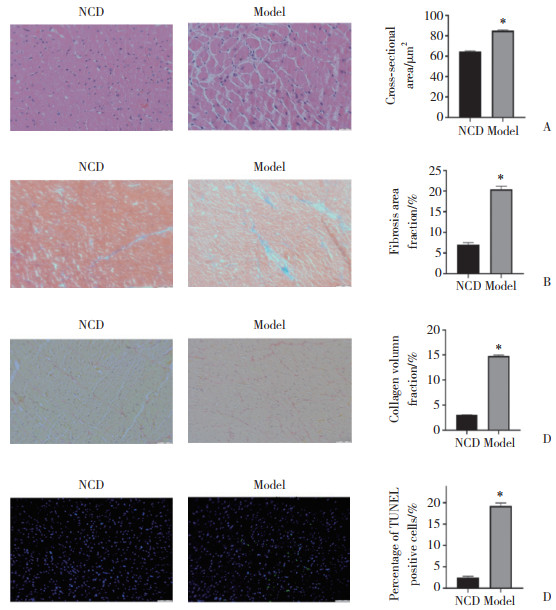
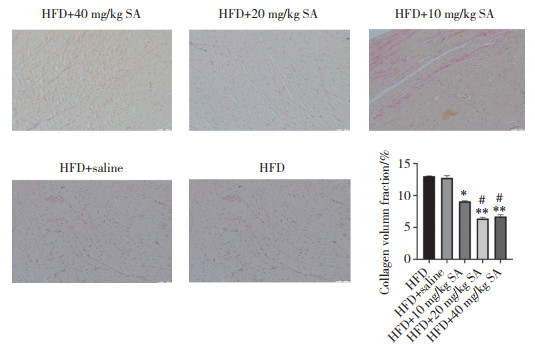
HE(图 3)、Masson(图 4)、天狼星红(图 5)以及TUNEL(图 6)染色结果显示,与HFD组相比,HFD+10、20、40 mg/kg SA组心肌细胞横截面积、心肌细胞纤维化百分率、心肌细胞胶原纤维百分率、心肌细胞凋亡率均显著降低(P < 0.05),且HFD+20、40 mg/kgSA组与HFD+10 mg/kg SA组比较,心肌细胞纤维化百分率、心肌细胞胶原纤维百分率、心肌细胞凋亡率均显著降低(P < 0.05)。但HFD+40 mg/kg SA组与HFD+20 mg/kg SA组比较,上述4项指标均无统计学差异(P > 0.05)。
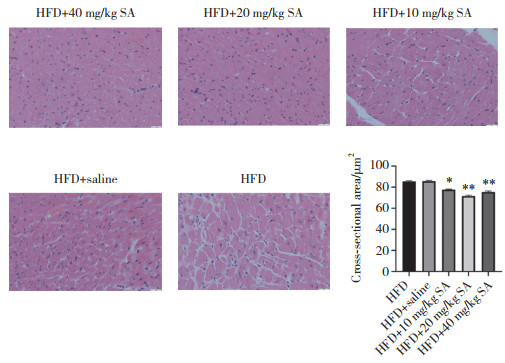
|
| *P < 0.05 vs. HFD group; **P < 0.01 vs. HFD group. 图 3 大鼠心肌组织HE染色 ×100 Fig.3 HE staining of the rat myocardium ×100 |

|
| *P < 0.05 vs. HFD group; **P < 0.01 vs. HFD group; # P < 0.05 vs. HFD+10 mg/kg SA group. 图 4 大鼠心肌组织Masson染色 ×200 Fig.4 Masson staining of the rat myocardium ×200 |
|
| *P < 0.05 vs. HFD group; **P < 0.01 vs. HFD group; # P < 0.05 vs. HFD+10 mg/kg SA group. 图 5 大鼠心肌组织天狼星红染色 ×200 Fig.5 Sirius red staining of the rat myocardium ×200 |

|
| *P < 0.05 vs. HFD group; **P < 0.01 vs. HFD group; # P < 0.05 vs. HFD+10 mg/kg SA group. 图 6 大鼠心肌组织TUNEL染色 ×200 Fig.6 TUNEL staining of the rat myocardium ×200 |
2.3 SA引起的大鼠心肌信号通路改变的富集分析
本研究结果提示,20、40 mg/kg SA的保护作用明显优于10 mg/kg SA,而40 mg/kg SA与20 mg/kg SA的作用无明显差异,因此选择20 mg/kg SA进行后续实验。为了揭示SA的作用机制,对HFD+20 mg/kg SA组和HFD组大鼠心肌组织进行测序,结果(图 7A)提示,显著上调的基因55个,显著下调的基因53个。KEGG信号通路分析结果(图 7B)显示,差异基因数目(Count值)排在前3位的信号通路分别为铁死亡、神经退行性疾病、阿尔茨海默病。

|
| A, heat maps of differential gene expression in the myocardium of the HFD+20 mg/kg SA and HFD groups; B, KEGG analysis of differentially expressed genes. 图 7 SA引起的大鼠心肌信号通路改变的富集分析 Fig.7 Enrichment analysis of myocardial signaling pathway changes induced by SA intervention |
3 讨论
长期高脂饮食诱发的代谢紊乱性疾病在我国和全世界已成为严重危害健康的公共卫生问题,这种饮食习惯常会因为游离脂肪酸浓度增加引发心肌脂毒性。目前,对于心肌脂毒性尚缺乏有效的药物治疗,寻找新的治疗方式已成为研究热点。本研究中超声心动图检查发现大鼠WT增加,心肌收缩功能降低,这与YANG等[6]的研究结果大致相同。然而,本研究并未发现大鼠心腔大小出现明显的变化,这与CAO等[7]的研究结果基本一致。另外,本研究发现高脂饮食喂养的大鼠出现明显的心肌肥厚、心肌纤维化和心肌细胞凋亡,这与KIM等[8]的研究结果一致。这些结果证实高脂饮食对心肌组织损伤明确,提示本研究造模结果稳定。
目前,临床长期应用的药物常出现不良反应,如肝肾功能损伤等。因此,药物研发逐渐转向天然植物,中药有望成为心肌脂毒性的重要治疗手段。研究[9-10]证实,SA对于预防骨质疏松和哮喘、抑制黑色素形成以及抑制病毒神经氨酸酶等均显示出良好的效果。研究[11]还发现,SA通过PI3K-Akt减轻缺血再灌注导致的心肌损伤,促进缺血导致的心脏功能异常的恢复。为了探索治疗高脂饮食诱导的心肌脂毒性的方法,本研究采用SA干预心肌脂毒性大鼠模型,发现SA可以改善高脂饮食诱导的心脏收缩功能障碍、心肌肥厚、心肌纤维化、心肌细胞凋亡,中剂量(20 mg/kg)SA的效果尤为明显。本研究结果证实,SA是一种具有抗心肌脂毒性的潜在化合物。
心肌脂毒性的发生机制十分复杂,包括信号通路[12]参与、非编码RNA介导的基因转录后调控[13]、炎症[14]等多个过程。为了明确SA对心肌脂毒性的保护机制,本研究对高脂饮食以及中剂量SA干预后的心肌脂毒性大鼠模型进行了测序分析。KEGG分析结果显示,铁死亡信号通路富集的差异基因数目最多。这一结果提示,SA对心肌脂毒性的保护作用可能是通过调控铁死亡实现的。铁死亡是近年发现的细胞死亡方式之一,在多种疾病中发挥重要作用[15]。多项研究结果证实,铁死亡可以作为心肌缺血、阿霉素诱导的心肌病、心力衰竭的干预靶点。特别值得注意的是,不饱和脂肪酸还可以诱导心肌细胞的铁死亡。由此可见,铁死亡可能是心肌脂毒性的干预靶点。
综上所述,本研究通过动物实验发现了SA在心肌脂毒性中具有保护作用,通过测序初步发现,SA对心肌脂毒性的保护机制可能是通过调控铁死亡来实现的。未来需要进行体外细胞实验,进一步明确SA的具体作用机制。
| [1] |
SLETTEN AC, PETERSON LR, SCHAFFER JE. Manifestations and mechanisms of myocardial lipotoxicity in obesity[J]. J Intern Med, 2018, 284(5): 478-491. DOI:10.1111/joim.12728 |
| [2] |
GIRONA J, SOLER O, SAMINO S, et al. Lipidomics reveals myocardial lipid composition in a murine model of insulin resistance induced by a high-fat diet[J]. Int J Mol Sci, 2024, 25(5): 2702. DOI:10.3390/ijms25052702 |
| [3] |
QI J, LI L, YAN X, et al. Sappanone A alleviates the severity of carbon tetrachloride-induced liver fibrosis in mice[J]. Antioxidants (Basel), 2023, 12(9): 1718. DOI:10.3390/antiox12091718 |
| [4] |
SHI X, LI Y, WANG Y, et al. Pharmacological postconditioning with sappanone A ameliorates myocardial ischemia reperfusion injury and mitochondrial dysfunction via AMPK-mediated mitochondrial qua- lity control[J]. Toxicol Appl Pharmacol, 2021, 427: 115668. DOI:10.1016/j.taap.2021.115668 |
| [5] |
WANG N, MA H, LI J, et al. HSF1 functions as a key defender against palmitic acid-induced ferroptosis in cardiomyocytes[J]. J Mol Cell Cardiol, 2021, 150: 65-76. DOI:10.1016/j.yjmcc.2020.10.010 |
| [6] |
YANG H, XIN X, YU H, et al. microRNA expression profiles in myocardium of high-fat diet-induced obesity rat[J]. Diabetes Metab Syndr Obes, 2020, 13: 1147-1159. DOI:10.2147/DMSO.S248948 |
| [7] |
CAO L, QIN X, PETERSON MR, et al. CARD9 knockout ameliorates myocardial dysfunction associated with high fat diet-induced obesity[J]. J Mol Cell Cardiol, 2016, 92: 185-195. DOI:10.1016/j.yjmcc.2016.02.014 |
| [8] |
KIM J, JOO S, EOM GH, et al. CCN5 knockout mice exhibit lipotoxic cardiomyopathy with mild obesity and diabetes[J]. PLoS One, 2018, 13(11): e0207228. DOI:10.1371/journal.pone.0207228 |
| [9] |
CHOO YY, TRAN PT, MIN BS, et al. Sappanone A inhibits RANKL- induced osteoclastogenesis in BMMs and prevents inflammation- mediated bone loss[J]. Int Immunopharmacol, 2017, 52: 230-237. DOI:10.1016/j.intimp.2017.09.018 |
| [10] |
CHANG TS, CHAO SY, DING HY. Melanogenesis inhibition by homoisoflavavone sappanone A from Caesalpinia sappan[J]. Int J Mol Sci, 2012, 13(8): 10359-10367. DOI:10.3390/ijms130810359 |
| [11] |
SHI X, TAO G, JI L, et al. Sappanone A alleviates hypoxia/reoxygena- tion-induced cardiomyocytes injury through inhibition of mitochondrial apoptosis and activation of PI3K-Akt-Gsk-3β pathway[J]. Biosci Rep, 2020, 40(2): BSR20192442. DOI:10.1042/BSR20192442 |
| [12] |
ZUO A, ZHAO X, LI T, et al. CTRP9 knockout exaggerates lipotoxi- city in cardiac myocytes and high-fat diet-induced cardiac hypertrophy through inhibiting the LKB1/AMPK pathway[J]. J Cell Mol Med, 2020, 24(4): 2635-2647. DOI:10.1111/jcmm.14982 |
| [13] |
KUWABARA Y, HORIE T, BABA O, et al. MicroRNA-451 exacerbates lipotoxicity in cardiac myocytes and high-fat diet-induced cardiac hypertrophy in mice through suppression of the LKB1/AMPK pathway[J]. Circ Res, 2015, 116(2): 279-288. DOI:10.1161/CIRCRESAHA.116.304707 |
| [14] |
WENZL FA, AMBROSINI S, MOHAMMED SA, et al. Inflammation in metabolic cardiomyopathy[J]. Front Cardiovasc Med, 2021, 8: 742178. DOI:10.3389/fcvm.2021.742178 |
| [15] |
王雅诗, 华祚玉, 张立新. 铁死亡及其抑制剂在中枢神经系统疾病中的研究进展[J]. 中国医科大学学报, 2024, 53(3): 276-281. DOI:10.12007/j.issn.0258-4646.2024.03.016 |
 2024, Vol. 53
2024, Vol. 53