文章信息
- 苏梓涵, 张乾忠, 姜红堃
- SU Zihan, ZHANG Qianzhong, JIANG Hongkun
- 血清肌酸激酶和肌红蛋白在儿童急性良性肌炎中的变化特点及临床价值
- Changes and clinical significance of serum creatine kinase and myoglobin levels in benign acute childhood myositis
- 中国医科大学学报, 2024, 53(11): 984-988
- Journal of China Medical University, 2024, 53(11): 984-988
-
文章历史
- 收稿日期:2024-06-07
- 网络出版时间:2024-11-21 11:15:18
2. 中国医科大学附属第一医院儿科,沈阳 110001
2. Department of Pediatrics, The First Hospital of China Medical University, Shenyang 110001, China
肌酸激酶(creatine kinase,CK)广泛存在于骨骼肌、心肌和脑组织中,能可逆性催化肌酸和腺苷三磷酸(adenosine triphosphate,ATP)生成磷酸肌酸和腺苷二磷酸,保证组织细胞供能。临床上可用于心肌梗死、肌炎肌肉病变的诊断。肌红蛋白(myoglobin,Mb)主要存在于心肌和骨骼肌中,能反映早期急性心肌梗死和骨骼肌损伤。临床上部分呼吸道感染和肠道感染患儿可并发儿童急性良性肌炎(benign acute childhood myositis,BACM)[1-2],目前针对BACM患儿血清CK和Mb的变化特点的研究较少。因此,本研究回顾性分析了中国医科大学附属第一医院2011年1月至2023年12月收治的78例BACM患儿的临床资料,重点探讨其血清CK和Mb的变化特点及临床价值,旨在进一步加深理解血清CK和Mb变化对BACM诊断的意义。
1 材料与方法 1.1 研究对象收集2011年1月至2023年12月中国医科大学附属第一医院儿科收治的BACM患儿的临床资料,共78例。其中男49例,女29例;年龄4个月~15岁,平均(6.33±2.58)岁,< 6岁34例(43.59%),≥6岁44例(56.41%);春季发病40例,夏季发病7例,秋季发病4例,冬季发病27例,冬春季发病共计67例(85.9%)。78例患儿中,55例有呼吸道感染前驱感染病史,其中上呼吸道感染33例,急性支气管炎12例,肺炎10例。病原学检测:肺炎支原体感染(MP-Ab≥1∶160,IgM阳性)21例,病毒感染(白细胞正常或减少,C反应蛋白和降钙素原在正常范围内)57例,其中1例为EB病毒既往感染再激活。
纳入标准:发病前先有呼吸道或肠道前驱感染史;在病程中突发下肢肌痛,伴不同程度的肢体活动受限,多有腓肠肌握痛;CK显著增高;病情迅速好转,病程短,预后好;除外其他神经肌肉疾病。
本研究已获得中国医科大学附属第一医院医学科学研究伦理委员会批准,批号为科伦审[2024]574号。所有患儿家属知情同意。
1.2 临床表现 1.2.1 症状本组78例患儿的典型症状为突发的下肢肌肉疼痛,多为双侧小腿肌痛。全身肌痛3例;四肢肌痛1例;单侧小腿肌痛7例,其中左侧5例、右侧2例;双侧小腿肌痛3例,以一侧显著。肌痛严重者多伴有下肢活动受限,导致不敢站立和行走者25例,行走困难、步态异常者17例,下肢活动稍受限者7例。无活动受限者5例。除肌痛外,还有7例患儿自觉下肢乏力。
下肢肌痛多出现在呼吸道感染发病后第2~7天,其中以第3~5天最多,共71例(91.0%)。患儿多在发生腿痛后当天至第6天来院就诊,其中发生腿痛1~3 d来院就诊者63例(80.77%)。本组病例多于小腿肌痛2~3 d后明显减轻,5~7 d后肌痛消失,肢体活动恢复正常,仅有5例出院时尚未痊愈。
本组有1例患儿病程中出现嗜睡,脑电图检查出现慢波,故不除外伴发病毒性脑炎。另外,有2例为再发病例,与前次BACM发病分别相隔1年3个月和3年。
1.2.2 体格检查最常见的异常体征是小腿腓肠肌握痛,78例中,62例(79.48%)握痛阳性,其中21例拒绝触摸小腿肌肉。查体未见下肢关节肿胀,肌张力和腱反射均正常,病理反射阴性。2例下肢肌力为Ⅲ~Ⅳ级,余76例肌力正常,无感觉减退。
1.3 实验室检查 1.3.1 常规化验所有患儿均行心肌酶谱、血清Mb、肝功能、肾功能、血离子、血常规、尿常规、C反应蛋白、降钙素原、病毒抗体系列、肺炎支原体抗体等检查,部分患儿检测风湿三项及风湿抗体系列。
1.3.2 血清CK检测采用速率法检测所有患儿血清CK,参考区间上限为310 U/L。
1.3.3 血清CK同工酶MB(creatine kinase MB form,CK-MB)和肌钙蛋白Ⅰ检测采用免疫化学发光法检测患儿血清CK-MB、肌钙蛋白Ⅰ,参考区间上限分别为7.2 ng/mL、0.1 ng/mL。
1.4 其他辅助检查本组患儿行心电图检查38例,窦性心律不齐11例,其余正常。行胸部X线检查14例,肺纹理增强8例,肺内炎症6例;行肺CT检查8例,肺内炎症4例,肺纹理增强1例,肺透过度减低1例,另2例正常。行肌电图检查5例,均未见明显异常。行脑电图检查1例,显示慢波增多。行脑磁共振成像检查1例,未见异常。
1.5 治疗患儿入院后均嘱其卧床休息,减少肢体活动。对考虑由病毒感染引发者给予抗病毒药物治疗,29例应用了干扰素α-1b肌肉注射或雾化治疗。对21例存在肺炎支原体感染者应用了阿奇霉素或红霉素静脉滴注或口服。另外,本组患儿中,69例应用了磷酸肌酸钠、左卡尼汀或1,6-二磷酸果糖等心肌代谢赋活药,35例患儿接受了输液及碱性药物治疗,3例应用了糖皮质激素(甲基强的松龙2例,强的松1例)。
2 结果 2.1 实验室检查结果 2.1.1 常规化验所有患儿肝功能、肾功能、血离子、尿常规、C反应蛋白及降钙素原未见异常。白细胞(white blood cell,WBC)计数1.5×109/L~9.73×109/L,其中 < 4.0×109/L 49例(62.82%);中性粒细胞计数0.15×109/L~4.31×109/L,< 1.5×109/L 43例(55.13%)。肺炎支原体检测结果≥1∶160且IgM阳性21例。
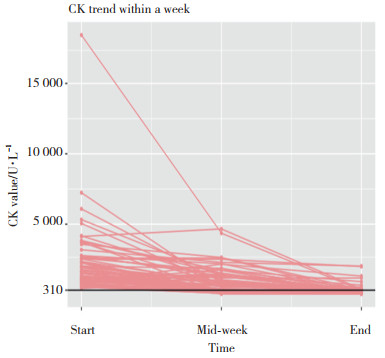
2.1.2 血清CK本组患儿CK检测值为432~18 440 U/L。大于参考区间上限2倍和10倍分别为72例(92.31%)和15例(19.23%),> 5 000 U/L 5例(6.41%),> 10 000 U/L 1例(1.28%)。CK检测资料较为完整(1周内CK检测次数≥3次)59例,观察和分析CK检测值动态变化,结果显示,CK峰值多于肌痛第1~3天出现,次日开始逐渐降低。BACM病程第7天时,73%患者的CK检测值已恢复正常。见图 1。
|
| 图 1 血清CK的变化趋势图 Fig.1 Trend of changes in serum creatine kinase levels |
2.1.3 血清CK-MB和肌钙蛋白Ⅰ
本组检测CK-MB共74例,检测值0.2~46.4 ng/mL。超过参考区间上限38例(51.35%),超过上限2倍17例(22.97%)。检测肌钙蛋白Ⅰ68例,检测值0~0.082 ng/mL,平均(0.006 5±0.012 4)ng/mL,均未超出参考区间上限。
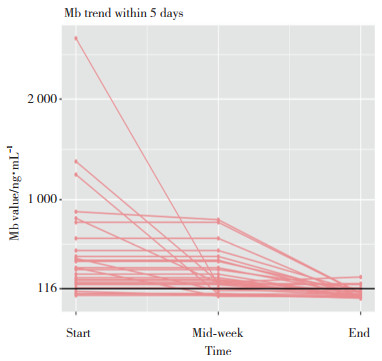
2.1.4 血清Mb本组检测Mb共66例,检测值13.3~2 603.8 ng/mL,平均(260.17±401.39)ng/mL。检测值大于参考区间上限34例(51.52%),其中大于参考区间上限2、5、10倍分别为20例(30.30%)、7例(10.61%)、3例(4.55%)。本组Mb检测资料较为完整者(1周内Mb检测次数 > 3次)8例。Mb检测值动态变化分析显示,峰值出现在肌痛第1~3天,以后逐渐降低,肌痛第4天时67.74%患儿Mb检测值已恢复正常,第5天时84.38%已恢复正常。与CK相比,Mb降低速度快,恢复早。见图 2。
|
| 图 2 血清Mb的变化趋势 Fig.2 Trend of changes in serum myoglobin levels |
2.2 治疗转归
患儿入院经相应治疗1~2 d后,病情逐渐好转,肌痛减轻。3~5 d后走路多恢复正常。住院时间2~10 d(平均4.59 d),住院3~5 d 53例(67.95%),仅2 d 4例,住院 > 1周6例,未见并发症和后遗症。
3 讨论BACM于1957年由LUNDBERG[3]首次报道,当时命名为流行性下腿部肌痛。国外文献[4]报道,在流行期间18岁以下儿童BACM发病率约为2.6/10万,目前国内尚缺少全国性流行病学调查资料。本组74例BACM患儿中,< 6岁34例(43.59%),≥6岁44例(56.41%),表明BACM不仅发生在学龄儿童,学龄前儿童也占相当比例,不可忽视该群体的发病情况。
BACM是一种感染性肌炎[5],与自身免疫性肌炎(幼年皮肌炎、多发性肌炎等)不同,其发病机制主要是由于病毒等致病微生物直接浸润肌肉纤维引发炎症反应,导致横纹肌细胞损伤甚至变性,以上已得到肌肉活检病理的证实。国外的研究[6-8]显示,BACM多由B型或A型流感病毒感染所致。儿科临床上,柯萨奇病毒、腺病毒、副流感病毒、EB病毒等其他病毒也可引发BACM。本组有1例BACM患者存在EB病毒既往感染再激活。近年来国内外均有在肺炎支原体感染病程中突发下肢肌肉酸痛和CK增高且恢复较快的病例报道[9-11],提示肺炎支原体也可能是BACM的病原体之一,应常规检测。本组78例中,有21例由肺炎支原体感染引发。另外,本研究还发现,患儿的肌痛多在呼吸道感染的第3~5天出现,最早者可在第2天出现,这与国外文献[7]报道的BACM多发生在呼吸道感染恢复期不同,提示呼吸道感染早期就应关注有无肌炎发生。
CK是肌肉损伤的重要生化标志物之一。BACM时肌肉炎症反应导致横纹肌细胞损伤,肌细胞膜通透性增加,甚或细胞膜破损,致使横纹肌细胞的“内容物”外渗或漏出,CK作为肌细胞内的酶类之一,也随之渗出或漏出入血,使血液中的CK含量明显升高,CK升高越显著,提示横纹肌细胞损伤越严重。本组78例患儿的CK检测值大于参考区间上限2倍占92.31%,> 10倍占19.23%,提示绝大多数BACM患儿都有CK值显著升高,因此CK值显著升高可作为BACM的诊断指标之一。通过对本组BACM患儿CK检测值动态变化的观察和研究发现,约73%的患儿在BACM病程第7天时CK检测值已恢复至正常水平,这与临床上在病程1周时绝大多数患儿症状已消失的结果一致。
本研究中,CK检测值> 10 000 U/L 1例(1.28%),CK检测值最高达18 440 U/L。有研究[12]指出,CK值> 20 000 U/L时才出现肌红蛋白尿,进而引起肾损伤。由于本组无CK值> 20 000 U/L的患儿,故未出现肌红蛋白尿,本组患儿尿常规检查均正常,无尿潜血试验阳性者。
本组74例患儿还检测了CK-MB,其中38例患儿检测结果超过参考区间上限,占51.35%;检测值大于参考区间上限2倍17例,占22.97%。CK增高同时伴有CK-MB增高临床上容易误诊为心肌损伤,但这些患儿肌钙蛋白Ⅰ检测值均未超过参考区间上限,另外,本组患儿心电图检查均正常,不支持心肌损伤。因此对大多数BACM患儿不需给予磷酸肌酸钠等心肌代谢赋活药物。对CK和CK-MB检测值明显升高的BACM患儿应同步检测肌钙蛋白Ⅰ和心电图等,判断有无心肌损伤,以便精准治疗。
Mb也是横纹肌细胞的“内容物”之一。当BACM肌细胞损伤时,Mb同CK一起渗出或漏出后吸收入血,进而引起血液中Mb含量和浓度增高。本组检测血清Mb 66例,其中34例检测值超过参考区间上限,占51.52%,大于参考区间上限2、5、10倍分别为20、7、3例,分别占30.30%、10.61%、4.55%。表明本组约1/2的BACM患儿出现血清Mb不同程度增高,提示血清Mb值增高对判断横纹肌细胞损伤也有较大的诊断价值。因此,对于诊断或疑诊BACM的患儿应尽早同步检测血清CK和Mb,并动态观察其变化。对本组部分患儿血清Mb动态变化的观察结果显示,升高的Mb较CK减低的速度更快,在肌痛起病第5天约85%已恢复正常,这可能与血清Mb的半衰期(1~3 h)较短、代谢较快有关。
有研究[13-14]指出,当血清游离Mb浓度 > 5~15μg/mL时可出现Mb尿。但尿中有少量肌红蛋白一般不会影响尿色,只有Mb浓度≥250 μg/mL时才会出现茶色甚至棕色尿,此时易引发肾损伤,建议患者进行尿Mb的定量或定性检测。本组血清Mb检测值最高1例为2 603 ng/mL,低于5 μg/mL,故未出现Mb尿(本例尿潜血试验阴性)。本组患儿尿常规检测均正常,肾功能(尿素氮、肌酐等)也未见异常,提示无肾损伤发生。国外有文献[15]指出,BACM患儿发生横纹肌溶解症罕见,本组亦未见横纹肌溶解症病例。当存在大量Mb尿时,由于Mb在肾小管中被浓缩后沉淀,形成管型堵塞肾小管,并且当尿中Mb水解后,产生亚铁血红素,对肾小管上皮细胞有直接毒性作用,易引发肾损伤,甚至肾功能衰竭,此时给予水化、碱化治疗有利于防治肾损伤和肾功能不全。由于大多数BACM患儿不会产生Mb尿,缺乏进行水化和碱化治疗的基础,因此不需要像横纹肌溶解症那样常规进行水化和碱化处理。只有当BACM患儿血清CK > 20 000 U/L,血清Mb≥5~15 μg/mL,尿潜血试验阳性时,才应考虑给予水化和碱化治疗,防止肾损伤和肾功能不全。因此,BACM患者CK和Mb值的水平及变化趋势有助于评价其是否会发生肾损伤。
BACM是一种预后良好的自限性疾病。本组绝大多数患儿于发病后1周左右临床症状消失,CK、Mb等检测值恢复正常,未出现并发症及后遗症。国外研究[16]多强调BACM早期诊断的重要性,建议对感染后出现肌痛的患儿早期检查CK、CK-MB和Mb等,以使患儿尽早确诊。一旦诊断为BACM后,应避免不必要的检查,尤其是侵入性检查[17-18]。除对症支持治疗外,无需行特殊干预,避免过度医疗[18]。
| [1] |
孔卫乾, 黎兴国, 赖永洪. 儿童急性良性肌炎23例临床分析[J]. 中国当代儿科杂志, 2000, 2(6): 424-425. DOI:10.3969/j.issn.1008-8830.2000.06.024 |
| [2] |
杜媛媛, 李淑华. 儿童急性良性肌炎36例临床诊治分析[J]. 中国药物与临床, 2013, 13(1): 88-89. DOI:10.11655/zgywylc2013.01.041 |
| [3] |
LUNDBERG A. Myalgia cruris epidemica[J]. Acta Paediatr, 1957, 46(1): 18-31. DOI:10.1111/j.1651-2227.1957.tb08627.x |
| [4] |
BUSS BF, SHINDE VM, SAFRANEK TJ, et al. Pediatric influenza-associated myositis - Nebraska, 2001-2007[J]. Influenza Other Respir Viruses, 2009, 3(6): 277-285. DOI:10.1111/j.1750-2659.2009.00102.x |
| [5] |
王华. 儿童炎症性肌病分类及临床表现[J]. 中国实用儿科杂志, 2014, 29 (2): 84-88. DOI: CNKI:SUN:ZSEK.0.2014-02-002.
|
| [6] |
MALL S, BUCHHOLZ U, TIBUSSEK D, et al. A large outbreak of influenza B-associated benign acute childhood myositis in Germany, 2007/2008[J]. Pediatr Infect Dis J, 2011, 30(8): e142-e146. DOI:10.1097/INF.0b013e318217e356 |
| [7] |
SZENBORN L, TOCZEK-KUBICKA K, ZARYCZAŃSKI J, et al. Benign acute childhood myositis during influenza B outbreak[J]. Adv Exp Med Biol, 2018, 1039: 29-34. DOI:10.1007/5584_2017_79 |
| [8] |
HUZIOR MC, CHERNICKI BP, NGUYEN L, et al. Benign acute childhood myositis in a pediatric patient post influenza B infection[J]. Cureus, 2023, 15(12): e51171. DOI:10.7759/cureus.51171 |
| [9] |
任健, 姜兴源, 张乾忠. 儿童急性良性肌炎的病因及诊断研究: 附9例分析[J]. 中国中西医结合儿科学, 2015, 7(2): 159-161. DOI:10.3969/j.issn.1674-3865.2015.02.024 |
| [10] |
孔卫乾, 王金华, 吴娇艳. 小儿肺炎支原体感染致急性良性肌炎36例[J]. 实用医学杂志, 2012, 28(7): 1145-1146. DOI:10.3969/j.issn.1006-5725.2012.07.043 |
| [11] |
CAPOFERRI G, MILANI GP, RAMELLI GP, et al. Sporadic acute benign calf myositis: systematic literature review[J]. Neuromuscul Disord, 2018, 28(5): 443-449. DOI:10.1016/j.nmd.2018.02.005 |
| [12] |
SAFARI S, YOUSEFIFARD M, HASHEMI B, et al. The value of serum creatine kinase in predicting the risk of rhabdomyolysis-induced acute kidney injury: a systematic review and meta-analysis[J]. Clin Exp Nephrol, 2016, 20(2): 153-161. DOI:10.1007/s10157-015-1204-1 |
| [13] |
SLATER MS, MULLINS RJ. Rhabdomyolysis and myoglobinuric renal failure in trauma and surgical patients: a review[J]. J Am Coll Surg, 1998, 186(6): 693-716. DOI:10.1016/s1072-7515(98)00089-1 |
| [14] |
EZIOKWU AS, ANGELINI D. New diagnosis of G6PD deficiency presenting as severe rhabdomyolysis[J]. Cureus, 2018, 10(3): e2387. DOI:10.7759/cureus.2387 |
| [15] |
ROSENBERG T, HEITNER S, SCOLNIK D, et al. Outcome of benign acute childhood myositis: the experience of 2 large tertiary care pediatric hospitals[J]. Pediatr Emerg Care, 2018, 34(6): 400-402. DOI:10.1097/PEC.0000000000000830 |
| [16] |
STEINSON AC, MUBASHAR T, JANZEN AF, et al. Benign acute childhood myositis: importance of early recognition[J]. Br J Nurs, 2019, 28(9): 560-564. DOI:10.12968/bjon.2019.28.9.560 |
| [17] |
NEOCLEOUS C, SPANOU C, MPAMPALIS E, et al. Unnecessary diagnostic investigations in benign acute childhood myositis: a case series report[J]. Scott Med J, 2012, 57(3): 182. DOI:10.1258/smj.2012.012023 |
| [18] |
FELIPE CAVAGNARO SM, ALEJANDRA AG, INGRID HR, et al. Benign acute childhood myositis: clinical series and literature review[J]. Rev Chil Pediatr, 2017, 88(2): 268-274. DOI:10.1016/j.rchipe.2016.07.002 |
 2024, Vol. 53
2024, Vol. 53