文章信息
- 刘欣, 曹云鹏, 赵传胜
- LIU Xin, CAO Yunpeng, ZHAO Chuansheng
- Aβ3-10KLH疫苗改善SAMP8小鼠认知功能和脑衰老
- Improved cognitive function and brain aging in SAMP8 mice after Aβ3-10KLH vaccine
- 中国医科大学学报, 2024, 53(11): 979-983
- Journal of China Medical University, 2024, 53(11): 979-983
-
文章历史
- 收稿日期:2024-07-23
- 网络出版时间:2024-11-21 11:15:00
2. 北华大学附属医院神经二科,吉林 吉林 132011
2. Department of Neurology Ⅱ, Affiliated Hospital of Beihua University, Jilin 132011, China
阿尔茨海默病(Alzheimer disease,AD)作为一种慢性神经系统变性疾病,发病率逐年上升 [1]。AD以其特有的认知功能渐进性恶化为显著特征,最终导致患者记忆丧失、思维混乱,严重损害其日常生活功能。β淀粉样蛋白(amyloid β-protein,Aβ)与AD的发病紧密相关,并可能通过诱导细胞衰老等机制加剧其病理变化[2]。
随着年龄的增长,脑组织中会出现一系列与AD相关的病理现象,其中Aβ的沉积尤为显著。同时,衰老的神经细胞周围普遍存在着微管相关蛋白tau神经纤维缠结等特征,这些变化都大大增加了AD的发生率[3]。衰老是一个由生物、化学或物理过程的负面后果介导的复杂过程,其中一个重要的表现为分子损伤的积累。在机体的衰老过程中,脑衰老表现得尤为突出,而这一过程常伴随着AD发生率的增加[4]。为了更准确地评估衰老状况及其与AD的关系,研究者们提出了多种指标,如衰老细胞的比例以及氧化应激水平等,为深入研究AD的发病机制和寻找有效的治疗方法提供了新的思路[5]。
前期研究[6]显示,Aβ3-10KLH多肽疫苗能够诱导产生高浓度的抗Aβ抗体,有效清除Aβ斑块,减轻脑组织的炎症反应,并对突触产生保护作用。SAMP8小鼠是从AKR/J品系中精心培育出的快速衰老模型,能够自发地模拟出与AD相关的病理改变。本研究旨在探讨Aβ3-10KLH疫苗在延缓SAMP8小鼠脑衰老中的作用,为后期的临床试验提供实验支持。
1 材料与方法 1.1 材料 1.1.1 实验动物3月龄的雄性SAMP8小鼠和雄性SAMR1小鼠均购自江苏华创信诺医药科技有限公司。提供足量无菌饲料和饮水,小鼠饲养的条件温度为(22±2)℃,湿度为45%~65%,12 h的昼夜交替。其中,光照期发生在7:00~19:00,适应性饲养时间为1周。本研究经中国医科大学动物伦理委员会批准(CMU2023006)。
1.1.2 主要试剂及仪器Aβ3-10KLH多肽疫苗委托南京金斯瑞生物科技有限公司合成,其氨基酸序列为EFRHDSGY。疫苗通过固相合成法及高效液相色谱法纯化,纯度达到96.2%,并通过质谱法验证其相对分子质量为1 113.17。在合成多肽的C端添加一个半胱氨酸用于偶联血蓝蛋白(keyhole limpet hemocyanin,KLH)。弗氏不完全佐剂、弗氏完全佐剂购自美国Sigma-Aldrich公司,衰老细胞β-半乳糖苷酶(senescence-associated β-galactosidase,SA-β-gal)染色试剂盒购自武汉谷歌生物科技有限公司,超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒购自北京索莱宝生物科技有限公司,丙二醛(malonic dialdehyde,MDA)检测试剂盒购自上海碧云天生物技术有限公司,水迷宫仪器购自上海欣软信息科技有限公司,包埋机购自武汉俊杰电子有限公司,冰冻切片机购自美国Thermo Fisher Scientific公司,组织摊片机购自浙江省金华市科迪仪器设备有限公司,显微镜购自日本Nikon公司,石蜡切片机购自德国Leica公司,酶标仪购自美国Thermo Fisher Scientific公司,离心机购自德国Eppendorf公司。
1.2 分组将3月龄雄性小鼠分为SAMR1组、SAMP8组和SAMP8+Aβ3-10KLH组。SAMR1组和SAMP8组注射PBS缓冲液100 μL,SAMP8+Aβ3-10KLH组注射Aβ3-10KLH疫苗溶液100 μL,浓度为1 μg/μL[6]。各组均为颈项部皮下注射,注射间隔为14 d,共注射10次。
1.3 Morris水迷宫检测小鼠的认知功能水迷宫为圆形水池,直径1.2 m,水深0.37 m,水温22 ℃。水池分为4个象限,透明隐藏平台设置在东南象限。实验分为熟悉训练、定位航行实验和空间探索实验3个阶段。熟悉训练旨在让小鼠熟悉水池环境;定位航行实验持续5 d,评估小鼠的空间学习能力,记录其到达平台的时间;空间探索实验于第6天进行,分析小鼠在无平台情况下的游泳轨迹,评估其记忆能力。若小鼠在90 s内未找到平台,实验结束,引导其上平台休息,并对小鼠在各象限停留时间和路线进行分析。
1.4 HE染色检测海马区神经组织4%多聚甲醛固定48 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片(厚4 μm),烤片,脱蜡再水化,Harris苏木素染色6 min,分化反蓝,伊红染色3 min,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察。
1.5 SA-β-gal染色检测小鼠海马组织衰老细胞比例按照说明书配置工作液,取小鼠脑组织泳冻切片自然晾干,固定20 min后用SA-β-gal染色液染色,置于PBS缓冲液中浸洗。切片充分染色,在37 ℃闭光湿箱中孵化18 h。显色后弃染液,用PBS缓冲液和纯水浸洗。核固红染液染色3 min,流水冲洗。切片经无水乙醇脱水、二甲苯透明后封片。衰老细胞胞质呈蓝色,细胞核呈红色。使用显微镜观察海马组织中衰老细胞的比例,并通过ImageJ软件扫描积分光密度(integral optical density,IOD)值进行计算。
1.6 MDA试剂盒检测海马组织MDA浓度准确称取10 mg海马组织样本,加入适量的裂解液在低温的条件下组织匀浆,12 000 r/min冷冻离心5 min。收集上清后检测每个样本的蛋白浓度。分别配置MDA检测工作液和TBA储存液,稀释标准品及样品测定按照试剂盒说明书操作。使用酶标仪在波长532 nm处测定吸光度,根据标准曲线计算浓度。
1.7 SOD试剂盒检测海马组织SOD活性海马组织匀浆后上清蛋白定量,样本检测按照试剂盒说明书进行操作,使用酶标仪在波长450 nm处测定吸光度。根据公式计算样本中的SOD活性。
1.8 统计学分析采用GraphPad Prism8.0.3软件进行统计分析,数据以x±s表示。行为学数据采用重复测量方差分析,其余数据采用单因素方差分析,并用Tukey’s进行事后检验。P < 0.05为差异有统计学意义。
2 结果 2.1 Aβ3-10KLH疫苗改善SAMP8小鼠的认知功能在定位航行实验阶段,随着训练天数的增加,3组小鼠找到平台的时间均变短,但组间比较无统计学差异(P > 0.05),见表 1。在空间探索实验阶段,与SAMR1组小鼠对比,SAMP8组和SAMP8+Aβ3-10KLH组小鼠在目标象限的停留时间均有所下降(P < 0.05);而与SAMP8组小鼠相比,SAMP8+Aβ3-10KLH组小鼠在目标象限的停留时间则显著延长(P < 0.05),见表 2。结果表明,与SAMR1组相比,SAMP8组和SAMP8+Aβ3-10KLH组小鼠的记忆能力均有所下降(P < 0.05);而SAMP8+Aβ3-10KLH组小鼠的记忆能力较SAMP8组小鼠有所提高(P < 0.05)。
| Group | Day 1 | Day 2 | Day 3 | Day 4 | Day 5 |
| SAMR1 | 46.02±20.81 | 34.92±18.07 | 16.83±4.04 | 17.21±10.12 | 19.77±7.01 |
| SAMP8 | 44.90±9.44 | 42.16±14.95 | 31.24±15.28 | 28.16±14.44 | 28.83±20.96 |
| SAMP8+Aβ3-10KLH | 40.04±17.28 | 38.83±21.67 | 21.74±7.87 | 22.16±9.69 | 26.23±21.12 |
| Group | Target zone | Other zone |
| SAMR1 | 31.48±5.20 | 17.66±2.37 |
| SAMP8 | 7.03±5.621) | 24.00±2.871) |
| SAMP8+Aβ3-10KLH | 23.30±4.221),2) | 20.13±1.412) |
| 1)P < 0.05 vs. SAMR1 group;2)P < 0.05 vs. SAMP8 group. | ||
2.2 Aβ3-10KLH改善海马区神经细胞形态
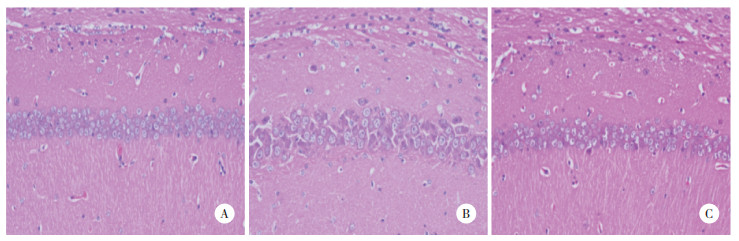
HE染色结果显示,SAMR1组小鼠海马CA1区可见排列紧密且形态规整的神经细胞,细胞质清晰、细胞核可见。SAMP8组小鼠海马CA1区神经细胞形态受损,排列松散,部分细胞出现核固缩现象。与SAMP8组小鼠相比,SAMP8+Aβ3-10KLH组小鼠则表现出明显的改善,小鼠海马CA1区神经细胞排列更为有序,且核固缩现象显著减少。见图 1。
|
| A,SAMR1 group;B SAMP8 group;C,SAMP8+Aβ3-10KLH group. 图 1 海马CA1区组织形态HE染色 ×200 Fig.1 Hippocampal CA1 region tissue morphology Hematoxylin and eosin staining ×200 |
2.3 Aβ3-10KLH减少SAMP8小鼠海马组织中衰老细胞比例
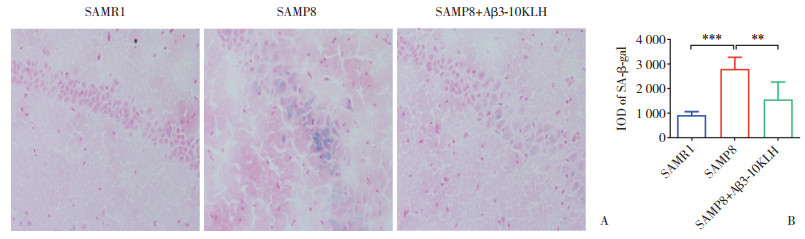
SA-β-gal染色观察3组小鼠海马组织阳性着色的衰老细胞比例结果显示,与SAMR1组比较,SAMP8组衰老细胞比例明显增加(P < 0.05),可以观察到明显的被染成蓝色的阳性着色衰老细胞。与SAMP8组比较,SAMP8+Aβ3-10KLH组海马组织中衰老细胞的比例减少(P < 0.05)。见图 2。
|
| A,SA-β-gal staining(×200);B,IOD of positive expression of senescent cells detected by SA-β-gal staining. **P < 0.01,***P < 0.001. 图 2 Aβ3-10KLH减少SAMP8小鼠海马衰老细胞比例 Fig.2 Aβ3-10KLH reduces proportions of senescent cells in hippocampi of SAMP8 mice |
2.4 Aβ3-10KLH减轻SAMP8小鼠海马组织中的氧化应激损伤
与SAMP1组小鼠相比,SAMP8组和SAMP8+Aβ3-10KLH组小鼠海马细胞内MDA浓度增加,SOD活性降低。与SAMP8组小鼠相比,SAMP8+Aβ3-10KLH组小鼠海马细胞内MDA浓度显著降低(P < 0.05),SOD活性明显增加(P < 0.05),见表 3。
| Group | MDA(μmol/mg) | SOD activity(U/mg) |
| SAMR1 | 90.49±30.27 | 91.09±14.64 |
| SAMP8 | 299.12±37.431) | 40.80±5.111) |
| SAMP8+Aβ3-10KLH | 179.44±44.071),2) | 74.44±11.392) |
| 1) P < 0.05 vs. SAMR1 group;2) P < 0.05 vs. SAMP8 group. | ||
3 讨论
AD是一种进行性的神经系统变性疾病,对患者的日常生活和社交能力造成了严重的影响。随着AD病情的恶化,患者可能会出现行为异常、情绪波动以及睡眠障碍等症状 [7]。目前,AD的病因尚未确定,但遗传、环境和年龄等可能是其发病的重要因素。神经细胞衰老作为AD病理过程中的一个核心环节,与患者认知能力的下降密切相关[8]。因此,研究神经细胞衰老对于揭示AD的发病机制具有重要的意义。
本研究观察到AD模型SAMP8小鼠海马组织中出现了核固缩现象,衰老细胞比例明显增加,并且MDA含量增高,这进一步证实了衰老在AD发病过程中的重要作用。海马是大脑中与学习、记忆和情感等高级功能密切相关的关键区域,在AD的发展中往往最早受到影响[9]。研究[10]显示,诱发细胞衰老的主要因素之一是高水平的活性氧,而在AD的早期即可观察到氧化应激的特征。Aβ3-10KLH疫苗能够减少SAMP8小鼠海马组织中MDA的生成,提高SOD的活性。MDA是脂质过氧化的副产物,在神经退行性疾病中常常升高,提示存在氧化损伤[11],而SOD则是一种重要的抗氧化防御机制[12]。因此,Aβ3-10KLH疫苗可能通过特定信号通路增强抗氧化剂,从而减轻与衰老神经细胞相关的氧化应激,发挥其有益作用。
空间探索实验结果显示,应用Aβ3-10KLH后SAMP8小鼠的记忆能力有所提升,这表明Aβ3-10KLH能够减缓SAMP8小鼠认知功能的退化,有效提高小鼠的认知功能。此外,Aβ3-10KLH疫苗还能改善SAMP8小鼠的神经细胞形态,减少海马区神经细胞的核固缩现象。通过SA-β-gal染色观察海马组织的衰老细胞,发现Aβ3-10KLH疫苗能降低SAMP8小鼠海马区衰老细胞的比例。
综上所述,本研究中Aβ3-10KLH疫苗能够降低海马组织衰老细胞比例、抑制氧化应激损伤,并延缓神经细胞衰老过程。尽管Aβ3-10KLH疫苗在延缓脑衰老方面的潜力已初步显现,但其具体作用机制,特别是与免疫系统的相互作用及调节氧化应激的途径,仍有待深入探讨。未来的研究将致力于阐明相关机制,以期为该疫苗在AD预防和治疗中的应用提供坚实的理论基础和新的策略方向。
| [1] |
徐勇, 王军, 王虹峥, 等. 2023中国阿尔茨海默病数据与防控策略[J]. 阿尔茨海默病及相关病, 2023, 6(3): 175-192. DOI:10.3969/j.issn.2096-5516.2023.03.001. |
| [2] |
ZHANG PS, KISHIMOTO Y, GRAMMATIKAKIS I, et al. Senolytic therapy alleviates Aβ-associated oligodendrocyte progenitor cell senescence and cognitive deficits in an Alzheimer's disease model[J]. Nat Neurosci, 2019, 22(5): 719-728. DOI:10.1038/s41593-019-0372-9. |
| [3] |
SCHELTENS P, DE STROOPER B, KIVIPELTO M, et al. Alzhei-mer's disease[J]. Lancet, 2021, 397(10284): 1577-1590. DOI:10.1016/S0140-6736(20)32205-4. |
| [4] |
GONZALES MM, GARBARINO VR, MARQUES ZILLI E, et al. Senolytic therapy to modulate the progression of Alzheimer's disease (SToMP-AD): a pilot clinical trial[J]. J Prev Alzheimers Dis, 2022, 9(1): 22-29. DOI:10.14283/jpad.2021.62. |
| [5] |
LIGUORI I, RUSSO G, CURCIO F, et al. Oxidative stress, aging, and diseases[J]. Clin Interv Aging, 2018, 13: 757-772. DOI:10.2147/CIA.S158513. |
| [6] |
ZHANG XY, MENG Y, YAN XJ, et al. Immunization with Aβ3-10-KLH vaccine improves cognitive function and ameliorates mitochondrial dysfunction and reduces Alzheimer's disease-like pathology in Tg-APPswe/PSEN1dE9 mice[J]. Brain Res Bull, 2021, 174: 31-40. DOI:10.1016/j.brainresbull.2021.05.019. |
| [7] |
JAROUDI W, GARAMI J, GARRIDO S, et al. Factors underlying cognitive decline in old age and Alzheimer's disease: the role of the hippocampus[J]. Rev Neurosci, 2017, 28(7): 705-714. DOI:10.1515/revneuro-2016-0086. |
| [8] |
BUSSIAN TJ, AZIZ A, MEYER CF, et al. Clearance of senescent glial cells prevents tau-dependent pathology and cognitive decline[J]. Nature, 2018, 562(7728): 578-582. DOI:10.1038/s41586-018-0543-y. |
| [9] |
HORIE K, BARTHÉLEMY NR, SATO C, et al. CSF tau microtubule binding region identifies tau tangle and clinical stages of Alzheimer's disease[J]. Brain, 2021, 144(2): 515-527. DOI:10.1093/brain/awaa373. |
| [10] |
HSU YC, HUANG Y, TSAI SY, et al. Efficacy of probiotic supplements on brain-derived neurotrophic factor, inflammatory biomarkers, oxidative stress and cognitive function in patients with Alzheimer's dementia: a 12-week randomized, double-blind active-controlled study[J]. Nutrients, 2023, 16(1): 16. DOI:10.3390/nu16010016. |
| [11] |
PARK MW, CHA HW, KIM J, et al. NOX4 promotes ferroptosis of astrocytes by oxidative stress-induced lipid peroxidation via the impairment of mitochondrial metabolism in Alzheimer's diseases[J]. Redox Biol, 2021, 41: 101947. DOI:10.1016/j.redox.2021.101947. |
| [12] |
CHIDAMBARAM SB, ANAND N, VARMA SR, et al. Superoxide dismutase and neurological disorders[J]. IBRO Neurosci Rep, 2024, 16: 373-394. DOI:10.1016/j.ibneur.2023.11.007 |
 2024, Vol. 53
2024, Vol. 53