文章信息
- 戴聪, 刘文源, 刘宣彤, 邹明宇
- DAI Cong, LIU Wenyuan, LIU Xuantong, ZOU Mingyu
- 肝细胞癌影像特征结合实验室指标在微血管侵犯中的预测价值
- Value of imaging features and laboratory indicators in predicting microvascular invasion of hepatocellular carcinoma
- 中国医科大学学报, 2024, 53(1): 75-79
- Journal of China Medical University, 2024, 53(1): 75-79
-
文章历史
- 收稿日期:2023-04-12
- 网络出版时间:2024-01-04 20:23:28
2. 北部战区总医院病理科, 沈阳 110016
2. Department of Pathology, Northern Theater Command General Hospital, Shenyang 110016, China
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,5年生存率约为70% [1]。对于同时伴有大血管侵犯及微血管侵犯(microvascular invasion,MVI)的HCC患者,手术切除或肝移植是治疗的首选方式,大量研究[1-2]显示MVI是HCC预后、提示转移可能性和肿瘤侵袭性的独立危险因素。因此,采取及时且适当的治疗措施可以一定程度上降低HCC复发率,延长生存期[3]。近年来越来越多的学者将关注点投向MVI的术前诊断,临床上对于HCC患者进行MVI分级管理的应用也日益增多。然而,影像学尚无明确的诊断标准对HCC MVI的存在及分级情况进行提示。在进行肿瘤描述时,通常关注其大小、形态、边缘光滑程度、肿瘤包膜完整等特征,将其与肿瘤的动态增强方式相结合,可以辅助医生判断肿瘤的恶性程度,但这些特征与MVI的相关度仍存在极大争议,目前的诊断金标准仍是术后病理。本研究拟探讨肿瘤的不同影像学特征结合部分临床指标对HCC发生MVI及其分级诊断的预测价值。
1 材料与方法 1.1 临床资料 1.1.1 研究对象回顾性分析2017年9月至2022年8月北部战区总医院接受HCC根治性切除术,并于术前进行过动态增强CT或磁共振成像(magnetic resonance imaging,MRI)检查的HCC患者73例,年龄34~94岁,平均(56.27±10.45)岁。患者的临床资料均从本院病历系统中获得,主要包括年龄、术前甲胎蛋白(alpha-fetoprotein,AFP)水平(记录为≤13.65 IU/mL或 > 13.65 IU/mL)、乙肝表面抗原及乙肝e抗原(记录为阴性或阳性)。根据病理结果,将HCC患者分为MVI组(n = 58)和无MVI组(n = 15);再根据肿物周围微血管内肿瘤细胞的数目将MVI组分为M1组(n = 28)及M2组(n = 30)。本研究获得北部战区总医院伦理委员会批准。
1.1.2 纳入标准(1)接受HCC手术;(2)术前1个月内接受动态增强CT或MRI检查;(3)术前未接受治疗(如化疗栓塞、射频消融和放疗);(4)影像资料完整。
1.1.3 排除标准(1)人口统计学特征及临床指标不全;(2)病理结果不完整;(3)影像学检查方法标准不一致。
1.2 方法 1.2.1 影像检查所有患者行动态增强CT或MRI成像检查。CT检查采用Canon Aquilion ONE Vision Edition第2代320排螺旋CT仪,探测器宽度160 mm,螺旋扫描层厚0.5 mm,旋转时间0.275 s,管电压100 kV,自动管电流技术,层厚5 mm;于平扫时经肘静脉以流率3.5~5.0 mL/s注射对比剂碘佛醇(350 mg/mL)60 mL,跟注30 mL生理盐水,到达触发阈值180 HU开始对比增强扫描。MRI检查采用3.0 TMRI扫描仪(Siemens Healthcare公司,德国),MRI成像序列为T1加权序列(T1-weighted imaging,T1 WI),T2加权序列(T2-weighted imaging,T2 WI),同相位和反相位T1 WI,以及动态对比增强序列:以2 mL/s的速率注射0.2 mL/kg钆特酸葡胺注射液,使用T1 WI回波序列获得动脉期(25~30 s)、门静脉期(55~65 s)和延迟期(2~3 min)图像。
1.2.2 影像特征评估由2名有8年以上工作经验的放射科医生进行双盲独立评估,若结果不一致,则由第3位具有20年工作经验的放射科医师进行评估。典型的患者MRI及CT检查影像特征见图 1。影像特征评估指标如下:(1)肿瘤长径(cm);(2)肿瘤形状(规则或不规则);(3)肿瘤数量(单发或多发);(4)肿瘤边缘是否清晰,肿瘤包膜完整与否;(5)肿瘤是否为多结节融合状态,局部是否可见外凸结节;(6)肿瘤内增强扫描动脉期是否可见供血血管;(7)肿瘤内是否存在变性、坏死(增强扫描显示为低信号/密度);(8)肿瘤周围是否有低信号/密度。
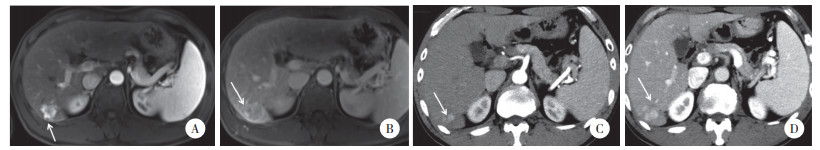
|
| A, a local convex tubercle at the point of the white arrow; B, the white arrow points to the blurred edge and partial incomplete envelope; C, the white arrow shows an unenhanced necrotic area of the tumor; D, the white arrow shows a slightly lower density surrounding the tumor. 图 1 患者部分MRI及CT检查影像特征 Fig.1 Partial MRI and CT features of a patient |
1.2.3 病理分析
病理指标由2名具有8年以上经验的病理专家双盲独立评估是否存在MVI,若结果不一致,则进行讨论直至得到统一结论。
1.3 统计学分析采用SPSS 26.0软件进行数据的统计分析。计量资料采用频数描述。组间差异检验采用Pearson’s检验。人口统计学特征和临床指标及CT、MRI检查影像学特征对HCC MVI危险性评估、MVI分级评估采用二元logistic回归,评价指标为优势比(odds ratio,OR)及95%置信区间(confidence interval,CI)。P < 0.05为差异有统计学意义。
2 结果 2.1 MVI组与无MVI组临床指标及影像特征二元logistic分析2组年龄、乙肝表面抗原及e抗原水平差异无统计学意义(P > 0.05),见表 1。与无MVI组比较,MVI组AFP升高。CT及MRI检查的影像特征中,肿瘤长径每增加1 cm,发生MVI的概率提升222.2%;与无MVI组相比,MVI组更易发现肿瘤边缘模糊以及局部包膜不完整的情况,这一特征为HCC发生MVI的独立危险因素;而2组肿瘤形态规则与否、肿瘤为单发或多发、肿瘤是否为多结节融合状态以及是否可见外凸结节、肿瘤内增强扫描动脉期是否可见供血血管、肿瘤内是否存在变性、坏死、肿瘤周围是否可见低信号或低密度差异无统计学意义(P > 0.05),见表 2。
| Variate | No MVI(n = 15) | M1(n = 28) | M2(n = 30) | P |
| Age [n (%)] | 0.622 | |||
| > 56 years | 9(12.3) | 16(21.9) | 11(15.1) | |
| ≤56 years | 6(8.2) | 12(16.4) | 19(26.0) | |
| AFP [n (%)] | 0.035 | |||
| > 13.65 IU/mL | 10(13.7) | 10(13.7) | 20(27.4) | |
| ≤13.65 IU/mL | 5(6.8) | 18(24.7) | 10(13.7) | |
| HbsAg [n (%)] | 0.453 | |||
| + | 10(13.7) | 23(31.5) | 21(28.8) | |
| - | 5(6.8) | 5(6.8) | 9(12.3) | |
| HBeAg [n (%)] | 0.879 | |||
| + | 3(4.1) | 5(6.8) | 7(9.6) | |
| - | 12(16.4) | 23(31.5) | 23(31.5) | |
| Irregular tumor morphology [n (%)] | 0.425 | |||
| + | 3(4.1) | 12(16.4) | 16(21.9) | |
| - | 12(16.4) | 16(21.9) | 14(19.2) | |
| Multiple tumors [n (%)] | 0.110 | |||
| + | 1(1.4) | 4(5.5) | 3(4.1) | |
| - | 14(19.2) | 24(32.9) | 27(37.0) | |
| Tumor length(cm) | 3.19±1.69 | 4.46±2.66 | 6.90±3.25 | 0.052 |
| The edge of the tumor was blurred or the local envelope was incomplete [n (%)] | 0.644 | |||
| + | 6(8.2) | 19(26.0) | 22(30.1) | |
| - | 9(12.3) | 9(12.3) | 8(11.0) | |
| The tumor was multinodular fusion, and some nodules were convex [n (%)] | 0.356 | |||
| + | 4(5.5) | 7(9.6) | 15(20.5) | |
| - | 11(15.1) | 21(28.8) | 15(20.5) | |
| Degeneration or necrosis in the tumor [n (%)] | 0.219 | |||
| + | 3(4.1) | 5(6.8) | 8(11.0) | |
| - | 12(16.4) | 23(31.5) | 22(30.1) | |
| Arteries in the tumor [n (%)] | 0.356 | |||
| + | 5(6.8) | 6(8.2) | 15(20.5) | |
| - | 10(13.7) | 22(30.1) | 15(20.5) | |
| Low peritumoral signal/density [n (%)] | 0.315 | |||
| + | 4(5.5) | 6(8.2) | 13(17.8) | |
| - | 11(15.1) | 22(30.1) | 17(23.3) |
| variate | β | SE | P | OR(95%CI) |
| Age | 0.005 | 0.049 | 0.927 | 1.005(0.912-1.106) |
| AFP > 13.65 IU/mL | 2.130 | 0.983 | 0.030 | 8.414(1.226-57.750) |
| HbsAg(+) | -1.001 | 1.036 | 0.334 | 0.368(0.048-2.801) |
| HBeAg(+) | 0.522 | 1.097 | 0.634 | 1.686(0.196-14.482) |
| Irregular tumor morphology | 0.002 | 0.972 | 0.998 | 1.002(0.149-6.739) |
| Multiple tumors | 1.321 | 1.412 | 0.349 | 3.747(0.236-59.591) |
| Tumor length(cm) | 0.798 | 0.291 | 0.006 | 2.222(1.257-3.929) |
| The edge of the tumor was blurred or the local envelope was incomplete | -1.757 | 0.883 | 0.047 | 0.173(0.031-0.973) |
| The tumor was multinodular fusion,and some nodules were convex | -0.226 | 1.157 | 0.845 | 0.798(0.083-7.707) |
| Degeneration or necrosis in the tumor | -0.007 | 1.096 | 0.995 | 0.993(0.116-8.509) |
| Arteries in the tumor | 0.897 | 1.025 | 0.381 | 2.452(0.329-18.272) |
| Low peritumoral signal/density | 0.103 | 1.182 | 0.930 | 1.109(0.109-11.252) |
2.2 M1组与M2组临床指标及影像特征二元logistic分析
2组临床特征,即年龄、术前AFP水平、乙肝表面抗原及e抗原情况,以及HCC CT和MRI检查的影像特征,即肿瘤形态、数量、大小、边缘清晰度及包膜完整度、存在多结节融合状态与否或局部有无外凸结节、内部供血血管情况、有无变性或坏死、瘤周围有无低密度或低信号存在等差异对于MVI分级均无统计学意义(P > 0.05),见表 3。
| variate | β | SE | P | OR(95%CI) |
| Age | -0.884 | 0.838 | 0.292 | 0.413(0.080-2.135) |
| AFP > 13.65 IU/mL | 1.591 | 0.896 | 0.076 | 4.909(0.848-28.409) |
| HbsAg(+) | 0.044 | 0.841 | 0.958 | 1.045(0.201-5.427) |
| HBeAg(+) | -0.289 | 0.758 | 0.702 | 0.749(0.170-3.306) |
| Irregular tumor morphology | 0.744 | 1.109 | 0.502 | 2.105(0.240-18.486) |
| Multiple tumors | -0.041 | 0.039 | 0.295 | 0.960(0.889-1.036) |
| Tumor length(cm) | 0.190 | 0.151 | 0.208 | 1.210(0.899-1.627) |
| The edge of the tumor was blurred or the local envelope was incomplete | 0.028 | 0.759 | 0.971 | 1.028(0.232-4.550) |
| The tumor was multinodular fusion and some nodules were convex | -0.544 | 0.831 | 0.513 | 0.581(0.114-2.958) |
| Degeneration or necrosis in the tumor | -0.119 | 0.831 | 0.886 | 0.888(0.174-4.527) |
| Arteries in the tumor | -0.463 | 0.796 | 0.561 | 0.629(0.132-2.994) |
| Low peritumoral signal/density | -0.565 | 0.868 | 0.515 | 0.568(0.104-3.117) |
3 讨论
本研究将HCC的影像学特征及临床指标与MVI的诊断相关联,结果显示,肿瘤长径越大、肿瘤边缘模糊并局部包膜不完整、AFP水平较高(> 13.56 IU/L)是预测MVI的独立危险因素。但这些特征及指标并未对HCC MVI的分级诊断提供明显帮助。
MVI是在肝脏血管内存在转移性的HCC肿瘤细胞团[4],HCC为富血供肿瘤,肝癌细胞团被一层纤维组织所包裹,凭借其极度复杂的以动脉为主的毛细血管网络,与相邻纤维组织通信,一部分癌细胞进入血液系统,一部分被覆内皮细胞或发生免疫逃逸,并生成血管[5]。研究[6]显示,发生MVI的HCC由于肿瘤阻塞门静脉微小分支可导致在门静脉流量减少或缺失的区域发生代偿性的动脉高灌注,致使瘤周动脉早期明显强化,并在随后阶段逐渐减弱为等强化。然而国际对HCC发生MVI的影像特征还没有准确定义。
在目前的HCC术前预测和评估中,影像学检查占有很大比重,已有多项研究[7-10]着重探讨了术前不同影像特征对MVI的预测作用。RHEE等[11]研究发现与不伴有动脉期不规则轮状强化的HCC相比,伴有动脉期不规则轮状强化的HCC更易表现出侵袭性的组织病理学特征。HONG等[12]认为肿瘤体积较大、动脉期边缘强化及瘤周强化、肝胆相位成像瘤周低信号、边缘不光滑、多灶性、T1WI低信号等多个MRI特征是HCC MVI的重要预测因子。然而基于成像报告和数据系统准确性的研究[13-14]发现,各试验间存在着显著的变异性和偏倚风险,表明医生仍需要高质量的试验和汇总分析来更好地量化诊断标准。
本研究结果显示,HCC肿瘤的直径越大,发生MVI的频率越高,肿瘤边缘模糊及局部包膜不完整是预测HCC发生MVI的独立危险因素,这些结论与大多数的研究结果一致。然而,其他的影像学特征在预测HCC发生MVI的表现上,与一些研究[11-12, 15]的结论相左,本研究并未发现肿瘤形态、单发或多发、增强扫描表现、肿瘤周围信号及密度改变与HCC MVI的发生相关。这可能与不同研究中所包含肿瘤的不同类型及分级有关。
本研究存在一定的局限性:(1)本研究是单中心病例研究,研究对象的HCC分类与分级可能受到地域限制等影响,在今后的进一步研究中应争取纳入不同地区的患者;(2)选取样本量较少,可能导致研究结果出现一定偏倚,在之后的研究中可增加样本量进一步探索。
MVI是影响HCC预后的关键因素,术前影像学诊断对HCC治疗计划的制定及疗效评价具有重要作用,因此术前应用影像检查确诊MVI的发生及分级被高度关注。本研究验证了HCC的部分影像学特征及临床指标对MVI的发生和分级具有极高的预测价值,也表明临床实验室和影像数据可以以互补的方式作用于MVI的预测。同时,HCC的影像学表现与MVI的关系有待深入探索,相信未来会有更多的研究成果可以帮助HCC进行MVI的术前诊断,更大程度地优化临床的治疗方案,提升患者的预后生存质量,提高患者的生存率。
| [1] |
SONG L, LI JW, LUO Y. The importance of a nonsmooth tumor margin and incomplete tumor capsule in predicting HCC microvascular invasion on preoperative imaging examination: a systematic review and meta-analysis[J]. Clin Imaging, 2021, 76: 77-82. DOI:10.1016/j.clinimag.2020.11.057 |
| [2] |
LEE S, KANG TW, SONG KD, et al. Effect of microvascular invasion risk on early recurrence of hepatocellular carcinoma after surgery and radiofrequency ablation[J]. Ann Surg, 2021, 273(3): 564-571. DOI:10.1097/SLA.0000000000003268 |
| [3] |
赵伟, 滑炎卿. 术前影像检查在预测肝癌微血管侵犯中的研究进展[J]. 国际医学放射学杂志, 2017, 40(5): 538-542. DOI:10.19300/j.2017.Z4628 |
| [4] |
ERSTAD DJ, TANABE KK. Prognostic and therapeutic implications of microvascular invasion in hepatocellular carcinoma[J]. Ann Surg Oncol, 2019, 26(5): 1474-1493. DOI:10.1245/s10434-019-07227-9 |
| [5] |
朱俊杰, 李柏峰. 肝癌微血管侵犯的研究进展[J]. 中华肝胆外科杂志, 2020, 26(7): 557-560. DOI:10.3760/cma.j.cn113884-20190617-00183 |
| [6] |
LEE S, KIM SH, LEE JE, et al. Preoperative gadoxetic acid-enhanced MRI for predicting microvascular invasion in patients with single hepatocellular carcinoma[J]. J Hepatol, 2017, 67(3): 526-534. DOI:10.1016/j.jhep.2017.04.024 |
| [7] |
李柳军, 苏中振. 影像组学术前评估肝癌微血管侵犯的研究进展[J]. 中华超声影像学杂志, 2021, 30(6): 548-552. DOI:10.3760/cma.j.cn131148-20201216-00939 |
| [8] |
左立平, 蒋丰洋, 周斌彬, 等. 术前MRI在预测169例肝细胞肝癌微血管侵犯及早期复发的价值[J]. 山东大学学报(医学版), 2022, 60(3): 89-95, 99. DOI:10.6040/j.issn.1671-7554.0.2021.1046 |
| [9] |
姚蓬, 黎学兵, 李小军. CT及MRI影像学检查对原发性肝癌患者微血管浸润的诊断价值[J]. 中国CT和MRI杂志, 2021, 19(1): 117-119. DOI:10.3969/j.issn.1672-5131.2021.01.040 |
| [10] |
马霄虹, 朱永健, 王爽, 等. 增强MRI纹理分析术前预测原发肝细胞肝癌微血管侵犯的价值[J]. 中华放射学杂志, 2018, 52(5): 327-332. DOI:10.3760/cma.j.issn.1005-1201.2018.05.002 |
| [11] |
RHEE H, AN C, KIM HY, et al. Hepatocellular carcinoma with irregular rim-like arterial phase hyperenhancement: more aggressive pathologic features[J]. Liver Cancer, 2018, 8(1): 24-40. DOI:10.1159/000488540 |
| [12] |
HONG SB, CHOI SH, KIM SY, et al. MRI features for predicting microvascular invasion of hepatocellular carcinoma: a systematic review and meta-analysis[J]. Liver Cancer, 2021, 10(2): 94-106. DOI:10.1159/000513704 |
| [13] |
VAN CB, LIM CS, SIRLIN CB, et al. Accuracy of the liver imaging reporting and data system in computed tomography and magnetic resonance image analysis of hepatocellular carcinoma or overall malignancy—a systematic review[J]. Gastroenterology, 2019, 156(4): 976-986. DOI:10.1053/j.gastro.2018.11.020 |
| [14] |
孔伟, 林文聪, 陈文坚, 等. LI-RADS CT诊断法则对诊断肝癌的临床价值[J]. 实用放射学杂志, 2021, 37(3): 407-411. DOI:10.3969/j.issn.1002-1671.2021.03.017 |
| [15] |
胡纳, 杨国庆, 付泉水. CT和MRI在肝细胞癌微血管浸润中的诊断价值[J]. 中国临床医学影像杂志, 2018, 29(8): 575-579. DOI:10.12117/jccmi.2018.08.012 |
 2024, Vol. 53
2024, Vol. 53