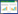文章信息
- 郭雨萌, 王越, 刘笑涵, 吴琳
- GUO Yumeng, WANG Yue, LIU Xiaohan, WU Lin
- 低强度脉冲超声对脂多糖诱导炎性活化的RAW264.7巨噬细胞迁徙和吞噬的影响
- Effect of low intensity pulsed ultrasound on the migration and phagocytosis of lipopolysaccharide-induced RAW264.7 macrophages
- 中国医科大学学报, 2024, 53(1): 15-19, 33
- Journal of China Medical University, 2024, 53(1): 15-19, 33
-
文章历史
- 收稿日期:2023-04-12
- 网络出版时间:2024-01-04 20:27:35
重度牙周炎困扰着全球超过10%的人口[1]。牙周炎发生时单核巨噬细胞被激活并释放促炎因子,破骨细胞活性提高,引起牙周支持组织的吸收和破坏[2]。近年来牙周炎的免疫调控受到了广泛关注,其通过干细胞、药物及其他方式作用于免疫微环境,使牙周炎症减轻、溶骨改善[3]。调节巨噬细胞的迁徙和吞噬可作为治疗牙周炎的方法 [4-7]。
低强度脉冲超声(low intensity pulsed ultrasound,LIPUS)可以促进骨折和骨不连愈合,其成骨作用的探索已深入分子机制水平[8]。本课题组前期研究[9]发现LIPUS通过激活钛酸钡材料的压电效应调控细胞内钙离子浓度,从而促进细胞成骨。近年来,LIPUS在炎症疾病中的治疗也受到关注。LIPUS能够促进炎症下肌肉组织的再生[10]、抑制LPS诱导的成骨细胞炎症反应[11],并抑制白细胞介素-6和白细胞介素-8的表达[12]。LIPUS可能影响巨噬细胞的迁徙和吞噬功能,改变炎症部位的巨噬细胞浸润和炎症反应,减轻牙周组织的炎症和损伤。本研究基于脂多糖(lipopolysaccharide,LPS)诱导小鼠单核巨噬细胞RAW264.7活化观察加载超声对细胞迁徙及吞噬功能的影响。
1 材料与方法 1.1 材料 1.1.1 细胞RAW264.7巨噬细胞由中国医科大学口腔医学院中心实验室提供。
1.1.2 主要仪器与试剂超声加载仪器为Sonicator 740(美国Mettler Electronics公司),酶标仪Infinite F200(奥地利Tecan公司),流式细胞仪LSRFortessa(美国BD公司),EVOSTM XL Core成像系统(美国赛默飞公司),激光共聚焦显微镜C2(日本尼康公司),RPMI 1640培养基(美国Gibco公司),胎牛血清(澳大利亚Scitcher公司),LPS(美国Sigma公司),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试剂盒(中国博士德公司),PE-CD206、APC-CD86(美国赛默飞公司),CCK-8试剂盒(美国APE×BIO公司),Transwell小室(中国洁特公司),结晶紫染色液(中国碧云天公司),pHrodo绿色荧光标记的大肠杆菌生物颗粒(美国赛默飞公司)。
1.2 实验方法 1.2.1 细胞培养用RPMI 1640培养基和胎牛血清按9∶1配成完全培养基,在5% CO2、37 ℃恒温培养箱中培养,细胞融合度达70%~80%时进行传代。
1.2.2 LPS体外诱导用100、200和1 000 ng/mL LPS诱导RAW264.7细胞24 h。24 h后收集细胞上清液,用酶联免疫吸附试剂盒检测TNF-α的分泌水平;轻吹打细胞悬液并孵育流式抗体PE-CD206和APC-CD86;倒置显微镜观察细胞形态并拍照。
1.2.3 LIPUS超声加载将面积为10 cm2的超声探头置于水箱中,与水面的恒定高度差为5 cm。超声加载参照文献[13]报道中LIPUS治疗牙周炎所使用的参数。频率为1 MHz,强度为50 mW/cm2,脉冲宽度200 μs,脉冲频率100 Hz,20 min/次。假辐照为不开功率源,除此之外与实验组设置均一致。
1.2.4 细胞分组将细胞分为未活化假辐照组(不加LPS,假辐照),未活化LIPUS组(不加LPS,加载超声),活化后假辐照组(加LPS,假辐照)以及活化后LIPUS组(加LPS,加载超声)。
1.2.5 CCK-8检测将500 μL的RAW264.7悬液接种至24孔板。活化组巨噬细胞在接种时加入100 ng/mL LPS。超声加载为24 h内加载3次,间隔8 h。24 h后将培养基换为450 μL RPMI 1640+50 μL CCK-8工作液,孵育2 h后移入96孔板,在450 nm波长处测定吸光度值。
1.2.6 划痕实验6孔板中细胞融合至80%时用200 μL枪头在皿中部划出划痕,更换培养基为仅含0.5% 胎牛血清的RPMI 1640并加载超声,24 h内加载3次,间隔8 h。0 h和24 h时间点倒置显微镜观察并拍摄照片。依据RAW264.7巨噬细胞划痕实验统计方法,结果用ImageJ软件进行分析。
1.2.7 Transwell实验孔径为8 μm的Transwell小室下室为500 μL含LPS(1 μg/mL)的10%胎牛血清的RPMI 1640培养基,上室为100 μL含0.5%胎牛血清的RPMI 1640培养基的细胞悬液。超声加载为24 h内加载3次,间隔8 h。24 h后4%多聚甲醛固定小室15 min,结晶紫染色15 min后用棉签轻轻擦去上室的细胞。随机选择5个视野并计数其中完整的细胞个数。
1.2.8 吞噬实验细胞接种于共聚焦小皿,待细胞贴壁后LPS(100 ng/mL)诱导24 h。加入1.5 L含pHrodo绿色荧光标记的大肠杆菌生物颗粒培养液。加载20 min超声后将共聚焦小皿37 ℃避光孵育,2 h后将小皿置于冰上终止吞噬,吸出含未被吞噬的生物颗粒的培养液,PBS洗涤3次,观察荧光素5-异硫氰酸酯(fluorescein isothiocyanate isomer,FITC)荧光强度;收集细胞后流式细胞仪分析样品FITC荧光强度。
1.3 统计学分析采用SPSS 22.0软件进行统计分析,数据以x±s表示。服从正态分布且方差齐的数据,2组比较采用独立样本t检验;分析不同浓度LPS对RAW264.7细胞TNF-α分泌时采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 LPS诱导巨噬细胞的活化LPS刺激RAW264.7细胞24 h后,随着浓度的提高,TNF-α分泌呈浓度依赖性增加。100 ng/mL的浓度诱导后TNF-α分泌增加,与未加LPS组相比有统计学差异(P < 0.05);LPS浓度为500 ng/mL和1 μg/mL时,TNF-α分泌与未加LPS组相比,差异有统计学意义(P < 0.01)(图 1A)。与未活化组相比,活化组CD206(M2抗炎型巨噬细胞表面标志物)/CD86(M1促炎型巨噬细胞表面标志物)的比值下降了1.28倍(P < 0.05)(图 1B)。此外,活化细胞形态改变,静止状态的RAW264.7为圆球形,呈片状生长。诱导后细胞体积增大,伪足伸出,见煎蛋样和梭形的活化巨噬细胞(图 1C)。
|
| A, TNF-α secretion was evaluated using ELISA; B, the ratio of CD206/CD86 was detected using flow cytometry; C, the morphology of inactivated (left) and activated (right) RAW264.7. Arrows indicate the activated RAW264.7 macrophages. *P < 0.05;**P < 0.01. 图 1 LPS诱导RAW264.7巨噬细胞活化 Fig.1 Activated RAW264.7 macrophages induced by LPS |
2.2 细胞活性
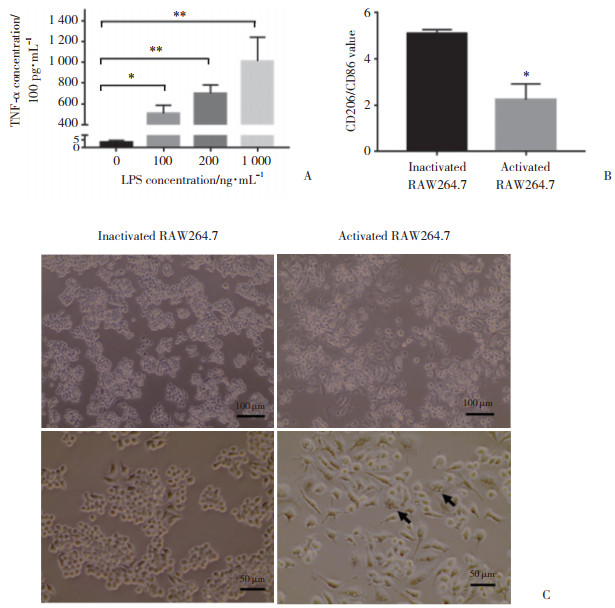
CCK-8检测结果显示,超声处理24 h时,活化组的RAW264.7细胞活性高于未活化组(P < 0.05);与同时间点假辐照组相比,LIPUS组巨噬细胞的细胞活性无显著变化(图 2A)。
|
| A, cell viability was evaluated using CCK-8;B, C, cell migration was detected by a cell scratch assay (×40);D, E, directed migration of macrophages was measured by the Transwell migration assay (×200). *P < 0.05;**P < 0.01. 图 2 超声加载抑制RAW264.7细胞的迁徙 Fig.2 LIPUS loading inhibited the migration of RAW264.7 macrophages |
2.3 细胞迁徙
与假辐照组相比,加载LIPUS使划痕区域内巨噬细胞数目减少,其中未活化LIPUS组较未活化假辐照组巨噬细胞数目减少46.1%(P < 0.05);活化后LIPUS组与假辐照组细胞数目无统计学差异(图 2B、2C)。Transwell实验中LIPUS组迁徙至下室的巨噬细胞数目少于假辐照组,LIPUS组Transwell下室中的细胞数为44.8±3.19,假辐照组为62.4±5.90(P < 0.01,图 2D、2E)。
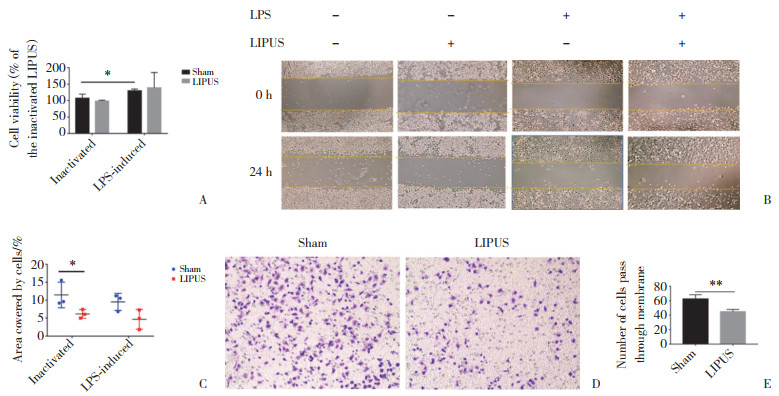
2.4 细胞吞噬孵育1 h时,FITC荧光强度较弱;2 h时FITC荧光明显。孵育2 h时活化组的巨噬细胞,可见被吞噬进入细胞内的生物颗粒有较强的FITC荧光信号,黏附在细胞膜和未被吞噬的生物颗粒不显示荧光。共聚焦显微镜下,LIPUS组与假辐照组相比,FITC荧光信号强度无统计学差异;流式结果显示,LIPUS组与假辐照组FITC平均荧光强度差异无统计学意义(P < 0.05),见图 3。
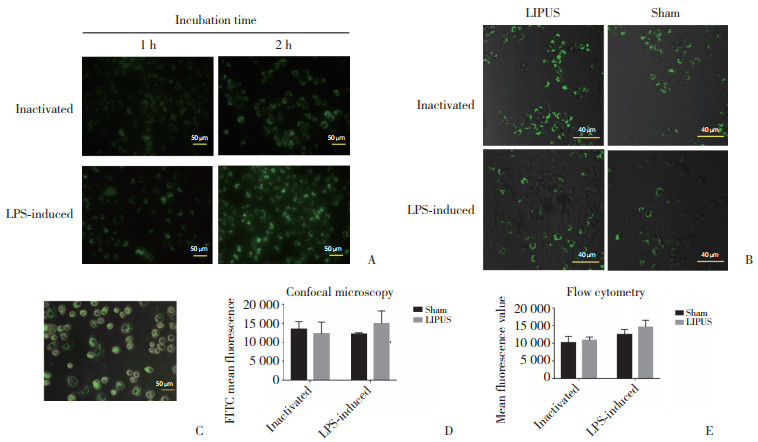
|
| A, phagocytosis ability of macrophages after 1 and 2 h of incubation was evaluated using fluorescent microscopy; B, LIPUS effect on RAW264.7 was assessed using confocal laser scanning microscopy; C, RAW264.7 macrophages exhibiting FITC fluorescence after 2 h of incubation; D, phagocytosis ability evaluated using confocal microscopy; E, phagocytosis ability evaluated using flow cytometry. 图 3 LIPUS对RAW264.7细胞吞噬能力无显著影响 Fig.3 LIPUS loading did not affect the phagocytosis ability of RAW264.7 |
3 讨论
LIPUS是一种非侵入性的治疗仪,能将机械能转化为生物能并产生极少的热效应,应用于新鲜骨折和骨不连的愈合等领域[8]。近来研究[11-15]表明,LIPUS可能对巨噬细胞有免疫调节作用。ZHANG等[12]通过60 mW/cm2强度加载LIPUS 2 h,LPS诱导U937巨噬细胞分泌的白细胞介素-6和白细胞介素-8被显著抑制。陈绩等[14]发现LIPUS加载后巨噬细胞白细胞介素-6、白细胞介素-23α、TNF-α和诱导型一氧化氮合酶的表达下降。但既往研究常关注于LIPUS抑制促炎因子的释放,在巨噬细胞迁徙方面,LIPUS的作用目前鲜见报道。本研究观察到LIPUS对巨噬细胞迁徙有抑制作用。CCK-8检验结果显示,在24 h的时间点,LIPUS并未影响巨噬细胞的细胞活力,表明LIPUS对巨噬细胞迁徙的抑制不是通过影响其细胞活力实现的。巨噬细胞是吞噬细胞的一种,吞噬是其重要的生物学功能。本研究结果显示,在当前LIPUS参数下,活化的RAW264.7吞噬能力升高;LIPUS组和假辐照组RAW264.7的吞噬能力无差异。关于LIPUS对巨噬细胞吞噬能力的影响,2008年和2021年分别有过相关报道[12,15]。ZHOU等[15]发现,在小鼠J774A.1巨噬细胞和人原代巨噬细胞,LIPUS以30 mW/cm2强度、1.5 MHz频率加载20 min和40 min时,LIPUS组FITC标记的大肠杆菌荧光强度明显强于假辐照组,且超声加载后细胞骨架蛋白F-actin聚合明显增加。这一结果与本研究结论不同,可能有以下原因:巨噬细胞的选择不同,RAW264.7与J774A.1可能对超声刺激反应不同,吞噬E.coli颗粒的能力有所差异;其次,ZHOU等[15]的研究选择20 min和40 min作为吞噬观察时间点,本研究为2 h。本研究结果显示,pHrodo E.coli生物颗粒在 < 1 h时未被内化进入RAW264.7巨噬细胞内,故无法在超声加载20 min的时间点进行即刻比较;除此之外,在LIPUS参数的选择上,ZHOU等[15]使用的LIPUS仪器提供的频率为1.5 MHz,而Sonicator 740提供的频率为1.0 MHz。有研究[16]表明,LIPUS不同频率的加载可对细胞膜面积及细胞伸展等产生影响。在另一项小鼠骨髓来源的巨噬细胞的吞噬研究[10]中,加载LIPUS后进行LPS诱导,发现LIPUS组细胞的脂滴吞噬能力小于假辐照组,LIPUS下调了LPS激活的NF-κB/MAPK通路相关蛋白的表达。虽然同样也使用了LPS诱导的巨噬细胞模型,但在吞噬颗粒、LIPUS参数、巨噬细胞选择等方面也与本研究不同。
炎性疾病常伴随着巨噬细胞过度聚集的现象,如类风湿性关节炎、牙周炎等。滑膜腔内巨噬细胞数目是评价类风湿性关节炎的标志,疾病改善时滑膜腔内巨噬细胞数目减少[17]。调整巨噬细胞的迁徙模式可能有利于减轻慢性炎性疾病。研究[4]表明巨噬细胞迁徙抑制剂宾达利可缓解牙周炎小鼠的牙槽骨吸收,使牙周上皮厚度增加。因此,调节巨噬细胞迁徙可能在抑制炎症上起重要作用。本研究采用物理治疗的方法,与手术治疗相比更为安全温和,结果显示LIPUS对巨噬细胞迁徙的抑制作用,这可能对炎性疾病,如牙周炎的的治疗提供新思路。然而,LIPUS抑制炎性环境下细胞迁徙的分子机制尚不明确。研究[18]表明,LIPUS可抑制LPS作用下p38 MAPK和ERK通路的激活。p38 MAPK信号通路可参与巨噬细胞的细胞骨架重塑并影响LPS诱导下巨噬细胞促炎因子释放和细胞迁徙[19]。因此,在体内外模型中LIPUS对巨噬细胞相关信号通路的影响有待研究,以进一步明确LIPUS在炎性环境下调控巨噬细胞迁徙的分子作用机制。
| [1] |
TONETTI M S, JEPSEN S, JIN L, et al. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: a call for global action[J]. J Clin Periodontology, 2017, 44(5): 456-462. DOI:10.1111/jcpe.12732 |
| [2] |
SUN X, GAO J, MENG X, et al. Polarized macrophages in periodontitis: characteristics, function, and molecular signaling[J]. Front Immunol, 2021, 12: 763334. DOI:10.3389/fimmu.2021.763334 |
| [3] |
YANG B, PANG X, LI Z, et al. Immunomodulation in the treatment of periodontitis: progress and perspectives[J]. Front Immunol, 2021, 12: 781378. DOI:10.3389/fimmu.2021.781378 |
| [4] |
SHEN Z, KUANG S, ZHANG M, et al. Inhibition of CCL2 by binda-rit alleviates diabetes-associated periodontitis by suppressing inflammatory monocyte infiltration and altering macrophage properties[J]. Cell Mol Immunol, 2021, 18(9): 2224-2235. DOI:10.1038/s41423-020-0500-1 |
| [5] |
LEE C-T, TELES R, KANTARCI A, et al. Resolvin E1 reverses experimental periodontitis and dysbiosis[J]. J Immunol, 2016, 197(7): 2796-2806. DOI:10.4049/jimmunol.1600859 |
| [6] |
CARNEIRO VMA, BEZERRA ACB, GUIMARÃES MDCM, et al. Decreased phagocytic function in neutrophils and monocytes from peripheral blood in periodontal disease[J]. J Appl Oral Sci, 2012, 20(5): 503-509. DOI:10.1590/s1678-77572012000500002 |
| [7] |
ZIDAR A, KRISTL J, KOCBEK P, et al. Treatment challenges and delivery systems in immunomodulation and probiotic therapies for periodontitis[J]. Expert Opin Drug Deliv, 2021, 18(9): 1229-1244. DOI:10.1080/17425247.2021.1908260 |
| [8] |
PALANISAMY P, ALAM M, LI S, et al. Low-intensity pulsed ultrasound stimulation for bone fractures healing: a review[J]. J Ultrasound Med, 2022, 41(3): 547-563. DOI:10.1002/jum.15738 |
| [9] |
CAI K, JIAO Y, QUAN Q, et al. Improved activity of MC3T3-E1 cells by the exciting piezoelectric BaTiO3/TC4 using low-intensity pulsed ultrasound[J]. Bioact Mater, 2021, 6(11): 4073-4082. DOI:10.1016/j.bioactmat.2021.04.016 |
| [10] |
NAGATA K, NAKAMURA T, FUJIHARA S, et al. Ultrasound modulates the inflammatory response and promotes muscle regeneration in injured muscles[J]. Ann Biomed Eng, 2013, 41(6): 1095-1105. DOI:10.1007/s10439-013-0757-y |
| [11] |
NAKAO J, FUJII Y, KUSUYAMA J, et al. Low-intensity pulsed ultrasound (LIPUS) inhibits LPS-induced inflammatory responses of osteoblasts through TLR4-MyD88 dissociation[J]. Bone, 2014, 58: 17-25. DOI:10.1016/j.bone.2013.09.018 |
| [12] |
ZHANG X, HU B, SUN J, et al. Inhibitory effect of low-intensity pulsed ultrasound on the expression of lipopolysaccharide-induced inflammatory factors in U937 cells[J]. J Ultrasound Med, 2017, 36(12): 2419-2429. DOI:10.1002/jum.14239 |
| [13] |
董妮, 宋锦璘, 冯格, 等. 低强度脉冲超声波对Beagle犬牙周炎组织修复效应的初步研究[J]. 四川大学学报(医学版), 2012, 43(2): 183-186. |
| [14] |
陈绩, 杨传熙, 徐天华, 等. 低强度脉冲式超声波对小鼠骨髓来源巨噬细胞极化和吞脂能力的影响[J]. 南京医科大学学报(自然科学版), 2021, 41(4): 489-495. |
| [15] |
ZHOU S, BACHEM M G, SEUFFERLEIN T, et al. Low intensity pulsed ultrasound accelerates macrophage phagocytosis by a pathway that requires actin polymerization, Rho, and Src/MAPKs activity[J]. Cell Signal, 2008, 20(4): 695-704. DOI:10.1016/j.cellsig.2007.12.005 |
| [16] |
BANERJEE H, ROY B, CHAUDHURY K, et al. Frequency-induced morphology alterations in microconfined biological cells[J]. Med Biol Eng Comput, 2019, 57(4): 819-835. DOI:10.1007/s11517-018-1908-y |
| [17] |
HARINGMAN JJ, GERLAG DM, ZWINDERMAN AH, et al. Synovial tissue macrophages: a sensitive biomarker for response to treatment in patients with rheumatoid arthritis[J]. Ann Rheum Dis, 2005, 64(6): 834-838. DOI:10.1136/ard.2004.029751 |
| [18] |
ZHENG C, WU S M, LIAN H, et al. Low-intensity pulsed ultrasound attenuates cardiac inflammation of CVB3-induced viral myocarditis via regulation of caveolin-1 and MAPK pathways[J]. J Cell Mol Med, 2019, 23(3): 1963-1975. DOI:10.1111/jcmm.14098 |
| [19] |
BIAN H, LI F, WANG W, et al. MAPK/p38 regulation of cytoskeleton rearrangement accelerates induction of macrophage activation by TLR4, but not TLR3[J]. Int J Mol Med, 2017, 40(5): 1495-1503. DOI:10.3892/ijmm.2017.3143 |
 2024, Vol. 53
2024, Vol. 53