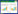文章信息
- 曹聪慧, 曹艳丽, 王晓黎
- SCN4A基因突变导致的低钾性周期性麻痹2例报道并文献复习
- Hypokalemic periodic paralysis caused by an SCN4A gene mutation: two cases and a literature review
- 中国医科大学学报, 2023, 52(8): 761-765
- Journal of China Medical University, 2023, 52(8): 761-765
-
文章历史
- 收稿日期:2022-07-20
- 网络出版时间:2023-07-28 11:13:37
低钾性周期性麻痹(hypokalemic periodic paraly-sis,HypoPP)是以周期性发作的肌肉软瘫伴随低钾血症为特征的常染色体显性遗传骨骼肌离子通道病[1],起病急且软瘫症状明显。HypoPP是由CACNA1S基因(HypoPP1型,40%~60%)、SCN4A基因(HypoPP2型,7%~14%)和KCNJ2以及其他尚未知的基因突变所导致[1-2]。本文报道2例SCN4A基因突变导致的HypoPP病例,其突变位点均在SCN4A基因的突变热点位点672位,其中1例携带的突变类型(R672L)尚未见文献及数据库报道。此外,本文对国内外已报道的CACNA1S基因和SCN4A基因所导致的HypoPP病例报道、最新的基础研究和临床试验等进行对比和回顾分析。
1 材料与方法 1.1 研究对象本研究纳入2021年3月和4月于我院就诊的2例先证者,均出现过发作性肌无力症状,对其进行病史采集、测定甲状腺功能、肾功能、尿常规、甲状腺及肾上腺相关激素,并行影像学检查,以排除继发性低钾型周期性麻痹。本研究获得本医院伦理委员会审核批准,所有受试者均签署知情同意书。
1.2 实验试剂及仪器血液提取试剂盒(中国北京康为世纪生物科技有限公司CWE 9600),Agencourt AMPure XP纯化磁珠(美国Beckman Coulter公司),Dynabeads MyOne Streptavidin M270(美国Invitrogen公司),文库准备试剂盒KAPA Library Preparation Kit(Illumina® platforms)(美国KAPA公司),捕获探针IDT xGen Exome Research Panel v1.0,双链DNA高灵敏度荧光定量试剂盒(Qubit dsDNA HS Assay Kit,Life Q32854,美国)。LifeECO -PCR基因扩增仪TC-96/G/H(b)C,Life Invitrogen Qubit® 3.0荧光定量仪(invitrogen Q33216),全自动超声破碎仪新芝SCIENTZ08-Ⅲ(产地:宁波)。捕获后的样本由北京金准基因公司进行Illumina NovaSeq高通量测序。测序数据经Illumina Sequence Control Software(SCS)评估合格后,进行数据读取和生物信息学分析。蛋白质结构示意图采用PyMol 2.5软件(PDB:6AGF),采用Chrome软件测序电泳图。
1.3 文献检索以“低钾性周期性麻痹或低钾性周期性瘫痪”检索PubMed、万方、维普、CNKI等数据库,截止时间为2021年12月,检索由CACNA1S基因和SCN4A基因所导致的HypoPP病例报道,并限定为人类研究,筛选出涉及国内病例的相关文献。
1.4 统计学分析分类变量的比较采用χ2检验,起病年龄和发病时血钾符合正态分布,以x±s表示,采用单因素方差分析检验。P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料病例1,男,26岁,以“周身无力酸痛2年,加重1个月”为主诉入院。患者2年前清晨起身时出现周身无力酸痛,可缓慢站立活动,约2 h后缓解,未用药,18个月后无明显诱因再次出现周身无力酸痛,休息约2 h缓解,未在意,1年前突发周身无力酸痛,呼吸费力,家属搀扶可缓慢行走,意识清,无心悸大汗,但病情逐渐加重,急诊入院时意识模糊,呼之不应,血钾1.2~1.3 mmol/L,静脉大量补钾后意识转清,周身无力酸痛缓解,住院治疗3 d后恢复正常,遂办理出院,出院后口服氯化钾缓释片(1.0 g),2次/d,未出现上述症状,停药1 d即出现周身无力酸痛,服用钾片后可缓解。家族史:父亲糖尿病,曾有软瘫症状但未系统诊治,姑姑曾有类似症状,母亲健康。查体:身高175 cm,体质量86 kg,体质量指数(body mass index,BMI)28.08 kg/m2,血压118/68 mmHg。未发作时检测血钾正常,甲功及抗体正常,醛固酮/肾素正常,皮质醇正常,影像学检查结果未见异常。
病例2,男,15岁,以“四肢乏力1年余,加重20余天”为主诉入院。患者1年前喝饮料后第2天清晨起床时发现肢体无力,翻身不能,不能下床活动,伴肌肉酸痛。在家休息约6 h后就诊于当地医院,结果显示钾离子水平低(约2 mmol/L),予静脉补钾治疗,明显见效。平均1个月发作1次。20 d前出现四肢无力伴酸痛,就诊于当地医院,钾离子约3 mmol/L,予静脉补钾治疗后缓解。患者为求进一步诊治入我科,入院后口服氧化钾缓释片,监测钾离子处于正常水平,症状未再发作。家族史:父亲14岁开始出现低钾性周期性麻痹,发作频率目前已经逐渐减少,祖母和叔叔曾有过类似症状。查体:身高171 cm,体质量49 kg,BMI 16.76 kg/m2,血压110/70 mmHg。未发作时检测血钾正常,甲功及抗体正常,醛固酮/肾素正常,皮质醇正常,影像学检查结果未见异常。
2.2 基因检测结果上述2个病例均排除了其他继发性低钾血症原因,存在常染色体显性遗传家族史。高通量测序(北京金准基因公司)结果显示,位于SCN4A基因的杂合性突变(病例1为R672L和病例2为R672H),并采用Sanger测序进行了验证(图 1),病例1的父亲和病例2的父亲均携带与先证者相同杂合突变,可诊断为家族性低钾性周期性麻痹,给予补钾治疗后症状缓解。

|
| 图 1 病例1和病例2的SCN4A基因突变测序结果和对蛋白结构影响示意图 |
2.3 病例归纳总结
共筛选出相关文献53篇,有完整临床资料和基因检测结果中文文献18篇,英文文献3篇。截止时间为2022年4月,加上本文报道的2例,共纳入34例先证者见表 1、2。2种基因对我国HypoPP的贡献基本相等(16∶18)。HypoPP1型患者血钾相比HypoPP2型患者血钾有降低趋势,但无统计学意义(P = 0.287),发作频率2组比较亦无统计学差异(P = 0.297)。SCN4A基因的R672和CACNA1S基因的R528为国内HypoPP患者最常见的突变位点(比例为9/18和5/16)。
| 病例来源 | 先证者性别 | 家系患者数量与性别 | 起病年龄(岁) | 发作频率(次) | 发作时血钾(mmol/L) | 突变位点 | 治疗效果 |
| 文献[6] | 男 | 1男1女 | 12.0 | 2~3 /月 | 2.00 | R528H | 补钾有效 |
| 文献[6] | 男 | 10男 | 19.0 | 2~3/月 | 1.50 | R900S | 补钾有效 |
| 文献[6] | 男 | 1男1女 | 3.0 | 1/3年~1/3~5 d | 1.90 | V876E | 补钾有效 |
| 文献[6] | 男 | 2男1女 | 15.0 | 3~4/年 | 1.80 | R897M | 补钾有效 |
| 文献[14] | 女 | 7男11女 | 10.0 | - | 1.40 | R1239H | 补钾有效 |
| 文献[15] | 男 | 无 | 10.0 | 1/1~3月 | 2.70 | R1239G | 补钾无效 |
| 文献[15] | 女 | 1男2女 | 6.0 | 1/1~4月 | 2.00 | R1239G | 补钾有效 |
| 文献[16] | 男 | 1男3女 | 11.0 | 1/月 | 2.40 | R528H | 补钾无效 |
| 文献[17] | 男 | 10男9女 | 16.0 | 6~300/年 | 2.30 | R528G | 补钾有效 |
| 文献[18] | 男 | 1男1女 | 8.0 | 35~50/年 | 1.50 | R1239H | 补钾及乙酰唑胺有效 |
| 文献[19] | 男 | 2男3女 | 23.0 | 3~4/年 | 2.50 | R528G | 补钾及醋甲唑胺无效 |
| 文献[20] | 女 | 无 | 8.0 | 1/1~2月 | - | R1239H | 补钾有效 |
| 文献[20] | - | - | 20.0 | 不等 | - | R900S | 补钾有效 |
| 文献[21] | 男 | 10男 | 18.0 | 4~5/年 | 2.90 | H916Q | 补钾有效 |
| 文献[22] | 男 | 3男 | 16.0 | 1/月~2/周 | 2.70 | R900S | 乙酰唑胺无效,但曲安替林有效 |
| 文献[23] | 男 | 4男 | - | 2~4/月 | 1.89 | R528C | 补钾有效 |
| 文献[6] | 男 | 4男2女 | 17.0 | 1/年~1/月 | 2.40 | R675Q | 补钾有效 |
| 文献[6] | 男 | 无 | 13.0 | 5~6/年 | 1.60 | R672H | 补钾有效 |
| 文献[24] | 男 | 5男1女 | 20.0 | 0~3/月 | 1.90 | R222W | 补钾有效 |
| 文献[25] | 男 | 3男2女 | 34.0 | 0~3/d | 正常/低钾 | G515R | 乙酰唑胺对血钾正常者有效,低钾者无效 |
| 文献[26] | 男 | 3男1女 | 21.0 | 1~3/月 | 3.30 | R1448H | 补钾、辅酶Q10有效 |
| 文献[27] | 男 | 4男2女 | 5.0 | - | 2.90 | T704M | 补钾有效 |
| 文献[28] | 男 | 3男 | 21.0 | 1/2年 | 2.20 | N820Y | 补钾有效 |
| 文献[29] | 男 | 无 | 16.0 | 首发 | 2.20 | I430V | 补钾有效 |
| 文献[30] | 男 | 3男 | 15.0 | 1~2/年 | 2.80/正常 | R672H | 补钾有效,乙酰唑胺无效 |
| 文献[31] | 男 | 4男5女 | 8.0 | 1/月 | 正常/低钾 | R1129Q | 乙酰唑胺对血钾正常者有效,低钾者无效 |
| 文献[32] | 男 | 3男 | 15.0 | 100~200/年 | 2.50 | R672H | 补钾有效,乙酰唑胺无效 |
| 文献[32] | 男 | 2男 | 12.0 | 30/年 | 2.00 | R672H | 补钾有效,乙酰唑胺无效 |
| 文献[33] | 男 | 3男1女 | 15.0 | 2/3月 | 2.38 | R672C | 补钾有效 |
| 文献[8] | 男 | 2男 | 15.0 | 3~4/月 | 2.78 | R675Q | 补钾有效 |
| 文献[8] | 男 | 2男2女 | 17.0 | 1/年 | 2.80 | R672H | 补钾有效 |
| 文献[7] | 男 | 无 | 16.0 | 1/年 | 2.00 | R672C | 补钾有效 |
| 本研究 | 男 | 2男1女 | 24.0 | 3/2年 | 1.20 | R672L | 补钾有效 |
| 本研究 | 男 | 3男1女 | 14.0 | 1/月 | 2.00 | R672H | 补钾有效 |
| 序列号1~16致病基因为CACNA1S,17~34致病基因为SCN4A. -,不详. | |||||||
| 患者特征 | 总计 | CACNA1S | SCN4A | P |
| 性别(男∶女) | 31∶3 | 12∶3 | 18∶0 | 0.083 |
| 起病年龄(岁) | 15.0±6.2 | 13.0±5.7 | 16.6±6.3 | 0.096 |
| 家族史(有∶无) | 28∶5 | 13∶2 | 15∶3 | 0.591 |
| 发病时血钾(mmol/L) | 2.22±0.52 | 2.11±0.48 | 2.31±0.54 | 0.287 |
3 讨论
HypoPP多为常染色体显性遗传模式,偶见散发病例,患病率为1∶100 000[3-4],但目前国内尚无确切患病率数据,基因检测尤其是高通量测序是诊断HypoPP的一个有效手段。
HypoPP的致病基因包括CACNA1S、SCN4A和KCNJ2以及其他未知基因,国外病例中70%~80%可查到致病基因,但在国内约为10%~50% [5-8]。国内外的致病基因类型差异较大,国外研究[1-2, 9]报道HypoPP的致病基因中CACNA1S基因突变占主要地位(40%~76%),而SCN4A基因仅占7%~24%,国内病例中2种基因的贡献基本相等。
CACNA1S和SCN4A基因编码的2种电压门控通道的α亚单位由4个同源跨膜结构域(DⅠ~DⅣ)组成,每个域包含跨越膜的6个螺旋段:电压传感器域(S1~S4)和孔域(S5~S6),目前发现的大多数突变影响蛋白质所有4个结构域S4段的残基,并导致高度保守的带正电残基精氨酸被带弱电荷或不带电荷的氨基酸取代[3, 10]。大多数与HypoPP有关的SCN4A基因突变位于DⅡ/S4和DⅢ/S4,这些突变分别是该基因第12、18和19外显子中的p.R669H、p.R672S/G/C/H、p.R1129Q、p.R1132Q、p.R1135H/C和p.P1158S[10]。其中SCN4A基因的R672位于DⅡ/S4螺旋跨膜段,是电压感应的关键部位,为该基因中常见的致病位点之一,其连同CACNA1S基因的R528可能为我国HypoPP最常见的突变位点。R672已报道可突变为S/G/C/H,本文病例携带的突变型L在文献中尚未见报道。R672H和R672G突变可以使钠通道稳态失活曲线左移和钠电流密度的降低,从而导致骨骼肌细胞膜兴奋性降低,引起肌无力发作[11]。目前尚无关于R672C/S/L突变的研究,推测带正电荷的精氨酸(R)无论被更大分子的组氨酸(H)替代,还是中性小分子的半胱氨酸(C),甘氨酸(G),丝氨酸(S),亮氨酸(L)替代,都会导致类似的功能改变,降低骨骼肌细胞膜的兴奋性。
HypoPP的治疗目前仍以避免诱因为主,辅以口服补钾预防。国外1项回顾性研究[1]发现对HypoPP1型患者可以试用乙酰唑胺进行治疗,而对HypoPP2型疗效有限。国内病例中有7例尝试了乙酰唑胺的治疗,在HypoPP1型患者中1例有效(共2例),而HypoPP2型患者中均无效(共5例)。一项随机双盲对照的RCT研究[12]证明双氯非那胺对于HypoPP有效,并被FDA批准用于HypoPP。另外在动物模型中证实有效的药物布美他尼[13],陆续已有临床试验进行尝试,有望为HypoPP的治疗提供了更多的选择。
综上所述,本文报道了2例HypoPP患者,并发现了1处位于SCN4A基因新的突变类型R672L。目前对于HypoPP的基因检出率较低,提示可能会存在更多的导致HypoPP的基因突变位点,HypoPP的临床表型和基因类型在国内外有较大差异,提示存在种族特异性。对HypoPP患者需要开展更多的前瞻性研究,为不同基因突变类型患者选择最佳药物治疗方案提供依据。
| [1] |
MATTHEWS E, PORTARO S, KE Q, et al. Acetazolamide efficacy in hypokalemic periodic paralysis and the predictive role of geno-type[J]. Neurology, 2011, 77(22): 1960-1964. DOI:10.1212/WNL.0b013e31823a0cb6 |
| [2] |
LATORRE R, PURROY F. Hypokalemic periodic paralysis: a systematic review of published case reports[J]. Rev Neurol, 2020, 71(9): 317-325. DOI:10.33588/rn.7109.2020377 |
| [3] |
MAGGI L, BONANNO S, ALTAMURA C, et al. Ion channel gene mutations causing skeletal muscle disorders: pathomechanisms and opportunities for therapy[J]. Cells, 2021, 10(6): 1521. DOI:10.3390/cells10061521 |
| [4] |
STATLAND JM, FONTAINE B, HANNA MG, et al. Review of the diagnosis and treatment of periodic paralysis[J]. Muscle Nerve, 2018, 57(4): 522-530. DOI:10.1002/mus.26009 |
| [5] |
LUO SS, XU MJ, SUN J, et al. Identification of gene mutations in patients with primary periodic paralysis using targeted next-generation sequencing[J]. BMC Neurol, 2019, 19(1): 92. DOI:10.1186/s12883-019-1322-6 |
| [6] |
崔云英, 王芬, 李春艳, 等. 低钾型周期性麻痹患者的临床及基因特征[J]. 医学研究杂志, 2016, 45(9): 72-75. DOI:10.11969/j.issn.1673-548X.2016.09.019 |
| [7] |
柯青, 吴卫平. 原发性低钾型周期性麻痹相关离子通道基因突变研究进展[J]. 中国神经免疫学和神经病学杂志, 2006, 13(1): 49-52. DOI:10.3969/j.issn.1006-2963.2006.01.017 |
| [8] |
刘晓黎, 黄啸君, 沈隽逸, 等. 原发性低钾型周期性麻痹致病基因筛查及其临床特征分析[J]. 上海交通大学学报(医学版), 2016, 36(1): 70-75. DOI:10.3969/j.issn.1674-8115.2016.01.014 |
| [9] |
BRUGNONI R, CANIONI E, FILOSTO M, et al. Mutations associated with hypokalemic periodic paralysis: from hotspot regions to complete analysis of CACNA1S and SCN4A genes[J]. Neurogenetics, 2022, 23(1): 19-25. DOI:10.1007/s10048-021-00673-2 |
| [10] |
GROOME JR, LEHMANN-HORN F, FAN CX, et al. NaV1.4 mutations cause hypokalaemic periodic paralysis by disruptingⅢS4 movement during recovery[J]. Brain, 2014, 137(Pt 4): 998-1008. DOI:10.1093/brain/awu015 |
| [11] |
JURKAT-ROTT K, MITROVIC N, HANG C, et al. Voltage-sensor sodium channel mutations cause hypokalemic periodic paralysis type 2 by enhanced inactivation and reduced current[J]. Proc Natl Acad Sci USA, 2000, 97(17): 9549-9554. DOI:10.1073/pnas.97.17.9549 |
| [12] |
SANSONE VA, BURGE J, MCDERMOTT MP, et al. Randomized, placebo-controlled trials of dichlorphenamide in periodic paraly-sis[J]. Neurology, 2016, 86(15): 1408-1416. DOI:10.1212/WNL.0000000000002416 |
| [13] |
WU FF, MI WT, CANNON SC. Beneficial effects of bumetanide in a CaV1.1-R528H mouse model of hypokalaemic periodic paralysis[J]. Brain, 2013, 136(Pt 12): 3766-3774. DOI:10.1093/brain/awt280 |
| [14] |
翟金盛, 李卫巍, 安丽梅, 等. 低钾周期性麻痹家系CACNA1S基因突变的研究[J]. 医学研究生学报, 2012, 25(5): 489-492. DOI:10.3969/j.issn.1008-8199.2012.05.010 |
| [15] |
陈霞, 郑荣秀, 阚璇, 等. 儿童CACNA1S基因突变型低钾型周期性麻痹2例报告[J]. 临床儿科杂志, 2015, 33(12): 1009-1012. DOI:10.3969/j.issn.1000-3606.2015.12.003 |
| [16] |
张萌萌, 潘鑫, 关海霞, 等. 一个家族性低钾型周期性麻痹家系报道[J]. 中国医科大学学报, 2020, 49(9): 798-802. DOI:10.12007/j.issn.0258-4646.2020.09.006 |
| [17] |
王秋芬, 杜戎, 许春胜, 等. 一个遗传性低钾周期性麻痹家系的CACNA1S基因突变研究[J]. 中华医学遗传学杂志, 2006, 23(2): 242-244. DOI:10.3760/j.issn:1003-9406.2006.02.034 |
| [18] |
柯青, 吴卫平, 郭秀海, 等. 一个中国家族性低钾型周期性麻痹家系中的CACNA1S基因R1239H突变[J]. 中华医学遗传学杂志, 2006, 23(3): 272-274. DOI:10.3760/j.issn:1003-9406.2006.03.007 |
| [19] |
陈红丹, 吴峰芬, 牟利军. 一例误诊为肾性失钾的家族性低钾型周期性麻痹家系报道[J]. 中华急诊医学杂志, 2020, 29(2): 284-286. DOI:10.3760/cma.j.issn.1671-0282.2020.02.0034 |
| [20] |
贾白雪, 杨旗, 王涵, 等. 原发性低钾型周期性麻痹患者的基因及影像学研究[J]. 中国神经免疫学和神经病学杂志, 2014, 21(1): 36-40. DOI:10.3969/j.issn.1006-2963.2014.01.010 |
| [21] |
LI FF, LI QQ, TAN ZX, et al. A novel mutation in CACNA1S gene associated with hypokalemic periodic paralysis which has a gender difference in the penetrance[J]. J Mol Neurosci, 2012, 46(2): 378-383. DOI:10.1007/s12031-011-9596-1 |
| [22] |
KE Q, HE FP, LU LP, et al. The R900S mutation in CACNA1S associated with hypokalemic periodic paralysis[J]. Neuromuscul Disord, 2015, 25(12): 955-958. DOI:10.1016/j.nmd.2015.09.006 |
| [23] |
YANG B, YANG Y, TU WL, et al. A rare case of unilateral adrenal hyperplasia accompanied by hypokalaemic periodic paralysis caused by a novel dominant mutation in CACNA1S: features and prognosis after adrenalectomy[J]. BMC Urol, 2014, 14: 96. DOI:10.1186/1471-2490-14-96 |
| [24] |
郭曼丽, 张国文, 马绍刚, 等. 一个家族性低钾型周期性麻痹家系的基因突变研究[J]. 中华医学遗传学杂志, 2018, 35(1): 74-77. DOI:10.3760/cma.j.issn.1003-9406.2018.01.016 |
| [25] |
常明则, 田晔, 黄昱, 等. SCN4A基因G515R新突变致正常钾和低钾性周期性瘫痪一家系报告[J]. 中国神经免疫学和神经病学杂志, 2013, 20(6): 411-414. DOI:10.3969/j.issn.1006-2963.2013.06.008 |
| [26] |
潘学琪, 张炜, 畅雪丽, 等. SCN4A基因p.R1448H突变致先天性副肌强直合并低钾性周期性麻痹一家系报道[J]. 中华神经科杂志, 2019, 52(6): 457-462. DOI:10.3760/cma.j.issn.1006-7876.2019.06.004 |
| [27] |
杨丹, 李海江, 耿嘉, 等. SCN4A基因Thr704Met突变致严重的家族性低钾性周期性麻痹[J]. 中华神经科杂志, 2016, 49(2): 98-101. DOI:10.3760/cma.j.issn.1006-7876.2016.02.005 |
| [28] |
李海燕, 周晓路, 郭纪锋, 等. SCN4A基因新突变致低钾性周期性瘫痪一家系分析[J]. 中华医学杂志, 2020, 100(45): 3622-3625. DOI:10.3760/cma.j.cn112137-20200421-01265 |
| [29] |
何妍妍. 低钾型周期性麻痹的临床特点及散发病例中CACNA1S和SCN4A基因筛查[D]. 衡阳: 南华大学, 2017.
|
| [30] |
陈涓涓, 邹文, 童晓欣, 等. 低钾性和正常钾性周期性瘫痪共存一家系病例的临床、病理及遗传学特点[J]. 中国神经免疫学和神经病学杂志, 2014, 21(3): 199-202. DOI:10.3969/j.issn.10062963.2014.03.012 |
| [31] |
柯青, 徐全刚, 黄德晖, 等. 家族性低钾性周期性麻痹存在SCN4A基因R672H突变[J]. 中华医学杂志, 2006, 86(11): 724-727. DOI:10.3760/j:issn:0376-2491.2006.11.002 |
| [32] |
洪道俊, 栾兴华, 郑日亮, 等. 骨骼肌钠通道α1亚基基因R1129Q新突变导致正常钾和低钾性周期性瘫痪一家系[J]. 中华神经科杂志, 2009, 42(9): 588-591. DOI:10.3760/cma.j.issn.1006-7876.2009.09.006 |
| [33] |
姜蕾, 王卫庆, 朱娜, 等. 一例家族性低钾性周期性麻痹患者的家系报告[J]. 诊断学理论与实践, 2005, 4(1): 69-70. DOI:10.3969/j.issn.1671-2870.2005.01.020 |
 2023, Vol. 52
2023, Vol. 52