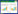文章信息
- 徐珵珵, 马铁, 张莹, 武全, 王哲
- XU Chengcheng, MA Tie, ZHANG Ying, WU Quan, WANG Zhe
- 组织芯片制备仪联合STR检测在葡萄胎病理诊断中的应用
- Application of tissue chip preparator combined with short tandem repeat detection in pathological diagnosis of hydatidiform mole
- 中国医科大学学报, 2023, 52(8): 736-740
- Journal of China Medical University, 2023, 52(8): 736-740
-
文章历史
- 收稿日期:2023-02-12
- 网络出版时间:2023-07-28 11:27:21
葡萄胎(hydatidiform mole,HM)是常见的妊娠滋养细胞疾病,其特征为绒毛水肿变性和滋养细胞增殖[1]。HM可分型为单卵双精型、单精纯合型、双精杂合型等[2-3]。近年来由于B超和人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG)测定的应用,大多数HM在早孕期间即可确诊[4]。但即使终止了妊娠,HM所致滋养细胞肿瘤带来的危险并未改变。
病理组织学检查是目前HM最主要的检查方法。现阶段HM组织病理辅助检查技术主要有免疫组织化学P57染色和短串联重复序列(short tandem repeat,STR)检测。STR属于DNA多态性基因组,在传递基因时为显性遗传[5]。利用STR基因分析比较绒毛组织和母体蜕膜间多个位点的STR多态性,可准确判断双亲基因组的比例、妊娠组织的来源、染色体倍性等遗传信息[6-7]。分离蜕膜组织与绒毛组织从而得到纯净的DNA是STR基因分析能否成功的关键[8]。而传统的分离方法易导致绒毛组织中混入母体蜕膜组织造成污染。本研究回顾性总结分析了90例可疑HM病例的临床病理资料,采用组织芯片制备仪联合STR检测,并对比分析应用组织芯片制备仪前后STR检测的成功率,为HM的诊断提供方法和遗传分子依据。
1 材料与方法 1.1 材料 1.1.1 标本来源收集中国医科大学附属盛京医院2017年3月至2022年9月怀疑HM的90例存档的石蜡标本。收集患者的临床资料,包括年龄、HCG水平以及妊娠时间、流产史等。本研究获得医院伦理委员会批准。所有患者知情同意。
1.1.2 主要试剂及仪器DNA提取和检测试剂盒、五色荧光标记试剂盒(北京阅微基因技术有限公司);P57小鼠抗人单克隆抗体(ZM-0252)、柠檬酸修复液(北京中杉金桥生物技术有限公司);二抗及DAB试剂(美国罗氏公司);苏木素染色液(中国贝索生物技术有限公司)。Applied Biosystems DNA Analyzer(美国应用生物系统公司);阅微基因Gen-Reader基因分析仪(中国北京阅微基因技术有限公司);组织芯片制备仪(TM-1,北京博医康实验仪器有限公司)。
1.2 方法 1.2.1 组织学检查固定处理组织后,完成普通石蜡包埋,同时将其制作为HE切片。每个标本均由病理医师完成组织形态学观察,观察指标包括绒毛大小、绒毛水肿程度、滋养叶细胞增生程度、有无有核红细胞等,并结合病理特征进行类别划分。同时对标本内的蜕膜以及绒毛组织是否符合标准进行评估,以便完成组织分离,保证STR分析能够完成。
1.2.2 传统分离方法根据组织学检查结果,做好标记并选取合格的蜡块,每例连续切片5~10片,切片厚度为5 μm。显微镜下观察,用无菌刀片刮取绒毛组织和蜕膜组织,并收集至无菌管。
1.2.3 组织芯片制备仪分离方法按照HE染色结果,确定绒毛组织和蜕膜组织所在区域,并在蜡块和玻片的相应位置做好标记。为了避免取芯时石蜡块破裂,先将蜡块放在37 ℃温箱中预热15 min。将蜡块置于组织芯片制备仪准备取样。注意应根据所选蜡块上绒毛组织大小采用不同大小的组织芯片制备仪取样头,避免因取样头过大导致采集到除绒毛外的其他组织,造成污染。在选好制备仪的取样头但不确定是否能正确采集无母体蜕膜污染的绒毛组织时,可用黑色签字笔在取样头前稍作晕染后,轻放在蜡块上形成取样头标记,以便既能在蜡块上看到取样头的大小,也可比对蜡块上相应位置的标记,在最终打芯片时也可更准确地找到理想位置。标记过的取样头可用75%乙醇擦净,以备下次使用。
1.2.4 STR基因分型检测及结果判读对2组不同分离方法获取的组织标本行DNA提取和STR基因分型检测。按照试剂盒说明进行DNA提取和检测,并用Applied Biosystems DNA Analyzer及阅微基因Gen-Reader基因分析仪测定DNA浓度和质量。采用五色荧光标记PCR试剂盒多重扩增检测DNA样本中20个STR基因座和1个性别位点。PCR反应体系和反应条件参照试剂盒说明书。应用GeneMapper分析软件进行数据分析。分型标准:通过比较每个STR位点中的等位基因,发现绒毛组织中异常的父源基因,若至少2个STR位点全部是父源性基因,为完全性葡萄胎(complete hydatidiform mole,CHM);如果每个STR位点均出现2个父源性和1个母源性等位基因,为部分性葡萄胎(partial hydatidiform mole,PHM);如果具有双亲的平衡性双等位基因表型,为水肿性流产(hydropic abortions,HA)或二倍体流产。
当分析的组织芯片为2个混合样本时,会出现复杂的STR图谱,谱带的数目取决于组织芯片中所包含的每个样本在这一基因座的基因型。不同的基因型可产生不同的STR图谱,因此可通过吸收峰出现的数目对STR检测成功与否进行确认。组织芯片中的母体细胞污染有2种情况:一种是完全为母体细胞污染,绒毛组织的STR分析和母体基因分型图谱完全相同;另一种是部分母体细胞污染,绒毛组织有多个基因座出现3个峰。
1.2.5 免疫组织化学染色及结果判读石蜡切片脱蜡至水,在水化切片的基础上,柠檬酸高压修复抗原4 min;在室温下自然冷却,用PBS清洗3次;滴加过氧化物酶10 min,以灭活内源性酶;用PBS清洗玻片后,滴加山羊血清并在室温下封闭30 min;甩干后滴加一抗P57,4 ℃过夜;第二天,切片自然复温后滴加二抗,室温孵育30 min,PBS清洗;DAB显色及苏木素复染。细胞核棕黄色染色为阳性。记录绒毛间质细胞和细胞滋养层细胞P57核染色情况。
2 结果 2.1 临床特征本研究共纳入90例可疑HM,妊娠年龄16~52岁,平均29.3岁;孕4~15周,平均9.5周;所有患者均行常规清宫手术,刮宫前血HCG水平8 132~279 400 IU/L。60例患者完成6~24个月回访,随访期间均未复发,也未发展为恶性滋养细胞疾病。
2.2 不同方法对STR检测成功率的影响本研究对90例可疑HM的石蜡标本采用2种不同方法分离绒毛和蜕膜组织。其中,应用组织芯片制备仪STR检测成功86例,成功率95.6%。采用传统方法STR检测成功54例,成功率60.0%。说明应用组织芯片制备仪分离绒毛组织和蜕膜组织大大提高了STR检测成功率。
2.3 STR基因分型检测结果在90例可行STR检测的临床可疑HM患者中,除4例因未能精准分离绒毛组织导致母体细胞污染而失败,其余86例获得了准确诊断与分型,包括HM 67例,非HM 19例。以单精纯合CHM为例,检测结果见图 1。

|
| 图 1 STR检测基因图谱 Fig.1 STR detected gene map |
2.4 分子分型结果
90例组织学诊断疑似HM中,86例成功进行STR分析。分子分型确定为CHM的病例中,单精纯合型CHM 53例(53/86,61.6%),双精杂合型CHM2例(2/86,2.3%);确定为PHM中,仅发现单卵双精型PHM12例(12/86,14%);非HM妊娠共19例,其中HA 16例(16/86,18.6%),三体3例(3/86,3.5%)。组织学诊断与分子分型诊断存在一定偏差,组织学诊断可能导致19例非HM妊娠误诊为HM。
2.5 组织形态学按照不同组织形态学特点对86例HM样本进行分析,主要关注滋养叶细胞增生情况,绒毛间质水肿及绒毛大小,包括有无有核红细胞,见表 1。
| Histomorphologic feature | MCM | BiCHM | DPM | HA | Triploidy |
| Villous size | |||||
| < 0.2 cm | 7(13.2) | 1(50.0) | 8(66.7) | 13(81.2) | 2(66.7) |
| ≥0.2 cm | 46(86.8) | 1(50.0) | 4(33.3) | 3(18.8) | 1(33.3) |
| Villous stroma hydropic | |||||
| Mild | 26(49.1) | 2(100.0) | 6(50.0) | 13(81.2) | 2(66.7) |
| Morderate | 18(34.0) | 0(0) | 5(41.7) | 2(12.5) | 1(33.3) |
| Severe | 9(16.9) | 0(0) | 1(8.3) | 1(6.3) | 0(0) |
| Nucleated red blood cells | |||||
| Exist | 5(9.4) | 0(0) | 7(58.3) | 10(62.5) | 2(66.7) |
| Null | 48(90.6) | 2(100.0) | 4(41.7) | 6(37.5) | 1(33.3) |
| Trophoblastic hyperplasia | |||||
| Mild | 43(81.1) | 2(100.0) | 10(83.3) | 14(87.5) | 2(66.7) |
| Morderate and severe | 10(18.8) | 0(0) | 2(16.7) | 2(12.5) | 1(33.3) |
| MCM,monozygous complete mole;BiCHM,biparents complete hydatidiform mole;DPM,dispermic partial hydatidiform mole;HA,hydropic abortions. | |||||
2.6 染色情况
组织学病理诊断为CHM者可见绒毛水肿增大,中央池形成,滋养叶细胞增生(图 2A),共55例,53例(96.4%)P57染色阴性,2例(3.6%)P57染色阳性。PHM可见绒毛水肿增大,且大小不等(图 2B),共12例,P57阴性2例(16.7%),其余10例(83.3%)P57染色阳性。非HM病例共19例,P57染色阴性4例(21.1%),P57染色阳性15例(78.9%),见图 2C~2F。
|
| A, the hydatidiform tissue of CHM, with partial chorioedema and the formation of a central cistern (×10);B, PHM mole tissue (×10);C, D, complete mole with negative expression of P57 staining in villous trophoblast cells; E, F, partial mole with positive expression of P57 staining in villous trophoblast cells. D and F are enlarged 50 times. C and E are enlarged 10 times. 图 2 CHM、PHM组织HE和P57免疫组织化学染色 Fig.2 HE and immunohistochemical P57 staining for CHM and PHM tissue |
3 讨论
HM是良性疾病,属于滋养细胞病变的一种,但也有可能发展成绒毛膜癌或侵袭性HM [9-10]。PHM发生恶变的概率约0.5%~5%。CHM发生恶变的概率为15%~20%[11],而HA属于自限性病变,且为良性病变。HM病变发生发展的具体机制尚不明确[12]。
近年来,STR基因分析已成为HM等妊娠滋养细胞疾病精准诊断和亚分类的强大辅助工具[13-15]。本研究选用90例较典型的CHM、PHM和部分非HM病例,采用组织学诊断、P57免疫组织化学染色以及STR基因分析3种方式对其进行研究。结果显示,组织学诊断导致19例非HM妊娠误诊为HM,与分子分型诊断存在一定偏差。本研究还发现,P57免疫组织化学检测与STR基因分析结果一致性较高。成功行STR检测的CHM共55例,其中53例(96.4%)P57表达阴性;PHM共12例,其中10例(83.3%)P57染色阳性。但P57只能区分CHM与PHM和HA,而无法进一步分型[16],因此需行STR基因分析以提供更多信息。本研究中,分别采用组织芯片制备仪法和传统方法对90例HM进行STR分型检测,组织芯片制备仪法中86例STR基因分析成功,其余4例因未能精准分离绒毛和蜕膜组织导致STR基因分析失败。而传统方法中有36例因未能精准分离绒毛组织导致检测失败。由此可见,STR基因分析大大提高了HM分子诊断的准确率,而精准分离绒毛组织更是成功进行STR基因分析的保证。
总之,组织芯片是一项经济高效的技术,可精准分离病理标本中绒毛组织,保证了STR基因分析的顺利进行。因此,在临床取材工作中,应尽可能分别装取子宫内膜组织与蜕膜组织和绒毛组织,另外,在切片上分离组织时,应尽可能防止交叉污染,以上是成功检测和分型工作的重点。本研究通过对90例较典型的HM标本的回顾性研究发现,用组织芯片制备仪精准分离绒毛组织和蜕膜组织联合STR基因分析可从源头上避免误诊、漏诊,为准确进行HM分子分型诊断提供了保证,也为HM患者后续的及时精准治疗奠定基础。
| [1] |
荆福祥, 袁雪芹, 史永灿. 短串联重复序列检测技术在部分性葡萄胎诊断中的作用[J]. 肿瘤学杂志, 2018, 24(1): 51-54. DOI:10.11735/j.issn.1671-170X.2018.01.B011 |
| [2] |
STRICKLAND AL, GWIN K. Gestational trophoblastic diseaserare, sometimes dramatic, and what we know so far[J]. Semin Diagn Pathol, 2022, 39(3): 228-237. DOI:10.1053/j.semdp.2022.03.002 |
| [3] |
BUZA N. Gestational trophoblastic disease: contemporary diagnostic approach[J]. Surg Pathol Clin, 2022, 15(2): 197-218. DOI:10.1016/j.path.2022.02.002 |
| [4] |
HECHT JL, BAERGEN R, ERNST LM, et al. Classification and reporting guidelines for the pathology diagnosis of placenta accreta spectrum (PAS) disorders: recommendations from an expert panel[J]. Mod Pathol, 2020, 33(12): 2382-2396. DOI:10.1038/s41379-020-0569-1 |
| [5] |
张良, 王斌, 陈新光, 等. 葡萄胎超声误诊一例并文献复习[J]. 内蒙古医学杂志, 2021, 53(12): 1536-1536. DOI:10.16096/j.cnki.nmgyxzz.2021.53.12.048 |
| [6] |
李烨, 郝春燕, 崔保霞. 葡萄胎妊娠辅助诊断的研究进展[J]. 山东医药, 2021, 61(16): 97-100. DOI:10.3969/j.issn.1002-266X.2021.16.023 |
| [7] |
BUZA N, HUI P. Genotyping diagnosis of gestational trophoblastic disease: frontiers in precision medicine[J]. Mod Pathol, 2021, 34(9): 1658-1672. DOI:10.1038/s41379-021-00831-9 |
| [8] |
陈永峰, 薛荣, 刘璇, 等. 短串联重复序列STR分析在葡萄胎诊断中的作用研究[J]. 现代妇产科进展, 2017, 26(2): 124-128. |
| [9] |
王珺, 陈素文, 安雅楠, 等. 短串联重复序列多态性分析在鉴别妊娠早期葡萄胎和水肿性流产中的临床应用[J]. 生殖医学杂志, 2017, 26(6): 573-577. DOI:10.3969/j.issn.1004-3845.2017.06.013 |
| [10] |
HUI P, BUZA N, MURPHY KM, et al. Hydatidiform moles: genetic basis and precision diagnosis[J]. Annu Rev Pathol, 2017, 12: 449-485. DOI:10.1146/annurev-pathol-052016-100237 |
| [11] |
廖林虹, 曾繁晟, 雷心莉. 短串联重复序列分型检测在葡萄胎诊断中的临床应用研究[J]. 现代医药卫生, 2020, 36(14): 2152-2156. DOI:10.3969/j.issn.1009-5519.2020.14.007 |
| [12] |
李学锋. 水泡状胎块的分子病理诊断与研究进展[J]. 临床与实验病理学杂志, 2018, 34(11): 1243-1246. DOI:10.13315/j.cnki.cjcep.2018.11.015 |
| [13] |
ELIAS KM, BERKOWITZ RS, HOROWITZ NS. State-of-the-art workup and initial management of newly diagnosed molar pregnancy and postmolar gestational trophoblastic neoplasia[J]. J Natl Compr Cancer Netw, 2019, 17(11): 1396-1401. DOI:10.6004/jnccn.2019.7364 |
| [14] |
MUCH M, BUZA N, HUI P. Tissue identity testing of cancer by short tandem repeat polymorphism: pitfalls of interpretation in the presence of microsatellite instability[J]. Hum Pathol, 2014, 45(3): 549-555. DOI:10.1016/j.humpath.2013.10.022 |
| [15] |
HAN LM, GRENERT JP, WⅡTA AP, et al. Prevalence of partial hydatidiform mole in products of conception from gestations with fetal triploidy merits reflex genotype testing independent of the morphologic appearance of the chorionic villi[J]. Am J Surg Pathol, 2020, 44(6): 849-858. DOI:10.1097/pas.0000000000001466 |
| [16] |
XING DY, ADAMS E, HUANG JL, et al. Refined diagnosis of hydatidiform moles with p57 immunohistochemistry and molecular genotyping: updated analysis of a prospective series of 2217 cases[J]. Mod Pathol, 2021, 34(5): 961-982. DOI:10.1038/s41379-020-00691-9 |
 2023, Vol. 52
2023, Vol. 52